八、载药微球临床试验研究 临床试验(ClinicalTrial),指任何在人体(病人或健康志愿者)进行药物的系统性研究,以证实或揭示试验药物的作用、不良反应及/或试验药物的吸收、分布、代谢和排泄,目的是确定试验药物的疗效与安全性。 临床试验一般分为I、II、III、IV期临床试验和EAP临床试验。 载药微球 I期 临床试验 包括初步的临床药理学、人体安全性评价试验及药代动力学试验,为制定给药方案提供依据。包括:耐受性试验:初步了解试验药物对人体的安全性情况,观察人体对试验药物的耐受及不良反应。 药代动力学试验:了解人体对试验药物的处置,即对试验药物的吸收、分布、代谢、消除等情况。 
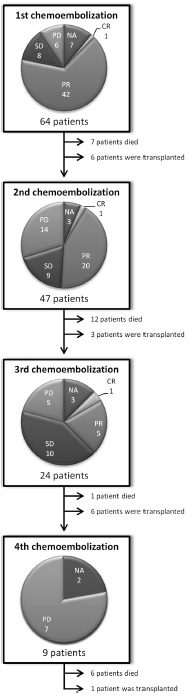
1. 64 patients /144 sessions OR=67.5% after first session, 44.5% and 25% after the 2ND and 3RD
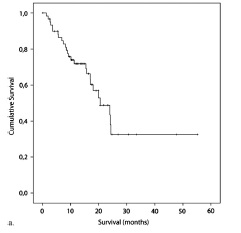
2. median overall and transplant-free survival of 20.5 months and 18 months respectively
3. PES in 85.9% with no grade 4 adverse events【14】
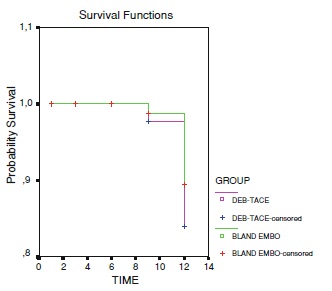
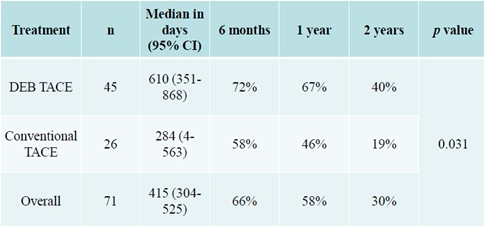
一项被广泛引用的研究是Malagari 等人【10】探讨在BCLC分期中B期肝癌治疗,肝动脉化疗栓塞中化疗(TACE)的补充作用。有关这一研究非常重要。首次以随机对照的方式证明了化疗对肝癌的潜在有效性。因为近来证据表明,缺氧或肿瘤不完全栓塞是血管生成的潜在刺激因素。还没有任何文章提供一级证据确定肿瘤化学治疗的价值。假设由于药物洗脱微球TACE是标准化和可重复的,那么与非载药TACE治疗的比较可以很容易(readily)显示化学治疗的价值。 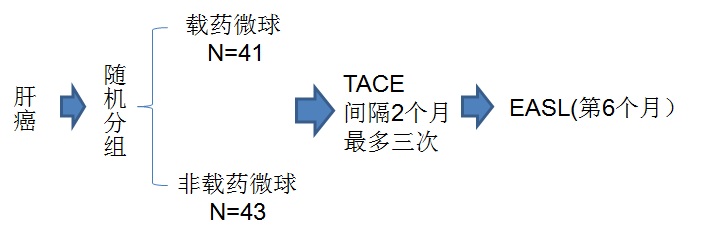
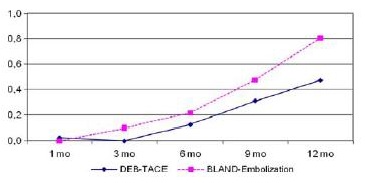
Chemoembolization vs Bland Embolization(单纯栓塞),结果显示
• Local response. Overall Response (p=0.04)
• Fewer recurrence at 9 months (p=0.002)
• Longer TTP (p=0.008)
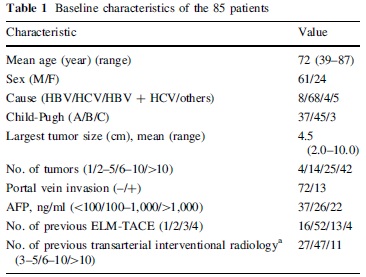
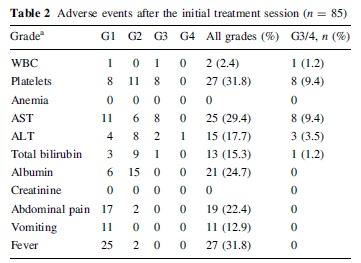
拯救性de-TACE(salvage transcatheter arterial chemoembolization with drug-eluting microspheres)【15】用于对C-TACE抵抗的患者 
• 50 to 100 μm of same composition and nature as Hepasphere & 25-30mg epirubicin
• 135 patients with advanced HCC, refractory to c-TACE
• overall 1- and 2-year survival :73.7 and 59.0%, respectively
• At 6 months : CR=3.5% ; PR=36.5% ;SD=17.6% and PD=42.4%
• 31.8% PES of grade 1 or 2
载药微球 II 期 临床试验 治疗作用初步评价阶段。其目的是初步评价药物对目标适应症患者的治疗作用和安全性,也包括为III期临床试验研究设计和给药剂量方案的确定提供依据。此阶段的研究设计可以根据具体的研究目的,采用多种形式,包括随机盲法对照临床试验。Ⅱ期试验必须设对照组进行盲法随机对照试验,常采用双盲随机平行对照试验(Double-Blind, Randomized, Parallel Controlled ClinicalTrial)。 载药微球的 III 期 临床试验 治疗作用确证阶段。其目的是进一步验证药物对目标适应症患者的治疗作用和安全性,评价利益与风险关系,最终为药物注册申请的审查提供充分的依据。试验一般应为具有足够样本量的随机盲法对照试验。 载药微球的 IV 期 临床试验 早期队列临床研究
Studies comparing conventional and drug-eluting beads transarterial chemoembolization in hepatocellular carcinoma patients
 Johannes Lammer, MD, FSIR, EBIR, FCIRSE 是奥地利 维也纳大学医学院退休教授。自2005年任该校心血管和介入放射科教授至2015年。他是很多国际医学会的名誉会员。 FSIR:Finnish Society of Interventional Radiology;Fellow of Society of Interventional Radiolgoy EBIR:European Board of Interventional Radiology FCIRSE:欧洲心血管和介入放射学会会员 为了比较载药微球TACE和常规碘油TACE的安全性和有效性,Lammer 【11】领导了第一个关于荷载表阿霉素的载药微球(DC-Bead)临床随机对照研究,即所谓PRECISION V Study  】 】19个中心 ,5个国家(法国、德国、瑞士、奥地利和希腊)
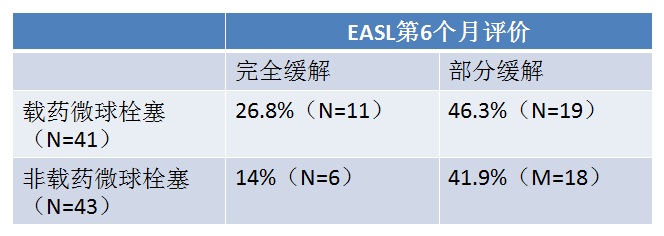
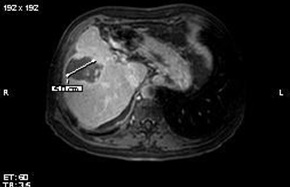
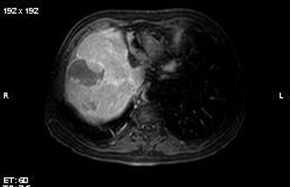
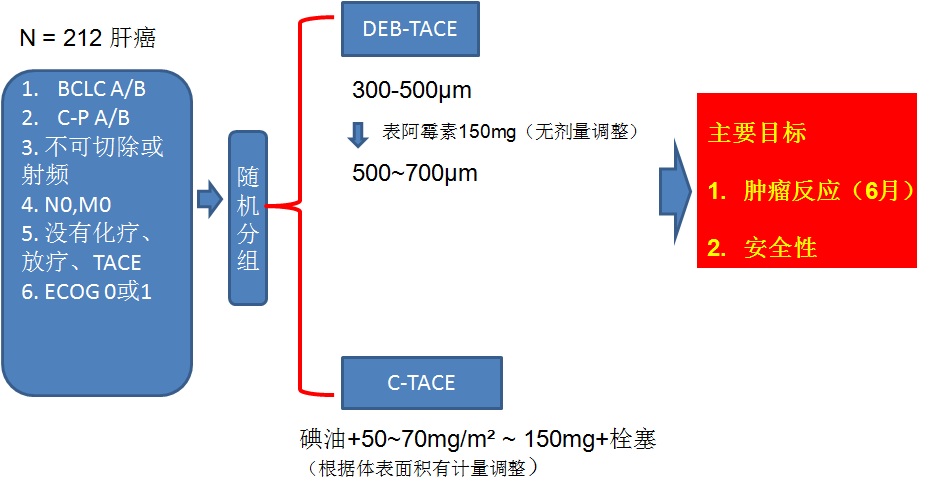 两组治疗间隔为2个月,最多接受三次TACE,在第6个月随访。栓塞终点是栓塞显影剂,在肝左或肝右动脉的2、或3级分支停滞。 主要疗效终点 肿瘤反应率(EASL标准)由MRI评价(poiled gradient-echo T1-weighted sequence 和 fast spin-echo T2-weighted sequence with fat suppression. A dynamic multiphasic, contrast-enhanced, spoiled gradient-echo T1-weighted sequence with arterial, portal, equilibrium, and delayed phase was performed. ),双盲独立评估。
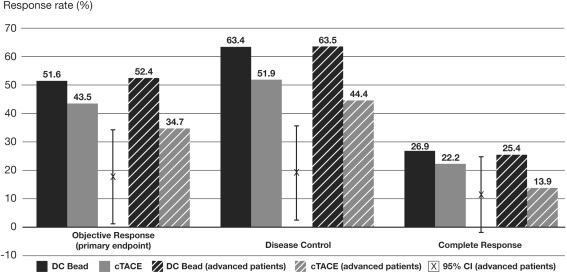
Precision V 临床实验显示 6个月的肿瘤反应率(p=0.11)
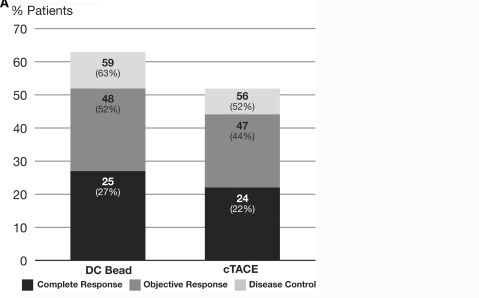
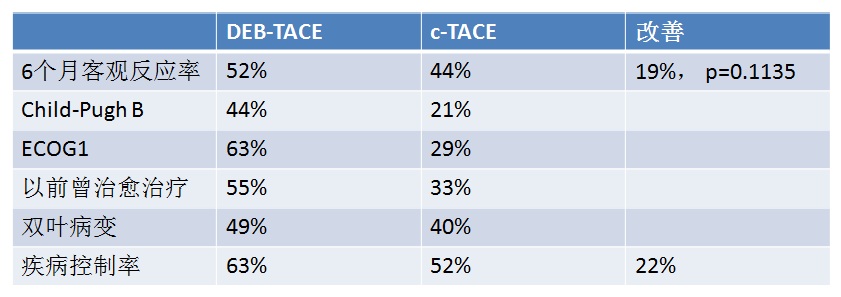
LOCF( last-observation-carried-forward):末次观测值结转法 为处理在一个点后疗效收集中断的情况,一个被广泛使用的方法是沿用末次观测值结转(Last observation carried forward, LOCF)的方法。这一分析采用最后一次得到的疗效反应作为其自身的终点,不一定要遵循具体的研究时点。 所有病人在6个月时的完全反应、客观反应率和疾病控制率
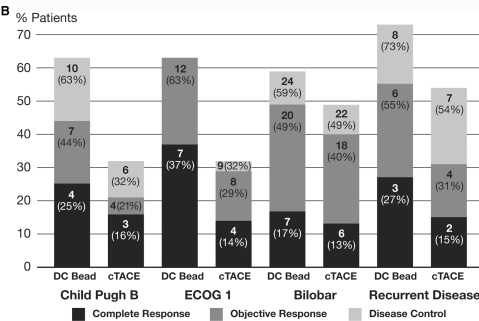
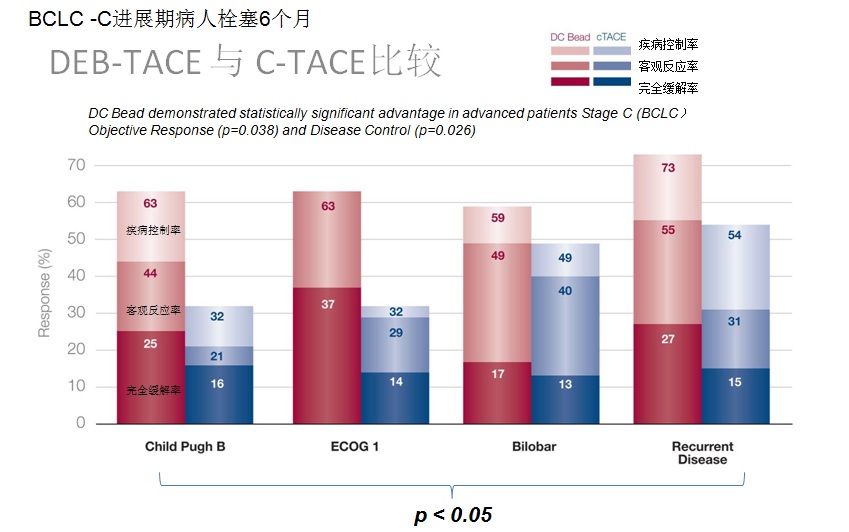
advanced disease 分层后的病人完全反应率、客观反应率和疾病控制率
6-Month Response in More Advanced Patients
c-TACE vs DEB-TACE
 1. 统计学上客观反映率比较cTACE,DC-Bead的优势没有得到证实。 2. 高反应率(Higher response rate)DC-Bead超过cTACE。 3. 值得注意的是尽管较高的表阿霉素的平均总剂量,但肝毒性显著的减少,比较cTACE,经治医生可以应用较高剂量的表阿霉素。 4. “脱发",化疗最常见的并发症DC-Bead 病人几乎没有 5. TACE的优势可以治疗更为晚期的病人 6. 不能耐受cTACE的病情较重的病人,将从DEB-TACE中获益。 以上是DC-Bead 的客观反应率,那么Hepasphere 又如何呢? 
• 50 patients, Hepasphere 50-100 loaded with doxo or epirubicin
• HCC of a mean diameter of 42.5mm
• No periprocedural complications
• 18% PES
• 2% pancreatitis
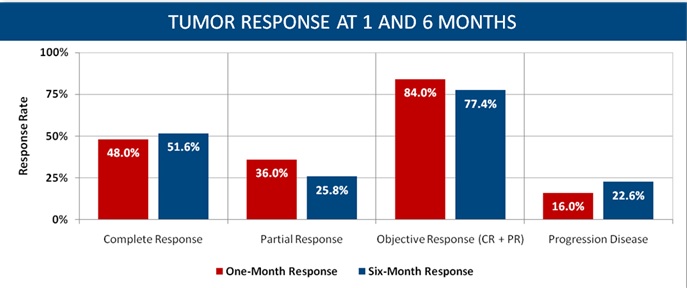
• PR in 36%, SD in 16%, no PD one month post
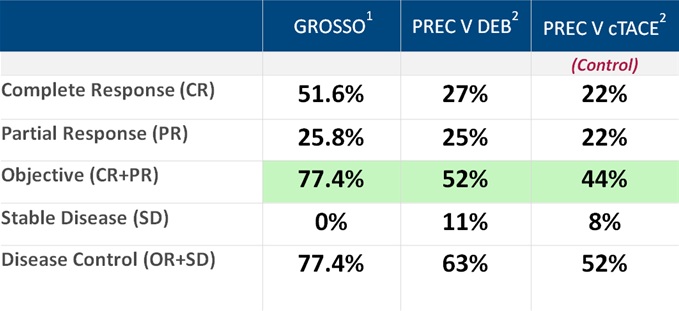
• CR in 51.6%, PR in 25.8% and PD in 22.6% at 6 mo
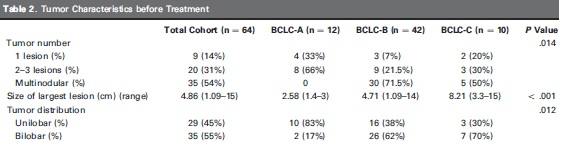
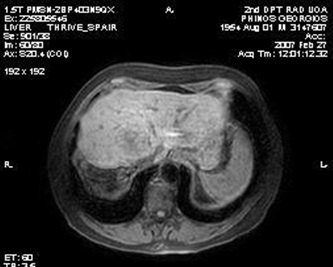
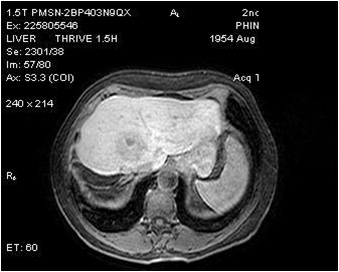
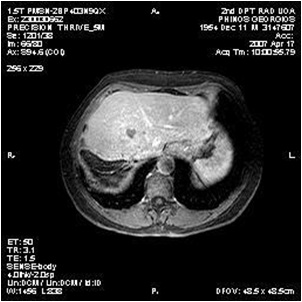
意大利Grosso 等人进行了一项50例不可切除肝癌的多中心的研究【11】。其中92%为Child - Pugh A,50mg表阿霉素/次,部分多次治疗。客观反应率(mRECIST)在第六个月为77.4%。
Grosso 等人的研究虽然现在看来有些早期和初步的研究,但在当时给人们留下一些关键的信息包括: HepaSphere/多柔比星载药微球
2. 若重复治疗,HepaSphere/多柔比星严重并发症发生率低 3. HepaSphere的实验比DC-Bead 实验应用的剂量低 4. 每次治疗仅仅需要一个安瓶
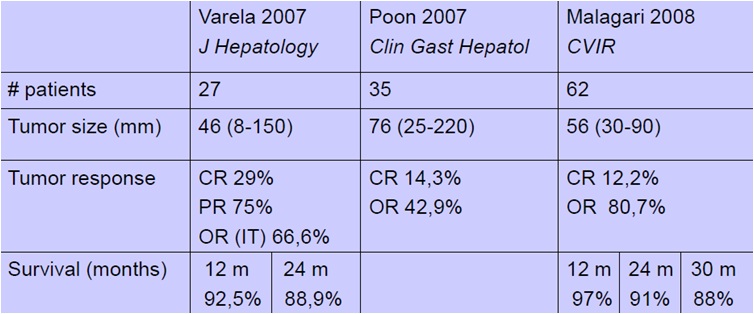
几个临床试验的比较
完全缓解
DEB-TACE的结果 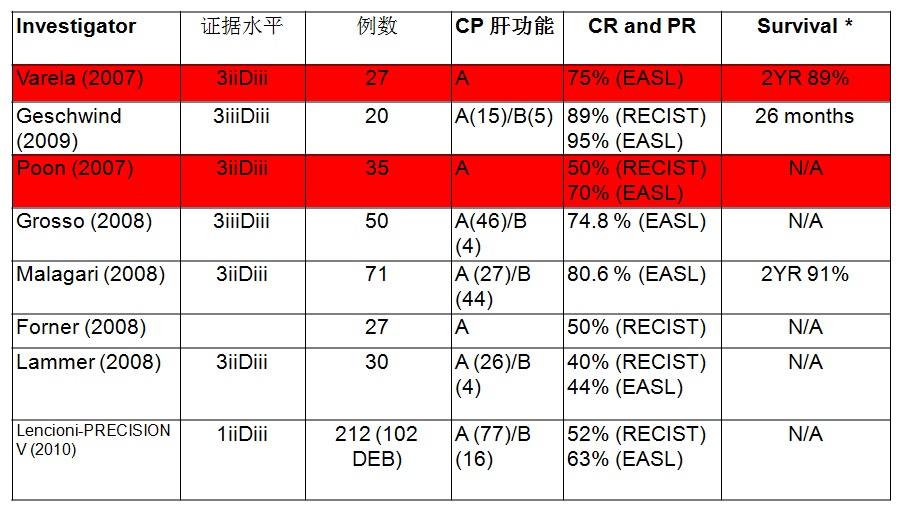
*DEB vs TACE: p=0.11.
DEB advantage for CP B/ECOG 1/bilobar or recurrence: p= 0.038. Fewer dox side effects: p=0.0001
ASCO 2009
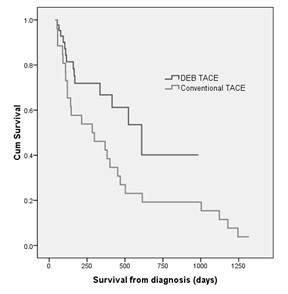
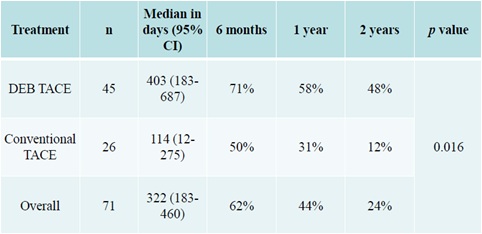
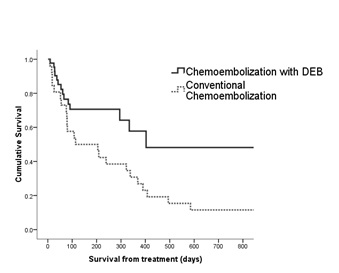
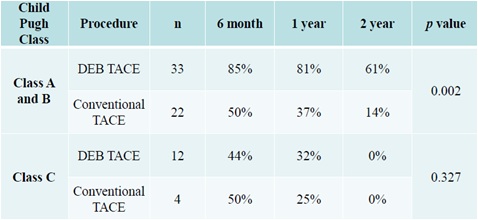
但仍有韩国学者证实DEB-TACE好于C-TACE
非常晚期病人的DEB-TACE 关于转移癌的疗效 结论: 1. 阿霉素荷载微粒:原理得到证实
2. 扩大传统TACE的适应症
3. 良好的药代动力学特征 4. 最小的全身毒性 5. 肿瘤反应率大于传统的TACE 6. DEB-TACE在术后生存率的优势没有超过传统TACE( BCLC B-C) (责任编辑:Mr.Editor) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

|












 评论加载中...
评论加载中...