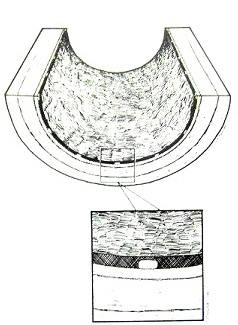
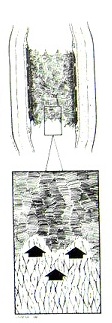
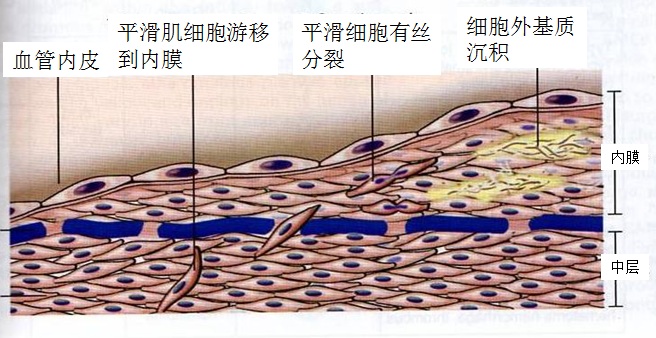
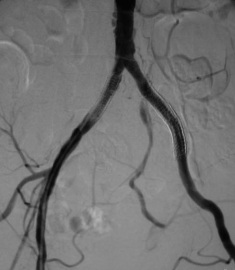
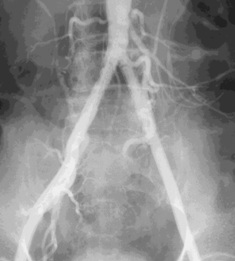
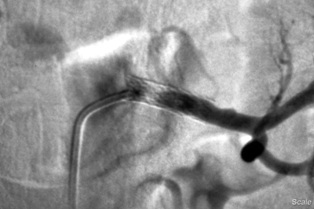
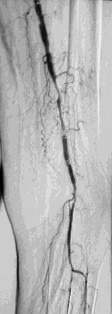
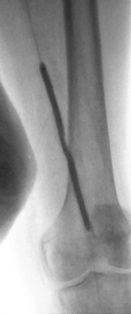
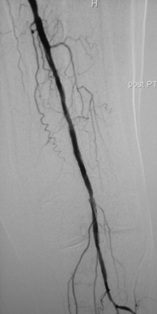
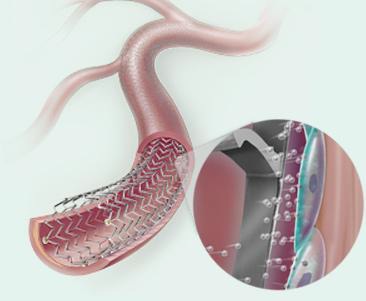
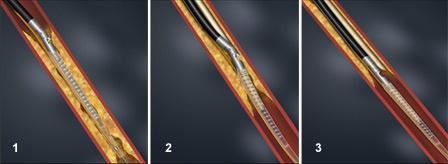
慢性并发症包括: 1. 支撑架内再狭窄:作为一种后期临床并发症,被治疗血管段可以发生再狭窄,尤其是直径较小的血管如股掴动脉,还有以前阻塞过的病变,较长的病变。大多数的狭窄可以通过PTA、局部溶栓治疗、以及直接斑块吸除而成功的得到治疗。但是开放的时间有限。 在介入放射学历史上,血管机械再通技术是由单纯的血管扩张开始的。但这种传统的血管扩张(angioplasty)的负性重构(Negative remodeling)重要的病理改变是再狭窄的发生。人们开始转为支撑架的血管内植入。而支撑架的植入后仍然会发生支撑架内的狭窄其主要是由于内膜增生导致血管内腔直径减少,以及平滑肌增生和细胞外基质的沉积构成支撑架内坚韧的纤维组织增加。
下肢血管的开放对于患者十分重要,因为可以减少严重肢体缺血导致截肢的潜在可能,至少可以推迟它的发生。大部分病人可以缓解间歇性跛行的症状提高患者的生存质量。一般来讲代表临床成功的血管开放的客观测量其实并不需要。 对于预期生命有限的患者,发生支撑架植入后再狭窄的临床重要性较小,但暂时的血流增加通常可以充分地缓解休息疼(rest pain)或溃疡组织的愈合。尽管供血动脉再阻塞,病人缺血的症状和体征并不反复。 而对于复发性严重间歇性跛行的患者,支撑架植入后再狭窄则会体验显著的生活质量的下降,应该考虑合适的治疗,通常倾向于血管内的治疗。
髂动脉 髂动脉支撑架内再狭窄(in-stent restenosis,ISR)达25%,影响开放的因素包括流出血管(run-off vessel)质量差,缺血严重,病变段太长,当然这些很难区别是否为动脉硬化性疾病的进展。 髂动脉再狭窄的临床影响往往导致长期持续性或间歇性跛行的重大改善不再被期望,病人更喜欢保守治疗。恰当的重复性血管内治疗往往好于外科旁路移植手术[1]。
主动脉分叉支架 主动脉分叉支撑架狭窄的临床影响是判断対吻支撑架(“Kissing” stent)的血流动力学和病理学影响,其实是不清楚的。较小主动脉早期対吻支撑架再狭窄可能是自由浮动的近端支架内或两支架从上到下的间隙内的内膜增生和机化血栓,以及两支撑架的直径差异[3]。
主动脉分叉对吻支撑架2年初始开放率(primary patency)为61%~80%,2年协助开放率(assisted primary patency)69%~98%。超过2年的数据还没有一致的意见,所报告的结果也不一致。狭窄复发导致复发性重症间歇性跛行(lifestyle-limiting claudication,LLC),年轻女性主动脉发育不全综合症有急性血栓形成的危险。
对于主动脉分叉对吻支撑架的再狭窄的治疗策略究竟是保守治疗还是采用积极的方式[2]。
股腘动脉 股腘动脉>10cm病变,单纯扩张(PTA)1年内再狭窄率>70%。早期支撑架设计的临床应用获益并不确定,但后期钛镍合金支撑架技术改善了支撑架的耐久性。对于TASC分期中C 和D 期的长段病变首选支撑架植入已经成为现实。钛镍合金支撑架具有独特机械性能,可以减少钛镍合金表面的致血栓性。病变长度,治疗长病变的支撑架和血管的流出道(runoff)与再狭窄的关系还不十分清楚[4]。 一旦发生支撑架内的再狭窄病人会重新体验治疗前的症状,但尽管如此病人的生活质量(QOL)仍然会得到改善。这一现象的主要影响因素包括侧支循环形成,加强的内科治疗(抗血小板药),生活方式的改变以及参与锻炼的项目[7,8]。 钛镍合金支撑架植入后支撑架内再狭窄比较其术前的情况,仅有少部分病人临床恶化[9]。这种固有的安全界限(inherent safety margin)允许更自由地应用血管内支撑架,甚至在TASC分期中的D病变。
腘以下动脉 对于腘以下动脉再狭窄的临床影响取决于其长期的开放,而单纯PTA,1年时再狭窄发生率>70%,经常导致严重下肢缺血(critical limb ischemia,CLI)故态复萌。往往需要反复的血管扩张。遵循以往在冠状动脉的成功经验,目前正在寻求支撑架或药物洗脱支架在腘以下动脉的临床应用[10~12]。 尽管对于长期肢体拯救(long-term limb salvage)的影响不大,但肢体拯救可以高达被治血管的开放率的两倍。3个月后绝大多数动脉溃疡可以治愈。失败多数是由于,不可逆的缺血,正在发生的感染,流出道血流(足部)太差以及再通血管的数目。 肾动脉狭窄: 肾动脉支撑架植入后再狭窄的发生率10%~40%(3~50个月)。其对临床的影响取决于再狭窄的定义,所应用的影像技术和肾动脉血管或支撑架的直径[23]。肾动脉支架内再狭窄的原因主要是继发于内膜增生的进展,支撑架直径不合适,抗血小板治疗失败以及罕见的支撑架断裂。尽管肾动脉支架内狭窄可以导致高血压,但有些病人的顽固性高血压却是由于肾功能衰竭导致的肾性高血压而非肾血管性高血压。 个别病人倾向于肾动脉支撑架植入后过度和活跃的新生内膜增生,除非这一过程被阻止,这种增生最终导致支撑架内的再狭窄。为了防止反复失效,需要另外的测量而不是刚刚扩张完一个严重的狭窄后[21]。至少第二次肾动脉支架内再狭窄治疗是简单和安全的。PTA、裸金属支撑架、覆膜支撑架或药物洗脱支撑架可以提供一个相对长期的开放。但是,切割球囊的血管成形术的复发率非常高[22]。
颈动脉支架内再狭窄: 还没有足够的文献证实有或没有复发性颈动脉再狭窄病人中风的相对危险的区别。但颈动脉剥脱术后复发性狭窄的过程似乎是良性的。ACAS研究显示后期中风与颈动脉复发性狭窄之间没有相关性。颈动脉支架内再狭窄治疗的适应症还没有清楚地被定义。 颈动脉支撑架内狭窄血管内治疗比较周围血管并发症发生率低。对于需要进行重复干预治疗的病人可以进行脑保护装置下的PTA,CBA以及支撑架植入。CBA(切割球囊血管成形术)的应用技术成功率高,较少需要新支撑架的再次植入[24]。 32个医学中心的 ALKK CAS注册研究 显示3722例颈动脉支撑架病人中有3655例(97.5%)病人有新生的狭窄(de novo stenosis),仅有93例(2.5%)预期进行颈动脉支撑架再狭窄的干预治疗。而再狭窄重复治疗的病人较少可能是由于症状性病变(22.7 vs 40.1%,p=0.001),在再狭窄病人中较少溃疡和严重的钙化,比较新生病变(de novo lesion),颈动脉支撑架内狭窄的脑血管事件发生率低。
支撑架内狭窄的治疗 支架内再狭窄的治疗主要是常规的支撑架内血管扩张(PTA)或者在支撑架内植入一个支撑架。但这一方法距离理想的解决方案还差得远。重复支撑架的置入(支撑架三明治,STENT SANDWICH)可以获得短期的技术成功率,但由于过度扩张血管,潜在挑起进一步的新生内膜的反应。如果传统血管内治疗方法治疗周围血管支撑架内再狭窄的效果不好,对于复发积极的治疗就是外科血管旁路移植术。
覆膜支撑架也在支架内再狭窄解决方案的考虑之中
药物洗脱球囊(Drug-coated balloons)具有潜在的均匀一致的药物释放到血管壁,可以立即释放药物而不需要聚合物。可以单独应用药物洗脱球囊,也可以联合裸金属支撑架的应用,随后没有异物留置于体内,潜在减少抗血小板药的治疗[15,16]。 有关动脉斑块切除包括直接动脉斑块切除(Silverhawk Plaque Excision System),激光动脉斑块切除(CLIRpath Excimer Laser)等,即刻效果较好,远期随访并不理想[17]。
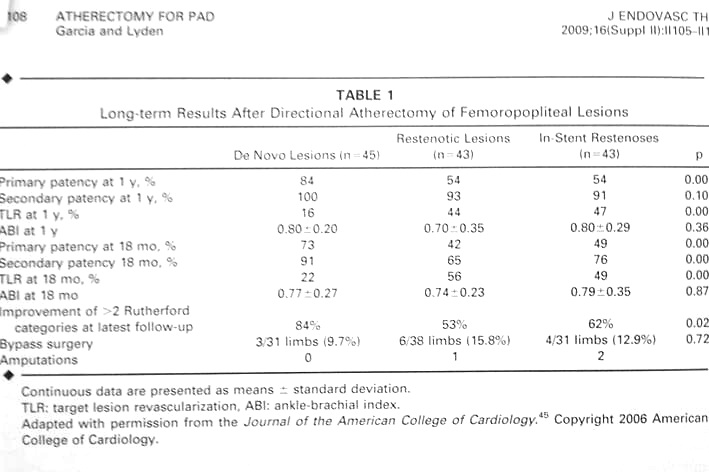
上表为Silverhawk Plaque Excision System 结果
Banning 等在1980年,Barath等在1989年分别首次提出和改进将粥样硬化的动脉内表面纵行切开后再扩张的设想。在球囊扩张时, 逐渐显露于球囊表面的刀片,扩张并纵向切开粥样斑块或血管壁内侧面, 深度可达基层。血管扩张完成后, 刀片可在回抽球囊内时陷入球囊凹陷中, 这样在回撤切割球囊时就不会损伤正常的血管壁。现在临床应用的切割球囊尺寸不一。 切割球囊在治疗支架内狭窄的机制主要包括可以通过支架的杆的挤压(extrusion),增生的内膜纵向再分布到临近的血管段,使支撑架重新扩张的适当的程度。
有关切割球囊在冠状动脉的应用非常广泛,不属于本栏目讨论的范围。在非冠状动脉的应用尚处在小样本的报告中。
甚至以现代支撑架技术,中期支撑架内再狭窄仍然是个大问题,支撑架长期开放并不是发生在每一个病例。虽然在大多数情况下这一过程相对良性。但由于病理条件下各个靶血管的血管床(vascular beds)不同,有些支撑架内再狭窄可能为“恶性”的,包括弥漫性,增生性和完全阻塞。通常支撑架内再狭窄和病情进展是同时发生的,我们治疗再狭窄通常都是治疗疾病本身。 治疗非冠状动脉支撑架内再狭窄的文献资料非常有限,也没有同行审评的出版物或深入随访研究关注这一特殊的情况。目前所应用的治疗方法并没有导致满意的临床结果,未来需要持续的研究和技术革新,未来需要关注Atherectomy,Laser ablation,cutting balloons,Viabahn with PROPATEN coating,DES,BCS的技术发展和临床进展,如何预防支撑架狭窄也是这一领域的关键。 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||