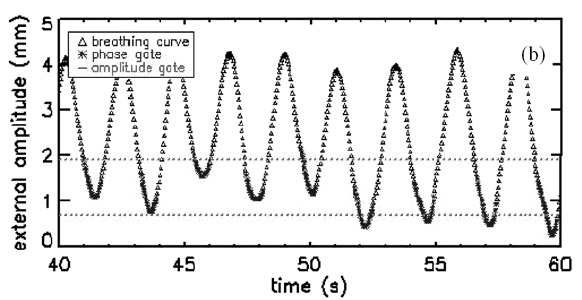
可以用皮肤上标记,也可以植入体内。还有其它如肺活量测定(spirometry)和 张力传感器(strain gauge)
外置标识
内置标识 植入标识物到肿瘤内或接近肿瘤
Since tumor ablation is a 3D volumetric process, methods that determine tumor volumes and that distinguish tumor from peritumoral ablation changes may be useful (144). For example, volumetric measurements may be useful in identifying treatment failure if the ablation zone is not larger than the tumor (145). Volume and size measurements after the initial therapy set a new baseline size and may be very useful for future comparisons. If there is growth after this new, posttherapy baseline, then there should be concern for recurrence.
Newer imaging techniques may provide an opportunity for improved assessment of the posttherapy tumor bed. These techniques include MR diffusion imaging, MR spectroscopy, CT and MR perfusion imaging, contrast-enhanced US, and PET imaging, as described below.
经导管手术后的早期评估,可资助的造影剂分布的分析。栓塞材料的吸收,用碘油或造影剂荷载的栓塞微球,栓塞治疗后的即刻图像可以是判断TACE后或单纯栓塞的指标。不同的吸收模式,如均匀吸收或不完全吸收与病理上坏死的结果相关【132】。 经导管手术后的系列影像学检查中典型的影像学发现包括肿瘤增强的丧失,有或没有肿瘤大小的减少。局灶性增强的区域被认为是余或复发性肿瘤【133,134】。其他的成像技术,如磁共振弥散成像,被用来帮助治疗后的解释,描述如下。 在2000年,实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)指南是由一个国际共识小组的建立【135】。这些标准成为评估肿瘤化学治疗反应的标准,包括测量所谓的靶病变单个最长的直径的变化。虽然这些标准已被成功地用于评估全身化疗的疗效判定的标准,当评估介入肿瘤治疗时,RECIST的标准并不实用,例如,消融后,不管CT或/和磁共振图像,被治疗肿瘤加上周围的消融组织的图像的变化往往大于那些治疗前的肿瘤。因此,由于消融区的目标范围是要大于肿瘤(以确保肿瘤边缘的微观疾病的破坏)【39】和消融引起周围出血,水肿和炎症,肿瘤的大小明显增加,在影像上可能与肿瘤没有什么区别【136 - 138】。单个最长径的测量肿瘤将会错误地显示肿瘤生长,而不是成功的治疗。同样,在经导管栓塞治疗后,也有可能被治疗的肿瘤没有大小变化,但在肿瘤增强中经常有变化。因此,RECIST标准不能适用于大多数肿瘤介入治疗的疗效判定。RECIST面临的这些挑战一直以来被认识和承认。有关肝脏肿瘤研究的巴塞罗那–2000和欧洲协会(EASL)会议的结论指出,肿瘤坏死并不总是平行于肿瘤直径的减少。该研究小组建议,肿瘤反应的评估应该反映出治疗后肿瘤坏死部分所占比例,可根据增强CT或MRI扫描中,非增强面积大小【139】。具有讽刺意味的是,一些较新的靶向药物也导致肿瘤发生坏死而无直径的变化。所有这些都进一步限制了RECIST标准的应用【140】。根据肿瘤在CT衰减后治疗Choi标准提供一种替代传统的RECIST标准【141】。除了简单的尺寸标准都明确要求评估治疗反应的方法【142】。改良RECIST评估考虑了肿瘤的增强最近被审查的肝细胞癌【143】。 由于肿瘤消融是一个三维立体的过程,确定肿瘤容积的方法和区别肿瘤与肿瘤周边组织消融的变化是有意的【144】。例如,在确定治疗是否成功时,如果消融区小于肿瘤,容积测量可以是有用的【145】。初始治疗后的容积和大小测量可以设置一个新的基线大小,并为未来的再治疗进行有益的比较,如果有新的,治疗后基线增长,就应该考虑复发。
新的成像技术可以提供的治疗后瘤床改进评估机会。这些技术包括磁共振扩散成像技术,磁共振成像技术,磁共振成像技术,磁共振成像技术,增强扫描成像技术,增强扫描成像技术,以及成像技术,如以下描述。
弥散加权磁共振成像(Diffusion-weighted MR imaging)是用来评估组织中的水分子扩散的一种技术。存活的肿瘤细胞有膜,限制水的运动,因此限制扩散,而经治疗坏死的肿瘤细胞膜遭遇破坏,增加水的运动,水因此而自由扩散。所以表观扩散系数可以预计在坏死区域比在残存肿瘤区域要高。这项技术已经被应用于化疗栓塞,放射性栓塞和热消融治疗的患者【135,146,147】。然而,弥散的评估在受呼吸运动影像的器官,或在磁化率(magnetic susceptibility)低的器官,如在肺内的空气【148】。 应用氢质子磁共振波普(Hydrogen 1 MR spectroscopy)评估胆碱水平是判定肿瘤介入治疗后残存肿瘤的另一种方法。胆碱是细胞膜生物合成的重要组成部分。胆碱水平升高与细胞增殖的增加相关。与残存肿瘤区域相比较,被治疗肿瘤坏死的区域被认为胆碱水平低【149】。 许多CT和MRI增强和灌注技术应用于肿瘤成像以提供额外的肿瘤生理信息。动态对比度增强技术测定特定区域造影剂增强率,已确定残存肿瘤。在一项研究中,这项技术显示消融后前列腺癌复发比其他磁共振技术更敏感【150】。动脉自旋标记磁共振成像(Arterial spin-labeling MR imaging)是用于测量某一个特定区域灌注另一种方法,而无需使用造影剂【151】。所有这些技术都试图增加CT和磁共振成像生理信息。 与CT或磁共振成像相似,造影剂已被用于超声评估消融后残存肿瘤。在某些临床研究中,超声评估的结果可以与影像CT及磁共振成像【152】相媲美。超声微泡造影剂,标定的配体连接到微泡壳的研究可以确定介入术后残存的肿瘤。在小鼠肿瘤模型中,血管生成受体已采用这种受体标记的微泡超声靶向成像【153】。 FDG-PET显像可用于提供癌症患者的生理信息,以确定是否存在残留或复发性病变。事实上,PET(Positron Emission Tomography)肿瘤治疗反应标准被称为PERCIST(PET Response Criteria in Solid Tumors)已经在最近提出的【153】。然而,由于治疗后炎症和治疗后残余癌都可以有FDG摄取增加,FDG显像具有局限性【154】。新的PET示踪剂可以增加特异性,可以用来区分治疗后炎症或肿瘤残余病变。胆碱,如上所述作为细胞增殖一个标记物,和其他代谢物与正电子发射同位素标记来检测肿瘤增殖【155】。特异性靶向癌细胞的抗体,也可以与PET的同位素标记【156-157】。这可以增加了成像的特异性可用于评估对治疗的反应。
总之,当今医学影像学的进步,使介入肿瘤学领域成为癌症患者治疗的一个重要的组成部分。以前、现在和将来影像学在诊断和治疗过程中扮演重要角色。肿瘤学成像可以进行介入治疗的术前规划,术中定位、术中监测和治疗的控制,和治疗后的评估。由于被用来治疗病人的新技术和新方法涌现,其所承担的每个角色都在迅速发展。随着影像设备针对肿瘤介入治疗的专门化,介入肿瘤学的任务将变得更安全,更有效。 |