| Ikeda M 2005;Yang TS 2004】。其他组合如表柔比星,顺铂和5-FU (ECF)方案或卡培他滨和顺铂也已进行了评估。联合用药往往有较高的有效率,但由于患者数量较少,这些研究无法得出明确的结论【Boucher E 2002】。
评价晚期结直肠癌常用的奥沙利铂、5-FU、亚叶酸钙(FOLFOX)和卡培他滨、特别是奥沙利铂(XELOX)在晚期肝癌中的应用。在一项随机III期研究中,FOLFOX与单药阿霉素相比,ORR (8.2% vs. 2.7%, P=0.02) 和PFS (中位PFS: 2.9 vs. 1.8个月,P≤0.001)均有改善,但OS(中位OS: 6.4 vs. 5.0个月,P=0.07)无显著增加趋势【Qin S 2013 秦叔逵】。FOLFOX最常见的3 - 4级不良事件为中性粒细胞减少(30.6%)、白细胞减少(8.7%)、血小板减少(7.7%)和贫血(4.9%)。但是,该试验是在以乙肝为肝硬化根本病因的亚洲进行的,因此,目前尚不清楚这一结果是否可以在西半球复制,因为丙型肝炎是导致肝硬化的头号原因。XELOX的单臂II期研究显示了更好的结果,中位PFS为4.1个月,中位OS为9.3个月【Boige V 2007】。然而,这不是一项随机研究,因此限制了任何明确的结论。
5-FU与干扰素α联合治疗晚期HCC,干扰素α通过上调肿瘤细胞上MCH I类分子、促进肿瘤细胞凋亡和对肿瘤新生血管的抗血管生成作用具有直接抗肿瘤活性【Floros T, 2015】。在5-FU +干扰素α的II期研究中,观察到9例(25%)客观缓解,中位OS为19.5个月【Patt YZ 2003】。然而,另一项研究未能显示5-FU联合干扰素α对重度预处理的晚期HCC患者有任何临床疗效【Stuart K 1996】。
基于吉西他滨的联合化疗
为增强抗肿瘤活性,吉西他滨与顺铂联合使用。在24例印度HCC患者【Pande SB, 2012】的回顾性研究中,吉西他滨联合顺铂显示出适度的临床活性 (25%的客观缓解率) 和可接受的毒性。与回顾性研究相似,一项吉西他滨+顺铂的II期研究报告了30例不可切除HCC患者的部分缓解率为20%,疾病控制率为63%(客观缓解+疾病稳定),中位PFS为18周,中位OS为21周【Parikh PM 2005】。其在研究中观察到的3 - 4级毒性为贫血(44%)、中性粒细胞减少(26%)和血小板减少(14%)。然而,另一项低剂量吉西他滨+顺铂的II期研究显示,临床活性较差,15例患者中只有1例部分缓解,且极短的PFS (中位数:6周)和OS( 中位数:18周)【Chia WK 2008】。结果不佳的原因可能是超过一半的患者有明显的肝功能损害(Child-Pugh B和C肝硬化),吉西他滨和顺铂的剂量远低于另一项研究【Stuart K 1996】。由于患者选择在联合用药的临床结果中起着很大的作用,对于选择的不符合临床试验条件且对索拉非尼难治且有轻度肝损害的患者,可以考虑吉西他滨+顺铂。
另一项基于吉西他滨的联合化疗,吉西他滨+ PLD治疗诱导了10个客观临床缓解(24%),其中3个完全缓解,在II期研究中,中位PFS为5.8个月,中位OS为22.5个月(43)。结果非常有希望,特别是中位OS显著改善。然而,还需要进一步的随机研究来证实这一发现。
吉西他滨联合奥沙利铂(GEMOX)是晚期HCC患者的一个有吸引力的选择,因为GEMOX没有肾和肝毒性。尽管GEMOX对晚期HCC患者最常见的3/4级血小板减少(27%)和中性粒细胞减少(24%)毒性耐受良好,但在II期研究中,ORR为18% (n=6)的临床结果并不令人印象深刻【Louafi S, 2007】。有趣的是,在非酒精性基础肝病患者(6/21)中观察到所有的客观缓解,而在酒精性肝病患者中则没有(0/13)。
全身化疗与靶向治疗
与索拉非尼联合使用
|
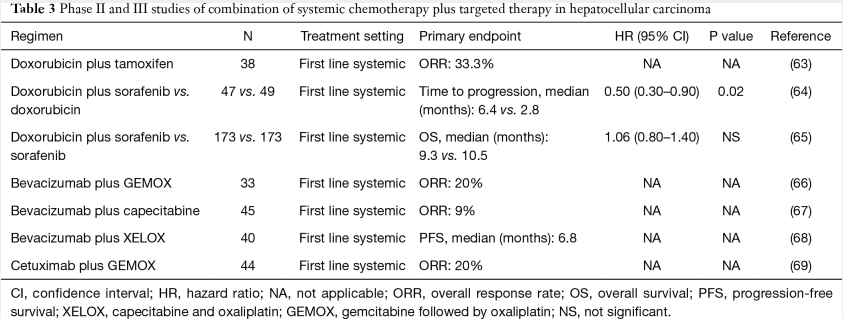 |
为了增强索拉非尼的抗癌活性,几项研究评估了索拉非尼与阿霉素的联合。由于Sorafenib抑制Ras/Raf/MEK/ERK信号通路可能抑制MDR-1的表达,因此Sorafenib联合阿霉素是一个有吸引力的方案【McCubrey JA 2006】。因此,联合用药可以增加阿霉素的曲线下面积(AUC)而不加重毒性【Richly H 2006】。在一项双盲II期研究中,与阿霉素单药治疗相比,索拉非尼联合阿霉素可延长PFS(中位PFS: 6.0 vs. 2.7个月,P=0.006) 和 OS(中位OS: 13.7 vs. 6.5个月,P=0.006)【Abou-Alfa GK, 2010】。基于II期研究的良好结果,癌症和白血病B组(CALGB)进行了一项III期试验,将索拉非尼加阿霉素与单独索拉非尼进行随机比较。然而,2016年提交的初步报告表明,与单药索拉非尼相比,索拉非尼联合阿霉素与更短的OS(中位OS: 9.3 vs. 10.5个月)和更高的毒性相关【Abou-Alfa GK 2016】。
与贝伐单抗联合
HCC是一种高血管肿瘤,新生血管在HCC的生长和进展中起着重要作用(【Pang R, 2006】。靶向肝癌血管生成的研究已经开展,抗VEGF-A单克隆抗体贝伐珠单抗在晚期HCC中显示出适度的抗肿瘤活性【Abou-Alfa GK 2010】。贝伐单抗联合化疗 (如GEMOX和XELOX)也在晚期HCC中进行了评估,因为贝伐单抗可能通过改变肿瘤血管系统来增强药物的输送和肿瘤摄取【Jain RK. 2001】。一项吉西他滨、奥沙利铂和贝伐珠单抗的II期研究结果为6例(20%)客观缓解,中位PFS为5.3个月,中位OS为9.6个月(【Zhu AX 2006】。贝伐单抗+卡培他滨作为一线治疗显示出适度的抗肿瘤活性(4个客观应答:9%),中位PFS为2.7个月,中位OS为5.9个月【Hsu CH 2010】。当贝伐单抗联合XELOX时,中位PFS和OS分别为6.8和9.8个月,有8例部分缓解(20%)【Sun W, 2011】。
联合西妥昔单抗
联合西妥昔单抗
EGFR在HCC细胞系上表达,据报道,EGFR通路在HCC的发展中起着重要作用【Berasain C 2014】。几项研究报道了EGFR酪氨酸激酶抑制剂厄洛替尼在晚期HCC中的适度临床疗效【Philip PA 2006】。一项II期研究研究了EGFR抑制剂(西妥昔单抗)联合化疗【Asnacios A 2008】(69)。在该研究中,西妥昔单抗+ GEMOX(吉西他滨和奥沙利铂)的确诊缓解率为20%(9例患者),中位PFS为4.7,中位OS为9.5个月。最常见的3 - 4级毒性是血小板减少(24%)、中性粒细胞减少(20%)、皮肤毒性(16%)和神经毒性(11%)。需要大规模随机试验来证实联合方案的疗效。
肝癌是发展中国家和发达国家日益严重的重大健康问题之一。不幸的是,晚期HCC只有有限的全身治疗选择。大多数使用全身化疗的试验都是在索拉非尼时代之前进行的,由于样本量小、人群异质性和缺乏随机化,解释这些研究结果是一个很大的挑战。此外,大多数早期研究没有根据潜在肝硬化的严重程度或其他因素对患者进行分层,这使得对这些研究结果进行比较变得困难。因此,在靶向治疗时代,细胞毒化疗在晚期HCC的治疗中将发挥次要作用。然而,某些肝功能检查良好的患者可考虑全身化疗。如果希望积极治疗且有效率高,可采用PIAF等方案;对于性能状态良好的索拉非尼难治性患者,如无临床试验,可采用FOLFOX、吉西他滨+顺铂等方案。对于肿瘤对索拉非尼难治的老年和体弱患者,可考虑单药治疗,如卡培他滨或5-FU单药治疗。最后,通过进一步的研究和联合化疗与其他治疗药物(如分子靶向治疗和免疫治疗)的进一步评估,了解HCC复杂的分子生物学,可能会改善这种有弹性肿瘤的临床结果。

