单剂化疗
阿霉素
|
 |
5 -氟尿嘧啶(研究者用)
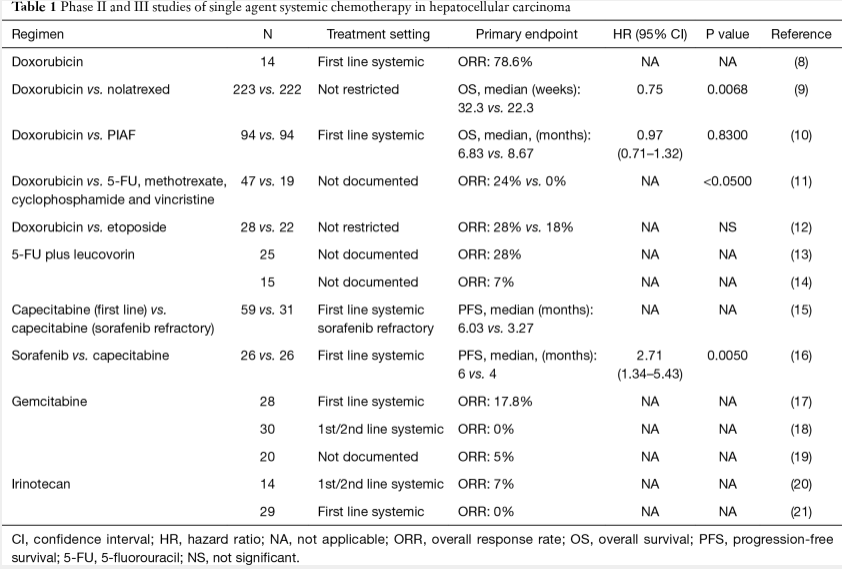
5-FU是治疗结直肠癌的常用药物,也被用于晚期HCC的治疗。一项5-FU联合亚叶酸钙的II期研究显示,在晚期HCC中活性适中,有效率为28%【Porta 1995】。然而,另一项5-FU联合亚叶酸的II期研究显示,临床反应较差,只有1例部分缓解(7%)【Tetef 1995】。
卡培他滨是氟嘧啶的一种口服活性形式,对轻度至中度肝功能受损患者的药代动力学无临床显著影响【Twelves C 1999】。因此,卡培他滨已经在晚期HCC患者中进行了评估,通常与肝功能受损有关。在一项II期研究中,59例初治患者和31例索拉非尼难治性晚期HCC患者接受了规律性卡培他滨治疗【Brandi G 2013】。既往未治疗患者的中位无进展生存期(PFS)和总生存期(OS)分别为6.0和14.5个月,缓解率为5%,而索拉非尼难治性患者的中位无进展生存期(PFS)和总生存期(OS)分别为3.3和9.8个月,无客观缓解。有趣的是,与匹配的历史对照相比,卡培他滨治疗延长了未治疗患者队列的OS(中位OS: 15.6个月vs. 8.0个月,P=0.043)。然而,卡培他滨的生存获益应谨慎解释,因为该试验不是随机研究。
最近,在晚期HCC患者中进行了一项比较索拉非尼和卡培他滨的小型随机II期研究【Abdel-Rahman O 2013】。本研究的主要目标是PFS。不幸的是,卡培他滨在PFS(中位PFS: 4个月vs. 6个月 p <0.005)和OS (中位OS: 5个月 vs. 7个月,P <0.016) 方面明显低于索拉非尼。由于缺乏大型随机对照研究,单药5-FU或卡培他滨的抗肿瘤活性尚不清楚。
吉西他滨
伊立替康是一种拓扑异构酶-1抑制剂,在多种恶性肿瘤中具有广泛的抗肿瘤活性。活性代谢物SN-38经历肠肝再循环,导致肝胆树中局部浓度较高【Chabot GG 1998】(法文,英文摘要)。基于伊立替康的这些特点,在晚期HCC患者的II期研究中对伊立替康进行了评估。遗憾的是,单药伊立替康的抗肿瘤活性不显著,客观缓解率仅为0-7%【O'Reilly EM 2001;Boige V 2006】。
研究人员评估了几种以阿霉素为基础的联合方案在晚期HCC中增强抗肿瘤活性(下表)。一项阿霉素联合顺铂的II期研究获得了边际临床获益,包括客观缓解率为18.9%(7/37),中位OS为7.3个月,中位PFS为6.6个月,不良反应可耐受【Lee J, Park 2004】。
吉西他滨
与其他化疗药物相比,吉西他滨不受肝癌化疗耐药机制的影响,如二氢嘧啶脱氢酶、p -糖蛋白或MDR-1蛋白的过表达【Kato A 2001;Jiang 1997;Soini 1996】。在一些临床前研究中,吉西他滨显示出对HCC有很强的抗肿瘤作用【Graziadei I 1998;Haberkorn U 2001;Seong J 2001】。因此,基于临床前的基本原理,我们对晚期HCC患者进行了吉西他滨的评估。在一项吉西他滨用于未接受治疗的晚期HCC患者的II期研究中,5名患者(18%)有轻微毒性的客观反应【Yang TS 2000】。然而,随后的两项吉西他滨II期研究未能显示有意义的临床疗效 [0-5%的总缓解率(ORR)] 【Fuchs CS 2002;Kubicka S, 2001 】。不同的结果可能来自于亚洲和西方患者群体和HCC病因的差异。
伊立替康
伊立替康是一种拓扑异构酶-1抑制剂,在多种恶性肿瘤中具有广泛的抗肿瘤活性。活性代谢物SN-38经历肠肝再循环,导致肝胆树中局部浓度较高【Chabot GG 1998】(法文,英文摘要)。基于伊立替康的这些特点,在晚期HCC患者的II期研究中对伊立替康进行了评估。遗憾的是,单药伊立替康的抗肿瘤活性不显著,客观缓解率仅为0-7%【O'Reilly EM 2001;Boige V 2006】。
联合治疗
基于阿霉素的联合化疗
研究人员评估了几种以阿霉素为基础的联合方案在晚期HCC中增强抗肿瘤活性(下表)。一项阿霉素联合顺铂的II期研究获得了边际临床获益,包括客观缓解率为18.9%(7/37),中位OS为7.3个月,中位PFS为6.6个月,不良反应可耐受【Lee J, Park 2004】。
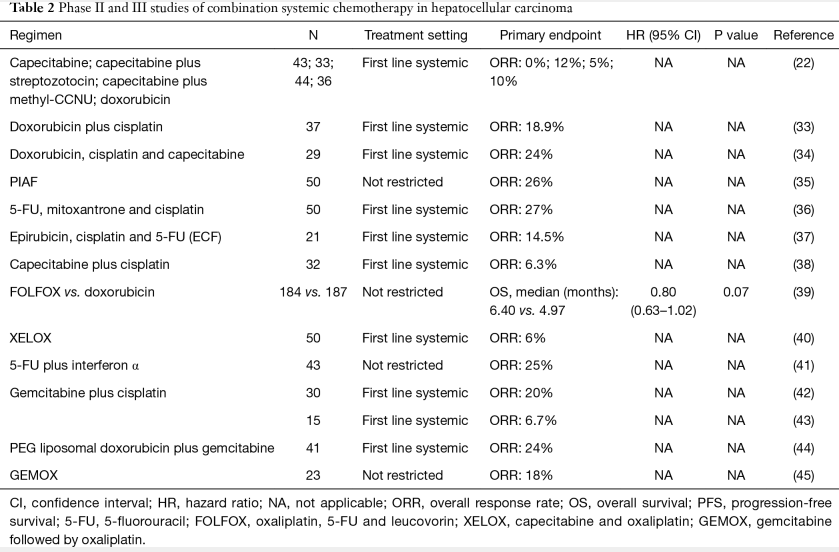 |
在阿霉素和顺铂中加入卡培他滨也显示出适度的抗肿瘤活性,包括7个部分缓解(24%),中位PFS和中位OS分别为3.7和7.7个月【Park SH, 2006】。
虽然这些基于阿霉素的联合方案仅显示出中等的抗肿瘤活性,但 PIAF方案,另一种基于阿霉素的联合方案,显示出有希望的结果。PIAF是一种由顺铂、干扰素α、阿霉素和5-FU组成的活性毒性联合化疗方案。PIAF方案的初始II期研究报告了相对较高的客观缓解率,可达26%(13/50)【Leung TW, 1999】。此外,9例获得部分缓解后接受手术切除的患者中,有4例病理缓解完全,无存活肿瘤细胞。II期研究的良好结果导致了更大规模的III期研究。尽管PIAF方案的高有效率在一项比较PIAF与阿霉素的随机III期研究中再次得到证实(20.9% vs. 10.5%),但没有生存获益(中位OS: 8.7 vs. 6.8个月,P=0.83),且有显著的与治疗相关的3/4级毒性,包括中性粒细胞减少、血小板减少和贫血【Yeo W 2005】。尽管反应率较高,但未能显示生存益处,这可能是由于研究中缺乏患者选择。几项回顾性研究证实了PIAF方案患者选择的重要性。一项回顾性研究表明,当筛选出总胆红素正常和非肝硬化的HCC患者时,ORR远高于胆红素异常和肝硬化的患者(50.0% vs. 6.3%, P=0.004)【Leung TW 2002】。在MD Anderson的另一项回顾性研究中,作者证明,在性能良好且无肝炎或肝硬化的患者中,改良PIAF比常规大剂量PIAF具有更高的客观缓解率(36% vs. 15%, P=0.013)、更高的可切除率(33% vs. 10%, P=0.004)和更长的中位OS (21.3 vs. 10.6个月,P=0.002)【Kaseb AO 2013】。因此,对于肝功能正常、性能良好的患者,PIAF可能是一种合理的选择。然而,该方案的毒性是一个问题。
5-FU为基础的联合化疗
由于5-FU或卡培他滨单药临床疗效一般,故5-FU与卡培他滨联合顺铂、奥沙利铂等其他化疗药物。两项针对5-FU、顺铂和米托蒽醌的II期研究报告了24-27%的客观缓解率,中位PFS为2.5-4个月,中位OS为4.9-11.6个月【

