历史
发现:1993年,三个实验室同时发现了一种独特的肿瘤发生机制:研究人员在结直肠癌中寻找杂合性丢失(LOH)时,发现肿瘤组织中的某些非编码区PCR条带的片段大小相比相邻的正常组织发生了变化。在进一步的调查中,他们发现这是因为被观测到变化的DNA序列中含有微卫星位点。这种微卫星位点的片段大小改变被证实是由于DNA错配修复缺陷(dMMR)所引起的,这种现象被称之为“微卫星不稳定性”。很快,其他实验室也陆续在其他癌种中发现并研究MSI现象。
.当时学术界对MSI并没有明确的界定标准,人们会用任何他们感兴趣的位点对肿瘤样本进行MSI检测,因此结果也比较混乱。为了解决这一问题,第一次美国国家癌症研究所(NCI)主办的关于MSI的会议于1997年在美国马里兰州的贝塞斯达(Bethesda)举行。基于本次会议的专家共识,NCI发表了第一篇奠基性的有关MSI检测标准的论文,首次给出了MSI的标准化定义:“与正常组织相比,肿瘤组织微卫星位点中重复单元的插入或删除导致的长度变化”。论文还推荐了一组微卫星检测Panel,包含两个单核苷酸重复位点BAT-25和BAT-26以及三个双碱基重复位点D2S123,D17S250,D5S345,共同组成5个位点的MSI检测Panel,这也就是后来为大家所熟知的Bethesda Panel(或称NCI Panel)。 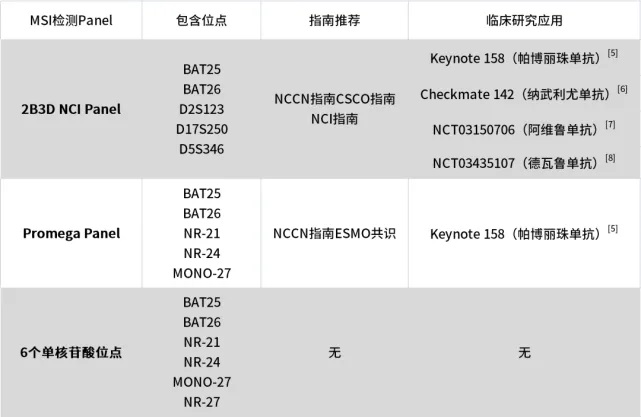
NCI专家共识更新:随着科学家对MSI认识的深入,逐渐发现1997推荐的Bethesda Panel并非检测MSI的最优Panel。其主要原因是Bethesda Panel中的三个双碱基重复位点D2S123,D17S250,D5S345对dMMR的灵敏度和特异性均非最优。研究结果表明,单碱基重复位点是MSI检测的更优位点选择。
2004年,NCI专家小组更新了MSI检测专家共识,推荐使用单核苷酸重复位点替代Bethesda panel中的双碱基重复位点D2S123,D17S250,D5S345。
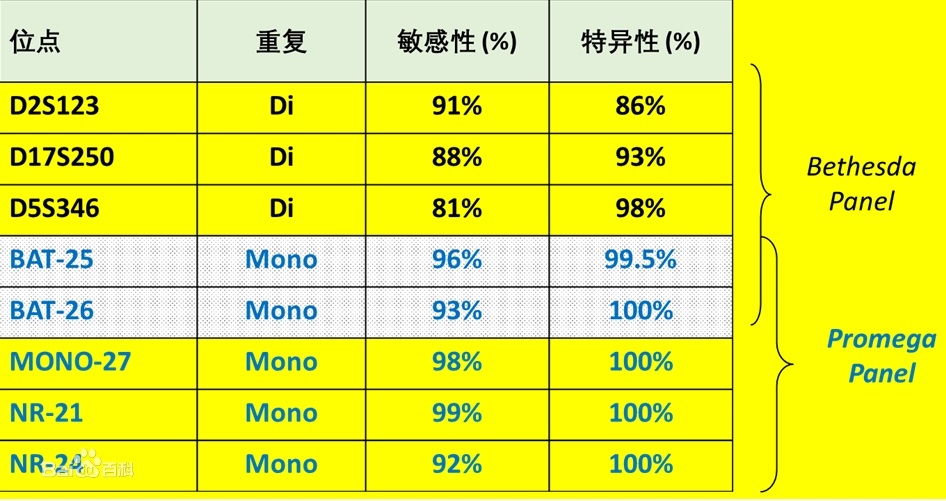
全球首个商品化MSI检测试剂盒发布:2004年美国Promega公司发布了全球首个商品化MSI检测试剂盒。基于NCI专家共识,Promega公司使用了5个单核苷酸重复位点BAT-25,BAT-26,NR-21,NR-24和MONO-27检测MSI,除此之外,该试剂盒还包含两个5核苷酸重复位点(Penta C,Penta D),用于样本内质控。Promega公司发表的文献表明,Promega Panel的性能要优于1997版的Bethesda panel。
Promega Panel 和 Bethesda panel所选用位点性能对比
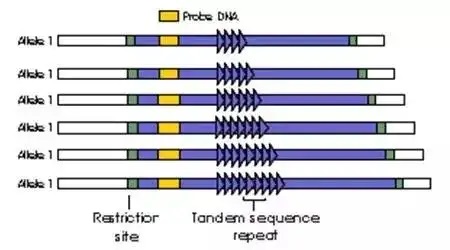
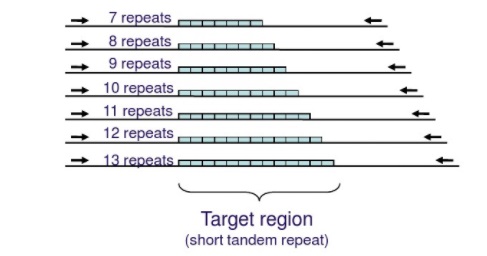
 微卫星定义:20世纪80年代后期,Marshfield医学研究基金会(Marshfield Medical Research Foundation)的James和俄勒冈健康科学大学(Oregon Health Sciences University )的Wis等人分离出来一种比小卫星DNA具有更短重复单元的卫星DNA,被称为微卫星DNA,又被称作短串连重复(Short Tandem Repeats, STRs)或简单重复序列(Simple Sequence Repeat, SSRs), 每单元长度在1~6bp之间根据重复单元的构成与分布,微卫星DNA序列被分为3种类型:
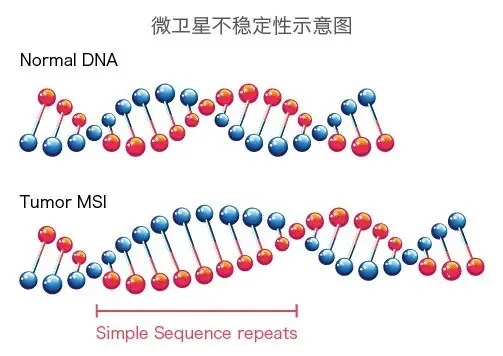
微卫星是一种短的、重复的DNA序列。由于它们在密切相关的生物之间变化不大,科学家通常将微卫星用作遗传标记,以识别来自同一繁殖群体的个体。它们也被称为短串联重复序列(STR)和简单序列重复序列(SSR) 微卫星是一个短而重复... 微卫星不稳定
结直肠癌中微卫星不稳定与错配修复蛋白的表达缺失
结直肠癌是一种在西方国家很常见的恶性肿瘤,在我国的发病率也逐年 上升。目前发现,参与结直肠癌发生的分子途径包括
微卫星检测的临床应用林奇综合征筛查
林奇综合征(Lynch Syndrome)是一种因胚系突变导致至少一个DNA错配修复基因(DNA mismatch repair, MMR)失活,从而引发的家族性遗传病,是一种伴常染色体显性遗传病。携带有林奇综合征缺陷的人有罹患多种癌症的高发风险,尤其是结直肠癌、子宫内膜癌、卵巢癌等。据推算,约每300人中就有就有一个林奇综合征缺陷携带者,然而遗憾的是公众对此家族性遗传缺陷了解并不多。
对确诊癌症的患者进行MSI分析可以高效的筛选出疑似林奇综合征患者,是被广泛推荐的林奇综合征筛查方法之一。患者的肿瘤样本呈MSI-H表明肿瘤微卫星DNA处于不稳定状态,意味着患者肿瘤组织的DNA错配修复功能失活(dMMR),而dMMR正是林奇综合征患者的关键特征。
MSI检测用于II期结直肠癌患者预后及治疗指导
Popat S et al.在《British Journal of Cancer》杂志上发表的一项纳入了32项研究共7642例II期结直肠癌患者的荟萃分析结果显示,与MSS患者相比,MSI-H患者死亡风险为0.65(95%CI, 0.59-0.71),降低高达35%[8]。目前已有大量证据表明,MSI-H是II期结直肠癌患者预后良好的一个标志物。
大量证据表明,MSI-H患者并不能从5-FU的辅助化疗中获益,MSI-H可作为5-FU辅助治疗CRC无效的预测标志物。Ribic CM et al.发表在《New England Journal of Medicine》杂志上的文献数据显示:在II期结直肠癌患者中,MSI-H患者接受辅助化疗较未经治疗者并无生存优势,5年生存率反而显著缩短(71% vs. 88%)[9]。这表明:对于MSI-H的II期患者,给予5-FU辅助化疗非但不能带来生存获益,反而对患者不利。因此,II期CRC患者是否需要辅助化疗,需要综合考虑临床高危因素和MSI状态。
《中国结直肠癌诊疗规范2015》建议有条件者检测组织标本MMR或MSI(微卫星不稳定性),如为dMMR(错配修复缺陷)或MSI-H(微卫星不稳定),不推荐氟尿嘧啶类药物的单独辅助化疗。
MSI除了用于II期结直肠癌患者的预后和指导5FU治疗,MSI-H也是预测PD-1抑制剂的一个重要的生物标志物 除了MSI TMB检测和肿瘤浸润淋巴细胞(TIL)也是预测PD-1抑制剂的有效率指标 肿瘤基因突变负荷(TMB)检测
肿瘤突变负荷高,从免疫治疗中获益的概率就大。在CheckMate-032临床研究中,按照TMB高低划分成TMB高、TMB中、TMB低三类病人,在接受联合治疗的人群中,三组的有效率分别为62%、20%、23%;而三组的中位总生存期,分别为:22.0个月、3.6个月、3.4个月——22.0个月与3.4个月,相差6倍!所以,TMB也是预测PD-1抑制剂的一个重要的生物标志物指标。
肿瘤浸润淋巴细胞(TIL)检测
通过免疫组化染色(CD3、CD4、CD8等),可以看出肿瘤组织中是否有较多的淋巴细胞浸润。浸润的淋巴细胞越多,PD-1抑制剂的有效率越高。
MSI作为PD-1药物治疗实体瘤的生物标志物
2015年,一篇发表在《新英格兰杂志》标题为《PD-1 Blockade in Tumors with Mismatch-Repair Deficiency》的文章重新引爆了公众对MSI的兴趣。Dr. Le和他的同事们拓展了MSI在肿瘤免疫治疗中的应用,证实了MSI状态与免疫治疗异常烈的反应相关。
在Dr. Le和他的同事们主持的一项关于PD-1免疫检查点阻断剂在结直肠癌中的作用研究中,33个样本只有1个有应答。经调查,作者发现这位患者的肿瘤是MSI-H分型。他们的进一步研究发现,具有MSI-H分型的肿瘤具有针对新抗原的高免疫细胞浸润,但被免疫检查点抑制配体(如PD-L1)所抵消,PD-L1结合PD-1阻止了T细胞活化。当使用PD-1免疫检查点阻断剂时,免疫细胞可以激活并攻击肿瘤细胞。基于此,即便是单剂量的治疗,患者的血清也能马上反映出临床受益。在Dr. Le所发表的论文中,其MSI检测使用了Promega公司提供的MSI检测试剂盒“MSI Analysis System”。
MSI检测Panel选择
由于微卫星位点的不稳定阳性率各不相同,比如BAT-25和 BAT-26这两个位点的阳性率比较高,NR-24的阳性率则稍低于前两者,而D2S123这类双核苷酸重复位点则明显低于BAT-25这类单核苷酸重复位点。因此不同MSI分析Panel选取的不同微卫星位点,将直接影响到MSI的诊断结果。 |