药物治疗 大多数肝癌对常规的、传统的化疗药物是不敏感的。此外,由于潜在的肝功能障碍,肝癌患者通常对肝癌的全身化疗的耐受性差。但是几个重要的分子和其路径,与肝脏癌发生的过程相关,包括受体酪氨酸蛋白激酶(Receptor tyrosine kinases,RTKs)、Wnt -β- catenin信号、泛素-蛋白酶体系统(ubiquitin-proteasome system),表观遗传学DNA修饰(epigenetic DNA modification-<promoter methylation and histone acetylation 启动子甲基化和组蛋白乙酰化>),PI3K -AKT - mTOR的通路,促进血管形成的分子( proangiogenic molecules)和端粒末端转移酶(telomerase)[42]。针对这些途径的药物正在积极的研究中。 索拉非尼,一种口服多激酶抑制剂,针对Rafkinase,血管内皮细胞生长因子受体(Vascular Endothelial Growth Factor,VEGFR)和血小板衍生生长因子受体(platelet-derived growth factor receptor,PDGFR)信号转导通路。其已经被美国FDA批准用于晚期肝癌(BCLC分期,C期;ECOG体力评分状况1-2,门静脉侵犯,淋巴结或肝外转移)病人。在一项III期的随机安慰剂对照研究中,602例晚期肝癌患者,索拉非尼组整体存活期为10.7个月,安慰剂组为7.9个月。索拉非尼治疗伴有疲劳,腹泻的和手足皮肤反应(已知的索拉非尼治疗相关副作用)等可以接受的不良影响[43]。另一个在亚太地区进行的试验也显示,索拉非尼治疗克改善整体存活率和可接受的副作用[44]。潜在治愈性治疗后(肝切除或射频消融)索拉非尼治疗应用(STORM clinical trial)[45],以及与TACE结合(SPACE clinical trial)目前正在进行中[46]。  主要的问题是,在欠发达地区HCC发病率高,可以从靶向药物治疗中获益的患者却无法负担治疗费用,所以不可能被普遍使用。比如,患者每月在sorafenib药物上的花费:中国$7300,美国$5400, 巴西$5000, 法国€3562, 韩国$1400。虽然2018年在中国索拉非尼被纳入医保,但自费部分对患者仍然是一种负担。 索拉非尼在2007年获批FDA后,作为肝癌治疗金标准的,不断受到目不暇接的相关治疗药物的挑战,这其中包括化疗,靶向治疗,甚至是免疫治疗,但十多年来索拉非尼的地位安如磐石。
每出现一种新药的临床试验,肿瘤科医生、肝外科医生、肿瘤介入的医生心情,都会从关注期待→失望→逍遥事外 
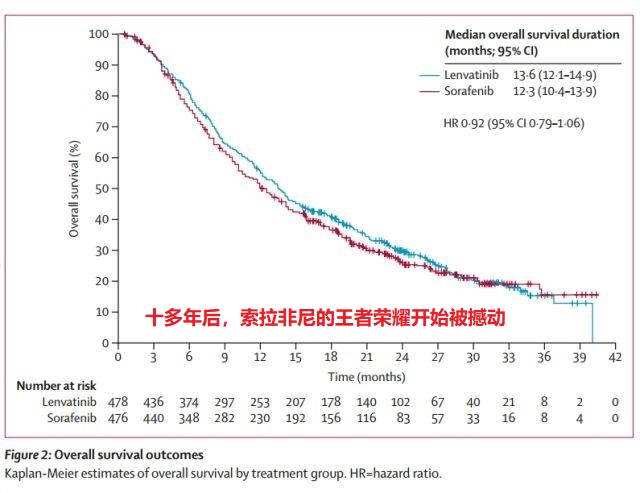
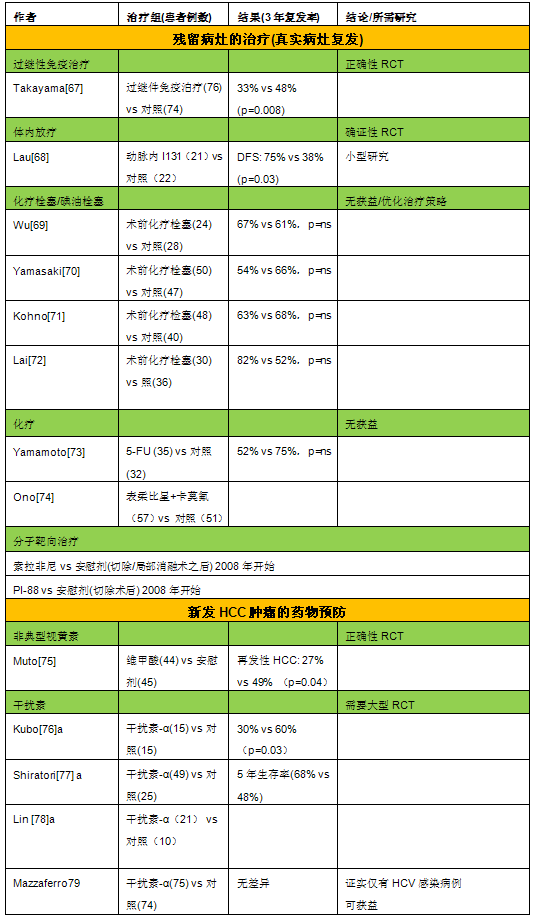
直到仑伐替尼的的reflect研究出现,证明仑伐替尼的疗效非略效于索拉非尼,尽管长期生存仑伐替尼与索拉非尼相当,但基于改良实体瘤疗效评估标准(mRECIST)评估,仑伐替尼组所有的次要终点均显著优于索拉非尼组。中位PFS分别为7.3个月和3.6个月(HR=0.64,P<0.0001),中位TTP分别为7.4个月和3.7个月(HR =0.60,P<0.0001),ORR分别为40.6%和12.4%(OR=5.01,P<0.0001)。 很明显,随着包括人口流行病学,生物医学,药理学,医疗器械和临床研究持续不断的努力,未来肝癌治疗还将面临更多的选择。这些研究将进一步改进我们对HCC的这种“疾病全球的经济负担”*的理解,指导有效措施的实施以减少肝癌的发生,这是继乙肝疫苗注射,黄曲霉毒素污染控制之后,HCC下一个最好的方法。特别是包括WHO,政府和非政府组织,不同大陆,地区,科学和社区组织的全球合作。通过建立培训项目,提高义务人员的认识,使各地区,各层次医疗机构在成本效益的原则下改善高危人群的监控,早期诊断和治疗肝癌,这将更有效地协调各方努力(就像人们在全球建立的各种区域经济组织那样)以减少深受肝癌之苦的发展中国家的肝癌和慢性肝炎所带来的经济负担,特别是占有全球HCC发病总是一半的中国。而各级专业学会(肝外科,消化科,介入放射学科)的合作意愿,以推动政府行为的改进扮演着至关重要的角色。 辅助治疗预防肿瘤复发 HCC术后5年复发率可高达70%,复发的原因包括肝内转移(真实的复发)或者新发肿瘤(denovo)的出现[31,52~58]。这两种不同类型的复发可以通过比较性基因杂交技术、乙型肝炎病毒的整合模式、基因杂性缺失法进行DNA指纹分析、或者DNA芯片等加以辨别根据这些研究,人们发现60%-70%的复发病例是由于手术时未能发现的肝内转移病灶所导致,只有30%-40%为新发HCC。遗憾的是,目前还无法通过常规临床方法鉴别这些不同个体。真实复发病例一般在手术后2年内出现,其主要预测指标为血管浸润,组织学分化不良和卫星病灶(表2)[ 31,52~58]。新发肿瘤的特征为起病较晚,通常在手术2年后出现[56]。 预防和治疗复发肿瘤的措施最终应该随复发类型不同而异,这已在其他文章中进行了综述[30]。从预防角度而言,未能发现的肝转移病灶有可能通过化疗栓塞/碘油栓塞、体内放疗、化疗或过继免疫疗法、或分子靶向治疗等加以处理,而新发肿瘤则可能需要通过使用药物进行预防,例如视黄素或干扰素[79](图4,表3]。
HCC手术/局部消融术后辅助治疗的相关随机对照研究总结于表3。几所有已发表的RCT都是在亚洲进行的。在预防肿瘤复发方面,辅助性化疗栓塞和/或化疗并不能增加获益[69~72]。在一项募集了43名患者后提前中止的RCT研究中,用I131标记碘油进行体内放射治疗显示一定的阳性效果[68]。随着其它非对照研究也显示令人鼓舞的结果,该效应无疑值得进一步研究证实[80]。在一项有150名患者参加的试验中,过继免疫疗法(白介素-2和CD3抗体活化的淋巴细胞)可降低首次复发率(3年复发率:治疗组为33%,而对照组为48%)[67]。另有研究发现,视黄素在预防新发肿瘤方面也有相似效果[75]。目前所有这些措施尚未应用于临床实践中,其结果也需要通过其他研究进一步证实。干扰素在部分RCT中表现出一定的正面作用,包括手术/经皮消融术后的患者凡[78]。最近,首个在西方国家进行的RCT评价了干扰素-α治疗150名患者的疗效,研究总体显示阴性结果。然而,亚组分析却表明该项治疗在HCV患者中可预防晚期的新发肿瘤,为今后对这一治疗措施的进一步评价提供了理论基础[79]。由于至今尚无有效的辅助干预措施,目前迫切需要开展临床试验对切除术后的辅助治疗进行评估和研究。研究的主要终点是至肿瘤复发时间。针对两种不同类型的复发模式,其干预措施也是完全不同的,而联合治疗应该是最合理的策略。由于尚缺乏己经证实有效的治疗措施,将患者随机分至无治疗对照组目前还是合理的。随机化之前应该先根据肿瘤大小,结节数目/卫星病灶数目和血管浸润等进行分层。考虑到这些研究的复杂性,需要开展多中心的大规模研究。
全身系统治疗
激素类药物和传统的体外放射疗法对于HCC并无明显生存获益。针对7项RCT共898例患者的套萃分析比较了他莫昔芬(Tamoxifen)和保守治疗的差异。结果表明,他莫昔芬治疗既无抗肿瘤活性也无生存获益(1 iiA)[ 33]。此后报道的两项大型RCT[106,107]也均未发现他莫昔芬的生存获益。因此,这一治疗药物在晚期HCC治疗方面的结果令人失望。
目前共有9项RCT对系统(全身或静脉)化疗的作用进行了评价[33]。体外和体内试验中活性最强的药物为阿霉素和顺铂。己有临床试验对阿霉素系统化学治疗1000多名患者的效果进行了评价,结果表明部分缓解率在10%左右,未发现任何有关生存优势的证据(1iiA)[ 33,47]。香港研究组报告了一项顺铂/干扰素-α 2b/阿霉素/氟尿嘧啶(PIAF)联合化疗[108]与阿霉素单药治疗比较的大型RCT。PIAF方案的客观缓解率为20.9%,而阿霉素组为10.5%。PIAF和阿霉素组的中位生存时间分别为8.67月和6.83月,无显著组间差异。与阿霉素相比, PIAF方案的骨髓毒性发生率明显升高。PIAF方案组的治疗相关死亡率为9%,主要原因为HBV再激活和肝衰竭。因此,系统性化疗不适于治疗HCC,而广泛的毒性作用也使其很难作为临床试验的对照药物。
有关干扰素和奥曲肽的初步研究取得了令人鼓舞的效果,但缺乏后续研究的进一步验证。相关的3项治疗晚期HCC的III期研究已经完成,结果均为阴性。迄今为止HCC研究领域最大规模的RCT比较了Seocalcitol(一种维生素D样抗增殖分子)与安慰剂治疗746名患者的差异,研究结果显示总体生存时间并不存在明显组间差异( Seocalcitol组9.6月,安慰剂组9.2月)[ 109]。
一项纳入446例患者的临床试验比较了胸苷合成酶抑制剂诺拉曲特(Nolatrexed)与系统性阿霉素治疗的差异,结果仍为阴性(中位生存时间分别为5月和7.5月)[ 110]。最后,一项大型多中心RCT同样报告了有关微管抑制剂(T-67,来自Tularik公司)的阴性研究结果[111]。
HCC的分子靶向治疗:索拉非尼 对HCC分子发病机制的不断认识和分子靶向药物在肿瘤领域的逐渐应用,为HCC这一复杂恶性肿瘤的治疗开辟了令人鼓舞的新趋势(见综述[39,112])。表5总结了目前通过相关II期和III期临床试验进行测试的HCC分子靶向药物。绝大多数治疗以阻断细胞增殖和生存相关信号传导通路为目的。其他药物则依赖于阻断生长因子或者与疾病播散相关的信号通路(即,血管生成,端粒酶活化)等。
目前正在研究的大多数药物都是通过阻断细胞膜酶氨酸激酶受体(TKRs)而发挥作用。这些受体的配体包括EGF, PDGF, VEGF和HGF等。这些配体可以激活RAS/MAPK信号传导通路并且诱导AP1基因家族的转录,例如c-fos和c-jun等诱导细胞增殖的关键因子。与其他恶性肿瘤相似,受体(尤其是EGFR)本身的体细胞突变(somatic mutations)也同样可致该信号通路的持续激活A[25]。另外,抑癌基因的失活,如RASS-FR1和NORE1,在晚期HCC中也非常普遍[39]。此外,这些生长因子还可诱导PI3K/Akt/mTOR信号通路或者HGF/c-met通路的活化[39]。
III期临床研究:索拉非尼
索拉非尼(多吉美)是一种口服多激酶抑制剂,对多种酪氨酸激酶(VEGFR2, PDGFR,c-Kit受体)和丝氨酸/苏氨酸激酶( b-Raf, p38) 发挥抑制活性[113]。所以,这一药物可同时作用于肝癌发生机制中的两条主要通路:其一,通过抑制VEFGR2和PDGFR阻断肿瘤血管生成;其二,通过阻断Ras/MAPK信号通路(bRAF)的活化抑制肿瘤细胞增殖。索拉非尼可以延长肾癌患者的无进展生存时间,并且已获批准用于肾癌的治疗[113]。临床前试验显示索拉非尼在HCC异种移植动物模型中的显著抗肿瘤活性[114]。此后,一项纳入137例晚期HCC患者的II期临床试验表明,索拉非尼可使35%的患者获得持续至少4月的疾病稳定期,中位总体生存时间达9.7月。部分缓解率不足10%。值得注意的是, RAS/MAPK通路活化的患者(根据p-Erk免疫染色结果判断)至疾病进展时间为178天,而没有该通路活化的患者仅为46天[115]。 随机双盲安慰剂对照的III期临床试验中,索拉非尼治疗晚期HCC患者的生存时间延长了3月,这一结果不仅有统计学意义,也更具临床价值[29]。这一多中心研究评价了索拉非尼(400mg,一天两次) (299例)与安慰剂(303 例)比较治疗晚期肝细胞癌患者的疗效差异,所有患者既往未接受过系统性药物治疗。研究主要终点为生存时间。研究在第二次预定的中期分析后由于治疗组的显著生存获益而提前中止,此时共出现321例死亡事件。索拉非尼治疗组的中位总体生存时间为10.7月,安慰剂组为7.9月(死亡风险比, 0.69; 95%可信区间, 0.55-0.87; p<0.001)。索拉非尼治疗组的中位至疾病进展时间为5.5月,而安慰剂组为2.8月(风险比为0.58; 95%可信区间0.45-0.74; P < 0.001)。索拉非尼组有7例患者(2.3%)达到部分缓解,而安慰剂组为2例(0.7%)。索拉非尼组中发生腹泻,体重减轻,手足皮肤反应和低磷血症者更为常见。这项RCT结果成为肝癌这一复杂疾病治疗中的重大突破[29]。索拉非尼是首个可以延长HCC患者生存时间的系统性治疗药物,因而成为晚期HCC患者治疗的新标准(表1)。
这一药物己经通过FDA和EMEA的批准用于治疗HCC。这些结果为HCC临床试验开辟了新的研究方向。未来的研究无疑将继续探索索拉非尼在根治性治疗(包括切除术或者局部消融术等)后的辅助治疗作用,或联合化疗栓塞治疗中期HCC患者,以及联合其他分子靶向药物治疗晚期患者的意义。在后两种情况下,索拉非尼还应当成为这些试验中的对照组用药。
正在进行II 期临床研究药物 Ras/MAPK信号传导通路的有效阻断可通过应用针对EGFR(西妥昔单抗,爱必妥)或者ErbB2/Her2(曲妥珠单抗,赫赛汀)的单克隆抗体而实现。 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||