|
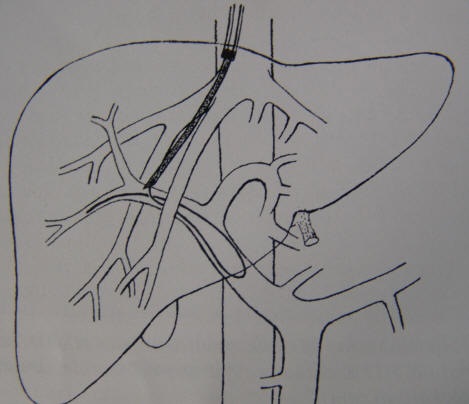
门静脉导管技术 一旦超硬导丝置入门静脉(PV)内适当的位置,以下的步骤通常可以在不增加操作医师心理压力和患者的危险性的情况下完成。即所谓的安全规则如下: (1)根据对患者肝脏的解剖研究(CT,二氧化碳楔入双平面肝脏门脉造影,实时超声引导)制定计划,确定将哪一支肝静脉与门静脉分支连接。 (2)最重要的问题为选择门静脉定位方法,根据你的喜好选择穿刺针 组件和提供的每一种可供选择的装置。 (3)在开始穿刺门静脉前确定你位于哪一支肝静脉内(右侧肝静脉或中间肝静脉或右副肝静脉)。 (4)如果在几次尝试后未穿入门静脉,再次评价穿刺针的位置,向另一个方向穿刺,或再次行CT扫描确定你的操作为什么不成功。插管更重要的是头脑的控制(保持清醒的头脑),而不是手法的控制。 (5)穿刺针的方向与针的弯曲程度同样重要,可通过手工弯曲改变穿刺针的弯曲程度。 (6)经颈内静脉向向下穿刺应保持于门静脉右支水平以上。避免在距离分叉过远或过于中心处穿刺。 绝大多数操作医生在右侧肝静脉流入下腔静脉入口前的2-3厘米内开始穿刺。使用肝静脉的近端部分有两个目的。第一,建立分流时,使用最大直径的肝静脉以避免分流流出道狭窄。第二,保证肝静脉穿刺部位在门静脉目标穿刺部位的头侧。 所有的穿刺技术都基于前方弯曲的穿刺套件组合(如,RUPS-100),在X线透视下,可以很容易的将其插入肝静脉内。在右侧肝静脉内,将套管向前旋转约90°,然后向前推进,保持导管尾部的推压力,使其楔入肝静脉壁。当位于中肝静脉内时,以同样方法将套管向后旋转。持续加压于套管尾部应与患者的呼吸保持一致,以保证套管位置稳定。 穿刺针:常用的四种商用TIPS穿刺针中 ,3种为长型 Colapinto 肝脏活检针的改进。这些穿刺针中的第一种相对简单,包括一个16号,55cm长的弯曲不锈钢针和一个45cm长的9F导管。穿刺针在其远端头部有一个锐利的、反向斜面,可协助穿刺针通过9F导管平稳穿入并协助引导导丝。 另一种穿刺针(Angiomed 或 Optimed)包括一个钝的金属套管,其针体为15号,向尖端逐渐变细为17.6号。为了使这一装置像穿刺针一样工作,必须插入锐利的针芯并将其锁于套管针内。将套管通过10F导管鞘置于 超硬导丝上或使用特殊的钝头填塞器。
使用所有这些穿刺装置时,需推进整个装置穿过肝实质进入门静脉。当进入门静脉穿刺后,在以装有造影剂的10毫升注射器回抽时有血液回流。造影剂可使被穿入门静脉分支立刻 显影(排除偶然穿刺到肝动脉)。一旦远端血流很好的充盈门静脉分支,通过套管插入导丝。在这一关键操作中,操作者必须握住穿刺针以保持其弯曲头部的旋转方向并同时保持其纵向水平。
一旦所选用的超硬导丝在门静脉内处于稳定的位置(尽可能进入门静脉的肠系膜上或脾静脉的远端属支),沿导丝将引导导管、金属套针和套管全部推至门静脉主支内。这一操作通常需要以(受控的)巨大推力克服门静脉壁和肝硬化实质的阻力。
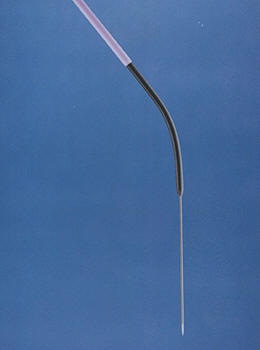
RUPS 100
金属套管外侧为10.5F薄壁锥形头导管(上图黑色)。最外侧为头端有金属标志的长鞘管(上图紫色)。长鞘管作为套管保证肝静脉内装置的楔入位置,其内的弯曲金属套管的头部控制穿刺的方向。套管本身在每一次穿刺针穿刺移动时不穿过肝实质。进行穿刺时将0.038英尺穿刺针连同5F导管使劲推向门静脉分支,而同时保持金属套管在肝静脉内楔入的位置。 有经验的操作者常常可以在穿刺针到达门静脉壁时感觉到一定的阻力,这一阻力通常需要稍增加推力来克服。当操作者相信已经到达门静脉分支时,解除穿刺针锁定,取出穿刺针并连接装有造影剂的注射器以提供吸引,同时缓慢抽出5F导管(无需X线透视)。当可以自由抽出血液时,5F导管在门静脉分支内的位置通过注射造影剂证实。然后插入带有旋转控制能力的180cm长0.035英尺亲水性成角导丝,将其沿门静脉分支推入脾或肠系膜静脉。 如果在远端导管头水平有阻力,可通过使用旋转、操纵控制导丝或将5F导管拉出2或3毫米(因为其头部可能进入对侧门静脉分支)。导管末端施加于导丝上的直接垂直力可能导致门静脉壁损伤。这种情况通常发生于门静脉分支穿刺处的对侧壁。如果只限于内膜,这样的对门静脉壁的损伤可刺激血栓形成。然而,继发假性门静脉瘤的形成也有报道。如果导丝穿透门静脉壁,接下来插入的诊断性导管可被推至肝门周围区域。如果沿导丝插入10F导管鞘时其内未插入锥形头的扩张器,也可造成门静脉壁撕裂。所以在决定推送导管的时候,要慎重。首先要使导丝的进入处于稳定状态,其二肝静脉到门静脉之间的走行必须平滑,不能角度太大。第三推送导管的时候同时抽回少量导丝,都是减少导管推送过程中门静脉损伤的重要步骤。 当穿刺门静脉周围支而不是门静脉右侧主干时,导丝往往倾向于转向门静脉末梢而不是肠系膜上静脉系统。在这种情况下,导丝插入周围支深部,以5F或4F弯曲导管(Berenstein 或Davis)代替5F导管。这些导管的形状使成角导丝可以更好的由周边向中心方向运动。所谓的“折叠”技术对于将导丝重新导入中央门静脉也有用处。以180厘米长的Benson导丝,替代硬Terumo导丝,推进导丝直到其头部卡在周围支内。再插入导丝可使导丝头长的可弯曲段弯曲成环状,后者向中心“折叠”(上图)。
还有其他细针同轴门静脉穿刺装置(使用开放的21和22号薄壁穿刺针)。这些穿刺针创伤较小,但对于门静脉分支插管,可使用对于扭折阻力更小的0.018英寸导丝。 肝实质内通道的扩张 一旦导丝安全的置于门静脉主支内,推荐行门静脉造影评价穿刺部位,这是一个关键的安全步骤。在实践中,使用180~320厘米长的“J”超硬亲水性导丝(Terumo stiff)进入门静脉系统的稳定位置(导管插入脾静脉深部以成像所有门体侧支,包括胃底食道静脉曲张)。 可沿这一导丝将5F猪尾状导管送入门静脉。在此操作之前退出金属套管。尽管金属套管支持其由门静脉走行至肝静脉。通过以10ml/s的速度注射20毫升造影剂进行门静脉造影。通过使用数字减影血管造影,可以2:1的比例以普通生理盐水稀释造影剂。在肾功能不全的患者中,可以二氧化碳代替碘化造影剂。为了显示穿刺部位,需行右前斜位甚至侧位图像采集。 这一步骤中的一部分位通过导管利用血压传感器或由三通旋阀、垂直塑料管和一个50厘米长的标尺制成的压力计直接测定门脉压。标尺的下端应位于患者右心房水平。一旦超硬导丝再次插入门静脉并且取出金属套管和10F特氟纶导管。通过10F导管鞘侧臂测量肝静脉或右房内血压。为了准确测量,导管鞘需置于肝脏上方。门体梯度通过门静脉压减去平均右房压计算。 造影证实导丝位于门静脉后,通常预先植入8~10mm球囊扩张导管扩张肝静脉与门静脉之间的肝内通道以利于支撑架植入或/和操作导管行选择性栓塞门体侧支。还可以通过使用直径较小的5或6毫米球囊进行预扩张。覆有亲水涂层的球囊导管对于伴周边纤维化的硬化肝脏非常有用。常规使用这一预扩张技术,较使用10F锥形导管简单。 扩张的最大阻力通常由门静脉和肝静脉壁引起。向球囊充气通常在门静脉和肝静脉壁水平显示腰部。肝内通道的扩张是TIPS操作中或者最为感到痛苦的过程,至少应在该步骤前2分钟给予静脉内麻醉。 有时,严重的肝门周围纤维化会阻止导管或球囊继续前进。如果用于门静脉插管的导丝至少有180厘米长,可以进行导管置换,使克服这些问题的过程相对容易。这一步主要使用硬质导丝,它使得向门静脉内推进任何导管都变得容易,因为推力沿更直的路径得到传导。另外,通过套管插入导管或球囊提供了额外支持,消除了导丝在肝脏以上发生折叠的现象。
如果第一根导丝不够硬,建议以长的5F导管进行扩张(Zeitler或van Andel导管,Cook, 丹麦)。这些导管通常可以很容易的插入门静脉,并允许以几种180厘米长“超硬质”导丝(Amplatz extrastiff, Amplatz-superstiff, Ultrastiff Lunderquist, Back up wire)中的一种替换原来的导丝。在门静脉走行非常水平的病例中,推荐手工弯曲导丝硬质部分的起始处。这可以稳定导丝的位置并相对于未改良的导丝降低对门静脉对侧壁的切应力。
Many centers have switched over to wedged carbon dioxide portovenography to facilitate the advancement of the needle towards the portal vein under two dimensional (2D) fluoroscopy[220].
许多中心已经切换到楔状二氧化碳孔静脉扫描,以促进在二维(二维)透视[220]下的针向门静脉推进。
However, it cannot be used in cases with occlusive portal vein thrombus.
但不能用于门静脉血栓闭塞的病例。
Arterial portography is another technique of navigation but requires intra-arterial injection of contrast, and visualization of portal vein may be suboptimal, particularly when the vein is small in caliber or shows hepatofugal flow[221].
经动脉门静脉间接造影术是另一种导航技术,但需要动脉内注射造影剂,门静脉可视化可能不理想,特别是当静脉口径小或显示肝血流[221]时。
Many studies have described computed tomography or ultrasound -guided percutaneous marking of portal vein using guidewires or metallic coils, which is not without risk in patients with advanced cirrhosis[222,223].
许多研究描述了计算机断层扫描或超声引导下使用导丝或弹簧栓子经皮门静脉标记,这在晚期肝硬化[222,223]患者中并非没有风险。‘
’
The use of transabdominal ultrasound-guided portal vein puncture (Figure (Figure7)7) overcomes these problems and has been shown to reduce the radiation dose[224].
使用经腹部超声引导下的门静脉穿刺(图(图7)7)克服了这些问题,并已被证明可以减少辐射剂量[224]。
It is also useful in patients with portal vein thrombosis.
它也适用于门静脉血栓形成的患者。
Intravascular ultrasound guidance is a potentially exciting tool for portal vein access and has been shown to reduce the radiation dose, multiple needle passes, and volume of contrast used compared to the conventional technique[225,226].
血管内超声引导是门静脉通路的一个潜在的令人兴奋的工具,与传统技术[225,226]相比,已被证明可以减少辐射剂量、多次针通和造影剂量。
However, intravascular ultrasound has a learning curve and requires additional expensive equipment.
然而,血管内超声有一个学习曲线,需要额外的昂贵的设备。
CO2: Carbondioxide; TIPS: transjugular intrahepatic portosystemic shunt; USG: Ultrasonography; IVUS: Intravascular ultrasound; CBCT: Cone beam computed tomography.
Recently, 3D cone-beam computed tomography-guided portal vein cannulation using image fusion technology has been described[227,228].
近年来,利用图像融合技术的三维锥束计算机断层扫描引导的门静脉插管被描述为[227,228]。
It allows registration of pre-procedural 3D multimodality imaging data sets with 2D fluoroscopy for real-time instrument visualization and has been shown to reduce the number of liver puncture, complications, and failed attempts at TIPS stent placement.
它允许用2D透视注册术前三维多模式成像数据集,以实时仪器可视化,并已被证明可以减少肝穿刺、并发症和TIPS支架放置失败的次数。
Apart from the difficulty in portal venous access during procedure and associated technical challenges, various other complications associated with the technical aspect of TIPS have been described.
除了手术过程中门静脉通路的困难和相关的技术挑战外,与TIPS技术方面相关的各种其他并发症已被描述。
A comprehensive discussion on these technical aspects is beyond the scope of this review.
对这些技术方面的全面讨论超出了本综述的范围。
Nonetheless, Table Table33 shows a concise and clarified discussion of these pertinent challenges.
尽管如此,表表33显示了对这些相关挑战的简明和明确的讨论。
|