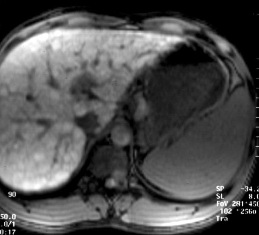
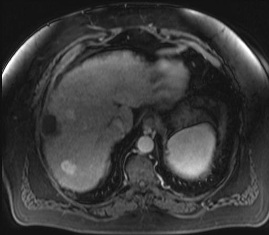
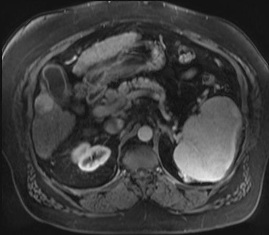
结果显示:
细针活检(FNB)在大多数病人70%可以建立肝癌的诊断。但有时需要2~3次的活检。 超声增强和MRI诊断的精确性 超声增强联合MRI诊断的精确性 在临床实践中作为肝癌的诊断工具必须显示为100% 的特异性以避免假阳性。 作为影像学,多血管病变可以采用包括超声或增强超声,增强CT,或增强MRI,最终可以考虑使用血管造影。这些影像学的工具应该是高质量,由有经验的医生进行影像学的解释和操作。 活检的阳性预测值:对于肝癌来说活检出肝癌细胞,阳性预测值为100%,但阴性时,从来就不做为一种诊断的结论。若为活检阴性,有时需要重复两次以上的活检。而对于1~2厘米的病变密切监测的结果>重复穿刺。对于小肝癌或非常早期小肝癌需要病理专家进行判定和诊断,特别是对那些术语上分化为异质性(Heterogeneity)活检标本。 活检的阴性占10~20%[3,4]
并发症0.006%~0.3% 肿瘤种植转移1~3%,种植转移的危险因素和什么有关不得而知,可能和针的大小,穿刺的次数,肿瘤的位置,肿瘤的分化程度有关,目前尚无大样本的研究[4~7]。 Ahn [13]等人总结肝癌超声引导下介入操作(PEI,FNAB,PTBD)5092例,共有针道种植转移7例,占全部病例的0.14%。
组织芯活检的结果要好于细针活检。
(1)前者可以显示肝癌细胞小樑类型(trabecular pattern)的结构信息,增厚的脊索(thickened cords)以及由血管窦状隙形成的分隔等等。
假腺管(Pseudoglandular)
实性肿瘤(Solid)
硬癌(Scirrhous)
透明细胞(Clear cells)
纤维板层(Fibrolamellar)
(2)活检结果产生的肿瘤细胞分级影响治疗后的生存因素。 (3)如果可能进行免疫染色:
1. hepatocyte paraffin 1 (90% HCC)
2. alpha fetoprotein (40%–50%)
3. CD34 和 CD10 其弥漫染色在HCC小樑周围的上皮细胞
4. polyclonal carcinoembryonic antigen
5. glypican-3 (敏感性 83% ; 特异性 96%)
关于肝移植前的活检 有两个问题需要回答:
(1)是否肝硬化失代偿的病人和高MELD(Model for End-Stage Liver Disease)分值的病人有或没有小肝癌并不改变肝移植的适应症。
(2)代偿性肝硬化和低MELD分值病人,肝移植的判定仅仅取决于是否同时存在肝癌。若没有肝癌,肝移植是否为无价值的肝移植。
但明确肝癌的诊断是绝对的先决条件
31%的肝移植病人,早期肝癌的诊断仅仅基于影像学,而体外病理并没有恶性病变的证据。而在移植界,活检在适合移植的病例中可以避免。主要原因是活检可以导致种植转移(seeding),弥漫性播散(hematogenous dissemination)/移植后免疫抑制加速肿瘤的生长。活检的风险必须与无价值肝移植风险平衡[8]。
结论:
活检对于无肝硬化病人是适应症
肝硬化病人的肝内结节应遵循AASLD的推荐
活检对于肝移植前的病人在特殊情况下是有用的。
肿瘤的分级影响切除后和肝移植后的生存率。肝移植前强调肿瘤的分化程度,中度和低度分化的肿瘤细胞和复发风险增高有关。肝移植前的组织学对于定义病人是否为肝移植适应症是有用的方法,甚至如果他们在通常标准之外,如超Milan标准或UCLC标准。
According to the European Association for the Study of the Liver (EASL) and the American Association for the Study of Liver Diseases (AASLD) [14] a nodule larger than
2 cm that displays a typical vascular pattern on contrastenhanced CT or contrast-enhanced MRI can be considered HCC without biopsy.
不是所有人都会认为肝癌活检是必要的
反对者认为肝癌的流行病学和危险因素(病毒性肝炎,黄曲霉毒素,慢性肝脏疾病)十分清楚。临床和影像学表现也并非茫无所知,包括二期预防中高危人群的“结节”监测,肿瘤在肝硬化背景下的影像学特征,以及门静脉瘤栓等。甲胎蛋白作为肿瘤标记物有较高的敏感性和特异性。如果>400,结合影像学表现可以确诊肝癌。
肝硬化和肝癌识别组织学级别(histological cascade)已经成规,但并没有在组织学方面明确定义。小结节中的增生结节(dysplastic nodule)和早期肝癌之间组织学区别是困难的,而且存在“观察者间的差异”(inter-observer variation)。即同一病理学改变,不同观察者之间有不同的结论。
谁是癌?
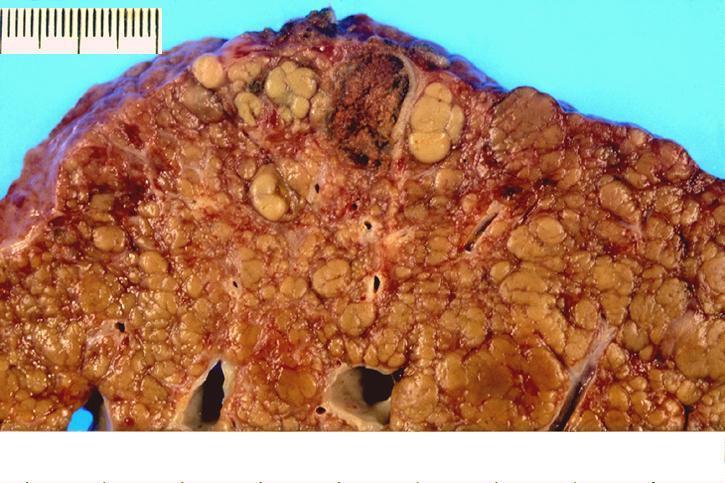
谁是癌?
在肝硬化中组织学包括:
再生结节(Regenerative nodule)
增生结节(Dysplastic nodule)
高分化结节(Well differentiated nodule)
中分化肝癌(Moderately differentiated HCC)
随着去分化(de-differentiation)程度的增加,动脉血流增加,门静脉血流减少。
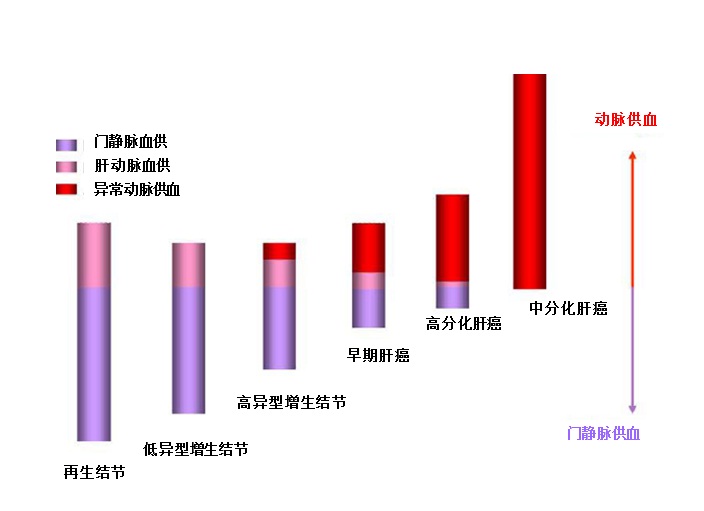 切除标本显示非侵入性影像技术可以清晰地显示病变,评估血管性和细胞特点,从而精确地诊断肝癌。另外高危人群中肝硬化门静脉高压特征可以相当可靠地诊断通过影像学诊断。
MRI增强小肝癌增强表现
MDCT小肝癌发现率为[9]
如果影像学不能决定≤2cm病变,密切监测也可以不改变病人的预后情况下更精确诊断。
如果肝移植的适应症是肿瘤性的,这一点对于潜在肝移植适应症的患者非常重要的。
病变<2cm的意义:
病人LDLT(living donor liver transplant)超米兰标准( Milan criteria),无瘤生存取决于肿瘤的直径(>5cm)而不是肿瘤的数量[10]。
动脉化病变(Arterialised lesions)在肝硬化病人中,存在高达10%。
T2和T1门静脉期等信号强度,动脉化病变中的93%,切除肝组织中没有相关的组织学发现[11]。
在最初影像学检查假阴性发现或不能决定肝癌的影响和意义是什么[12]?
结论:未定结节监测并不影响预后。生长率反应肿瘤的生物学和分化程度。 与肝癌不同的局灶性肝病变或其组织学前期病变可以相当可靠地有非创伤性影像所诊断。在肝硬化病人,转移相当罕见或从来就没有发生过。 活检有出血风险,如果病变位于肝缘,没有辅助的消融措施容易发生肿瘤的种植。 在组织学解释上有观察者间偏差。已经认识到组织学分化程度和预后相关,分化差的肿瘤生存期差,甚至<3cm肿瘤移植术后结果较差。但是个别肿瘤显示较广泛的分化程度,那么哪种分化程度和预后有关呢? 肉眼可见的血管侵润和分化,这应该是影像学所扮演的角色。
如果影像,肿瘤标记物和辅助的临床资料诊断为肝癌,将决定治疗方式,肝切除,肝移植,肝局部消融治疗或栓塞治疗,它们或单独,或联合治疗。
临床实验和组织诊断的肿瘤学原理指导临床实践吗?
组织库(tissue banks)和靶向生物制剂的证据,分子生物指标能够观察到。
**********************************************************************************************************
* 非肝炎性肝硬化(Non Hepatis Cirrhosis)包括: 1. 基因性血色素沉积症 Genetic hemochromatosis 2. 原发性胆汁肝硬化 Primary biliary cirrhosis 3. α1抗胰蛋白酶缺乏症 alpha 1-Antitrypsin Deficiency 4. 自体免疫性肝炎 Autoimmune hepatitis
3. Huang et al . J Hepatol. 1996;25:334–338 4. Liver Transpl 13:S17–S23, 2007. © 2007 AASLD 5. Chang et al Korean J Radiol. 2008;9:268–274; 6. Takamori et al Liver Transpl. 2000;6:67–72 7. Bravo et al N Engl J Med. 2001;344:495–500 8. Wiesner RH, Freeman RB, Mulligan DC. Liver transplantation for hepatocellular cancer: the impact of the MELD allocation policy. Gastroenterology 2004; 127: S261–S267 9. Monzawa S Am J Roentgenol 2007;188;147-153 10. Soejima Y Transplantation 2007 15;83:893-9 11. Holland A et al Radiology 2005;237:938-44 12. Choi Det al Radiology 2007 ;244:766-83
14. |