|
经皮消融术
目前还有多项正在世界各地开展的研究对切除术和局部消融术进行直接比较。据我们所知,目前仅有一项研究的结果得到报道(该研究共纳入76例肿瘤直径小于3cm、肿瘤数目1-2个的患者)[98]。但是这一研究的方法学问题还需要进一步证实。 Wang[链接]等人对BCLC分期为超早期/早期肝癌RFA与外科切除进行比较显示,就整体生存期而言,外科切除和射频消融之间没有显著性差异。但是外科切除无病生存率比RFA要好。
经皮消融术通常是指射频消融或经皮无水乙醇消融术。对于直径小于3厘米,患者无被选资格进行肝移植或外科切除,或由于伴发其它病,或由于肝功能失代偿的肝癌是一种潜在的治愈手段。经皮无水乙醇注射(Percutaneous ethanol injection ,PEI)对直径小于2cm的大多数小肝癌可以达到完全坏死[28],临床效果极佳。然而,尽管小肝癌选择什么样的局部消融术最好并没有定论,但在医疗资源充沛的发达国家,射频消融(radiofrequency ablation ,RFA)比PEI更经常得到应用。随机对照试验表明,RFA与PEI获益病人成功的几项标准测量[29]:
随后的研究,包括另外两项随机对照试验显示射频消融治疗早期肝癌疗效类似外科手术切除效果,而且相关并发症发生率较低,也比外科手术费用节省[30-33](下表)。 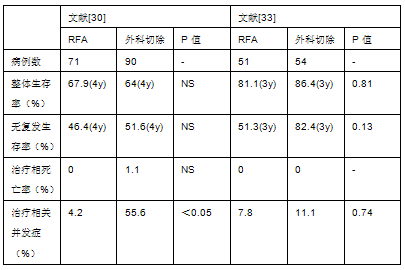 肝动脉化疗性栓塞 动脉栓塞是无法手术切除HCC患者最常用的主要治疗手段[4,11,93]。早期时动脉栓塞并不是一线治疗选择,因为日本的一项综述发现其治疗结局不及手术或者经皮消融术[11,93]。肝动脉阻断可诱导富血供的HCC发生大范围坏死。治疗时可将栓塞物质(通常是明胶海绵或微球)与混合于腆油中的化疗药物一起选择性动脉内给药(化疗栓塞)。阿霉素,丝裂霉素和顺铅是常用的抗肿瘤药物。动脉化疗栓塞可以获得15%-55%的部分缓解率[4,34,99~102,并可以明显延缓肿瘤进展和血管浸润(相关综述见[101]) (1iiDii)。 通过对1978年至2002年间发表的随机对照试验的系统性综述分析,发现共纳入516名患者的7项对比栓塞术与保守治疗的研究,其中5项是以阿霉素或顺铅为基础的化疗栓塞[34]。一共两项研究提示栓塞治疗有生存获益[99,100],其中一项确定了疗效是生存时间的独立预测指标[99]。荟萃分析表明,栓塞术/化疗栓塞术比对照组显示生存获益34 (1 iiA)。总体而言,中期HCC患者的自然中位生存时间预计在16月左右,而化疗栓塞术使患者的中位生存时间延长到20月。目前,还没有足够证据确定最佳化疗药物的选择和最佳再治疗方案。上述两项显示阳性结果的随机对照试验中均为每年进行3-4次治疗,分别使用阿霉素和顺铂作为化疗药物[99,100] (1 iiA)。化疗栓塞的临床获益的判断不应该被治疗本身可能诱导的肝衰竭所影响。最佳候选患者为肝功能储备良好且无症状的多结节性肿瘤患者,并且无血管浸润或者肝外扩散[99,101],而伴有肝功能失代偿或者肝衰竭( Child-Pugh B-C级)的患者应该被排除在外,因为栓塞治疗所致的缺血性损伤可能进一步诱发严重不良事件[102]。"最佳患者"选择标准的异质性可能导致截然相反的结果,因此在设计和分析RCT时应该考虑到这一点。
目前已经采取了许多策略旨在进一步改善化疗栓塞术的抗肿瘤活性和临床获益。在一II期临床试验中,我们发现含有阿霉素的缓释颗粒(drug-eluting beads)可以获得约70%的客观缓解率(采用EASL-WHO标准)。因为该缓释颗粒使药物可在1周时间内缓慢释放,研究中高浓度阿霉素(150mg)给药所致的系统性毒性作用并不严重[103]。这些结果为进一步开展III期临床试验评价生存时间奠定了基础。
其他局部治疗方法均未通过系统研究证实生存获益。某些治疗方法显示约20%的客观缓解率,例如131-I标记腆油或者Y-90的体内放疗,或者动脉内碘油栓塞。体内放疗已开始成为中期和晚期HCC患者的治疗选择。有一项开创性的随机对照试验比较了化学栓塞术和1-131体内放疗的差异,但至今尚未出现后续研究[104]。最近,一项共纳入209名晚期HCC患者的单中心队列研究显示Y-90治疗取得较高有效率,中位生存时间达到12月[105]。这一疗法需要进一步通过III期临床试验来验证疗效,或与标准治疗(索拉非尼)进行直接比较。
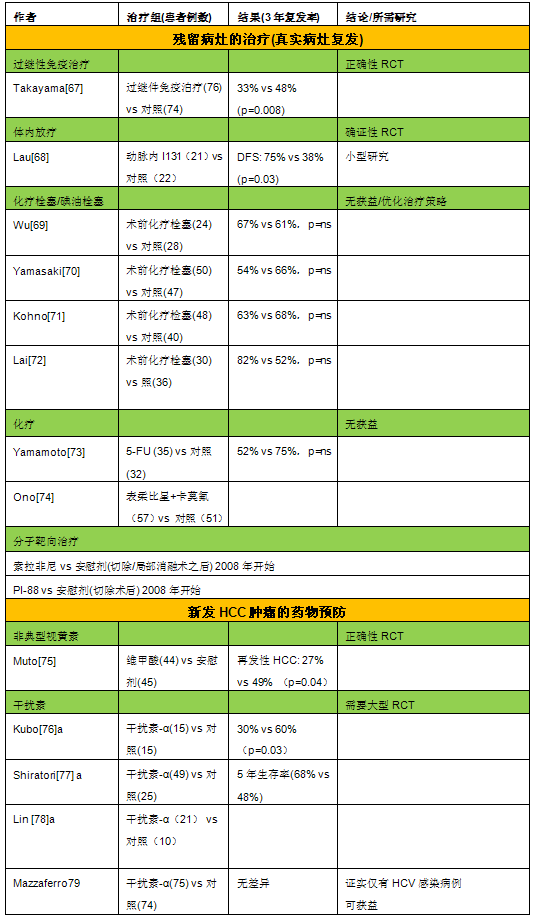
由于肝癌是多血管肿瘤,所以肝动脉化疗性栓塞(Transarterial chemoembolization,TACE)-用化疗药与明胶海绵颗粒或碘化油的混合物栓塞肝癌供血的肝动脉分支内-是一种有效的治疗策略。TACE主要的适应症是没有大血管侵润和转移的不可切除性肝癌,在BCLC分期中为B期的肿瘤。与单独的最好的支持治疗比较,TACE治疗改善这类病人中期的整体存活率。在两个随机对照试验,TACE组2年总生存率为31-63%,而对照组为11-27%[34,35]。TACE也被认为是早期肝癌由于肿瘤的位置无法进行射频消融治疗时的替代治疗。TACE,也经常作为肝移植术前缩小肿瘤大小的过渡性的治疗[24,36]。 由于急性肝失代偿的高度危险,肝功能差、门静脉瘤栓的病人不应该进行TACE治疗[37]。新的证据表明,在降低副反应率和提高生存率方面,用阿霉素药物洗脱微球(doxorubicin eluting beads,DC beads)进行TACE栓塞优于常规常规的TACE [38,39]。这种微球可主动吸收阿霉素,被栓塞至肝动脉分支后以较高的浓度缓慢释放到肿瘤血管内,而血清中的阿霉素浓度相对较低。 有关肝癌肝动脉化疗性栓塞的详尽内容请见本站其它栏目。 经动脉放疗性栓塞 经动脉放疗性栓塞(Transarterial radioembolization,TARE)是用放射性粒子90钇玻璃微球(TheraSphere®; MDS Nordion, Ottawa, Canada)或树脂微粒(Sir-Sphere®; Sirtex, Sydney, Australia)正越来越多地应用于不可切除性肝癌,包括多发肝癌,门静脉浸润性肝癌。TARE似达到相当于TACE的临床效果,其安全性是可接受的,耐受性也得到改善[40,41]。需要随机研究评估TARE的长期疗效和不良效应。 药物治疗 大多数肝癌对常规的、传统的化疗药物是不敏感的。此外,由于潜在的肝功能障碍,肝癌患者通常对肝癌的全身化疗的耐受性差。但是几个重要的分子和其路径,与肝脏癌发生的过程相关,包括受体酪氨酸蛋白激酶(Receptor tyrosine kinases,RTKs)、Wnt -β- catenin信号、泛素-蛋白酶体系统(ubiquitin-proteasome system),表观遗传学DNA修饰(epigenetic DNA modification-<promoter methylation and histone acetylation 启动子甲基化和组蛋白乙酰化>),PI3K -AKT - mTOR的通路,促进血管形成的分子( proangiogenic molecules)和端粒末端转移酶(telomerase)[42]。针对这些途径的药物正在积极的研究中。 索拉非尼,一种口服多激酶抑制剂,针对Raf kinase,血管内皮细胞生长因子受体(Vascular Endothelial Growth Factor,VEGFR)和血小板衍生生长因子受体(platelet-derived growth factor receptor,PDGFR)信号转导通路。其已经被美国FDA批准用于晚期肝癌(BCLC分期,C期;ECOG体力评分状况1-2,门静脉侵犯,淋巴结或肝外转移)病人。在一项III期的随机安慰剂对照研究中,602例晚期肝癌患者,索拉非尼组整体存活期为10.7个月,安慰剂组为7.9个月。索拉非尼治疗伴有疲劳,腹泻的和手足皮肤反应(已知的索拉非尼治疗相关副作用)等可以接受的不良影响[43]。另一个在亚太地区进行的试验也显示,索拉非尼治疗克改善整体存活率和可接受的副作用[44]。潜在治愈性治疗后(肝切除或射频消融)索拉非尼治疗应用(STORM clinical trial)[45],以及与TACE结合(SPACE clinical trial)目前正在进行中[46]。 主要的问题是,在欠发达地区HCC发病率高,可以从靶向药物治疗中获益的患者却无法负担治疗费用,所以不可能被普遍使用。比如,患者每月在sorafenib药物上的花费:中国$7300,美国$5400, 巴西$5000, 法国€3562, 韩国$1400。 很明显,随着包括人口流行病学,生物医学,药理学,医疗器械和临床研究持续不断的努力,未来肝癌治疗还将面临更多的选择。这些研究将进一步改进我们对HCC的这种“疾病全球的经济负担”*的理解,指导有效措施的实施以减少肝癌的发生,这是继乙肝疫苗注射,黄曲霉毒素污染控制之后,HCC下一个最好的方法。特别是包括WHO,政府和非政府组织,不同大陆,地区,科学和社区组织的全球合作。通过建立培训项目,提高义务人员的认识,使各地区,各层次医疗机构在成本效益的原则下改善高危人群的监控,早期诊断和治疗肝癌,这将更有效地协调各方努力(就像人们在全球建立的各种区域经济组织那样)以减少深受肝癌之苦的发展中国家的肝癌和慢性肝炎所带来的经济负担,特别是占有全球HCC发病总是一半的中国。而各级专业学会(肝外科,消化科,介入放射学科)的合作意愿,以推动政府行为的改进扮演着至关重要的角色。 辅助治疗预防肿瘤复发 HCC术后5年复发率可高达70%,复发的原因包括肝内转移(真实的复发)或者新发肿瘤(denovo)的出现[31,52~58]。这两种不同类型的复发可以通过比较性基因杂交技术、乙型肝炎病毒的整合模式、基因杂性缺失法进行DNA指纹分析、或者DNA芯片等加以辨别根据这些研究,人们发现60%-70%的复发病例是由于手术时未能发现的肝内转移病灶所导致,只有30%-40%为新发HCC。遗憾的是,目前还无法通过常规临床方法鉴别这些不同个体。真实复发病例一般在手术后2年内出现,其主要预测指标为血管浸润,组织学分化不良和卫星病灶(表2)[ 31,52~58]。新发肿瘤的特征为起病较晚,通常在手术2年后出现[56]。 预防和治疗复发肿瘤的措施最终应该随复发类型不同而异,这已在其他文章中进行了综述[30]。从预防角度而言,未能发现的肝转移病灶有可能通过化疗栓塞/碘油栓塞、体内放疗、化疗或过继免疫疗法、或分子靶向治疗等加以处理,而新发肿瘤则可能需要通过使用药物进行预防,例如视黄素或干扰素[79](图4,表3]。
HCC手术/局部消融术后辅助治疗的相关随机对照研究总结于表3。几所有已发表的RCT都是在亚洲进行的。在预防肿瘤复发方面,辅助性化疗栓塞和/或化疗并不能增加获益[69~72]。在一项募集了43名患者后提前中止的RCT研究中,用I131标记碘油进行体内放射治疗显示一定的阳性效果[68]。随着其它非对照研究也显示令人鼓舞的结果,该效应无疑值得进一步研究证实[80]。在一项有150名患者参加的试验中,过继免疫疗法(白介素-2和CD3抗体活化的淋巴细胞)可降低首次复发率(3年复发率:治疗组为33%,而对照组为48%)[67]。另有研究发现,视黄素在预防新发肿瘤方面也有相似效果[75]。目前所有这些措施尚未应用于临床实践中,其结果也需要通过其他研究进一步证实。干扰素在部分RCT中表现出一定的正面作用,包括手术/经皮消融术后的患者凡[78]。最近,首个在西方国家进行的RCT评价了干扰素-α治疗150名患者的疗效,研究总体显示阴性结果。然而,亚组分析却表明该项治疗在HCV患者中可预防晚期的新发肿瘤,为今后对这一治疗措施的进一步评价提供了理论基础[79]。由于至今尚无有效的辅助干预措施,目前迫切需要开展临床试验对切除术后的辅助治疗进行评估和研究。研究的主要终点是至肿瘤复发时间。针对两种不同类型的复发模式,其干预措施也是完全不同的,而联合治疗应该是最合理的策略。由于尚缺乏己经证实有效的治疗措施,将患者随机分至无治疗对照组目前还是合理的。随机化之前应该先根据肿瘤大小,结节数目/卫星病灶数目和血管浸润等进行分层。考虑到这些研究的复杂性,需要开展多中心的大规模研究。
全身系统治疗
激素类药物和传统的体外放射疗法对于HCC并无明显生存获益。针对7项RCT共898例患者的套萃分析比较了他莫昔芬(Tamoxifen)和保守治疗的差异。结果表明,他莫昔芬治疗既无抗肿瘤活性也无生存获益(1 iiA)[ 33]。此后报道的两项大型RCT[106,107]也均未发现他莫昔芬的生存获益。因此,这一治疗药物在晚期HCC治疗方面的结果令人失望。
目前共有9项RCT对系统(全身或静脉)化疗的作用进行了评价[33]。体外和体内试验中活性最强的药物为阿霉素和顺铂。己有临床试验对阿霉素系统化学治疗1000多名患者的效果进行了评价,结果表明部分缓解率在10%左右,未发现任何有关生存优势的证据(1iiA)[ 33,47]。香港研究组报告了一项顺铂/干扰素-α 2b/阿霉素/氟尿嘧啶(PIAF)联合化疗[108]与阿霉素单药治疗比较的大型RCT。PIAF方案的客观缓解率为20.9%,而阿霉素组为10.5%。PIAF和阿霉素组的中位生存时间分别为8.67月和6.83月,无显著组间差异。与阿霉素相比, PIAF方案的骨髓毒性发生率明显升高。PIAF方案组的治疗相关死亡率为9%,主要原因为HBV再激活和肝衰竭。因此,系统性化疗不适于治疗HCC,而广泛的毒性作用也使其很难作为临床试验的对照药物。
有关干扰素和奥曲肽的初步研究取得了令人鼓舞的效果,但缺乏后续研究的进一步验证。相关的3项治疗晚期HCC的III期研究已经完成,结果均为阴性。迄今为止HCC研究领域最大规模的RCT比较了Seocalcitol(一种维生素D样抗增殖分子)与安慰剂治疗746名患者的差异,研究结果显示总体生存时间并不存在明显组间差异( Seocalcitol组9.6月,安慰剂组9.2月)[ 109]。
一项纳入446例患者的临床试验比较了胸苷合成酶抑制剂诺拉曲特(Nolatrexed)与系统性阿霉素治疗的差异,结果仍为阴性(中位生存时间分别为5月和7.5月)[ 110]。最后,一项大型多中心RCT同样报告了有关微管抑制剂(T-67,来自Tularik公司)的阴性研究结果[111]。
HCC的分子靶向治疗:索拉非尼 对HCC分子发病机制的不断认识和分子靶向药物在肿瘤领域的逐渐应用,为HCC这一复杂恶性肿瘤的治疗开辟了令人鼓舞的新趋势(见综述[39,112])。表5总结了目前通过相关II期和III期临床试验进行测试的HCC分子靶向药物。绝大多数治疗以阻断细胞增殖和生存相关信号传导通路为目的。其他药物则依赖于阻断生长因子或者与疾病播散相关的信号通路(即,血管生成,端粒酶活化)等。
目前正在研究的大多数药物都是通过阻断细胞膜酶氨酸激酶受体(TKRs)而发挥作用。这些受体的配体包括EGF, PDGF, VEGF和HGF等。这些配体可以激活RAS/MAPK信号传导通路并且诱导AP1基因家族的转录,例如c-fos和c-jun等诱导细胞增殖的关键因子。与其他恶性肿瘤相似,受体(尤其是EGFR)本身的体细胞突变(somatic mutations)也同样可致该信号通路的持续激活A[25]。另外,抑癌基因的失活,如RASS-FR1和NORE1,在晚期HCC中也非常普遍[39]。此外,这些生长因子还可诱导PI3K/Akt/mTOR信号通路或者HGF/c-met通路的活化[39]。
III期临床研究:索拉非尼
索拉非尼(多吉美)是一种口服多激酶抑制剂,对多种酪氨酸激酶(VEGFR2, PDGFR,c-Kit受体)和丝氨酸/苏氨酸激酶( b-Raf, p38) 发挥抑制活性[113]。所以,这一药物可同时作用于肝癌发生机制中的两条主要通路:其一,通过抑制VEFGR2和PDGFR阻断肿瘤血管生成;其二,通过阻断Ras/MAPK信号通路(bRAF)的活化抑制肿瘤细胞增殖。索拉非尼可以延长肾癌患者的无进展生存时间,并且已获批准用于肾癌的治疗[113]。临床前试验显示索拉非尼在HCC异种移植动物模型中的显著抗肿瘤活性[114]。此后,一项纳入137例晚期HCC患者的II期临床试验表明,索拉非尼可使35%的患者获得持续至少4月的疾病稳定期,中位总体生存时间达9.7月。部分缓解率不足10%。值得注意的是, RAS/MAPK通路活化的患者(根据p-Erk免疫染色结果判断)至疾病进展时间为178天,而没有该通路活化的患者仅为46天[115]。 随机双盲安慰剂对照的III期临床试验中,索拉非尼治疗晚期HCC患者的生存时间延长了3月,这一结果不仅有统计学意义,也更具临床价值[29]。这一多中心研究评价了索拉非尼(400mg,一天两次) (299例)与安慰剂(303 例)比较治疗晚期肝细胞癌患者的疗效差异,所有患者既往未接受过系统性药物治疗。研究主要终点为生存时间。研究在第二次预定的中期分析后由于治疗组的显著生存获益而提前中止,此时共出现321例死亡事件。索拉非尼治疗组的中位总体生存时间为10.7月,安慰剂组为7.9月(死亡风险比, 0.69; 95%可信区间, 0.55-0.87; p<0.001)。索拉非尼治疗组的中位至疾病进展时间为5.5月,而安慰剂组为2.8月(风险比为0.58; 95%可信区间0.45-0.74; P < 0.001)。索拉非尼组有7例患者(2.3%)达到部分缓解,而安慰剂组为2例(0.7%)。索拉非尼组中发生腹泻,体重减轻,手足皮肤反应和低磷血症者更为常见。这项RCT结果成为肝癌这一复杂疾病治疗中的重大突破[29]。索拉非尼是首个可以延长HCC患者生存时间的系统性治疗药物,因而成为晚期HCC患者治疗的新标准(表1)。
这一药物己经通过FDA和EMEA的批准用于治疗HCC。这些结果为HCC临床试验开辟了新的研究方向。未来的研究无疑将继续探索索拉非尼在根治性治疗(包括切除术或者局部消融术等)后的辅助治疗作用,或联合化疗栓塞治疗中期HCC患者,以及联合其他分子靶向药物治疗晚期患者的意义。在后两种情况下,索拉非尼还应当成为这些试验中的对照组用药。
正在进行II 期临床研究药物 Ras/MAPK信号传导通路的有效阻断可通过应用针对EGFR(西妥昔单抗,爱必妥)或者ErbB2/Her2(曲妥珠单抗,赫赛汀)的单克隆抗体而实现。 西妥昔单抗己通过FDA批准用于治疗结直肠癌,而曲妥珠单抗可用于治疗有Her2过度表达的转移性乳腺癌。另一方面,该信号通路也可以通过针对EGFR催化域(catalytic domain)的小分子药物如埃罗替尼(Tarceva)或者吉非替尼(Iressa)等获得成功抑制。拉帕替尼(Tykerb)可同时阻断EGFR和Her2。埃罗替尼己知可有效作用于晚期非小细胞肺癌。临床前试验和临床研究均表明埃罗替尼(Erlotinib)在HCC中具有抗肿瘤活性。在HCC细胞株的体外研究中,埃罗替尼单独或者与化疗药物联用均可明显抑制细胞增殖并促进细胞凋亡。此外,埃罗替尼和化疗药物联用还可产生附加效应。此后,同一研究组还发现西妥昔单抗(Cetuximab)对于HCC细胞株具有抗增殖作用和一定程度的促细胞凋亡作用[116]。其他研究者在大鼠肝硬化实验模型中证实另一酪氨酸酶抑制剂吉非替尼(Gefitinib)可减少HCC结节数目[117]。一项短期II期临床试验研究了埃罗替尼治疗38名中晚期HCC患者的疗效,尽管研究显示中位生存时间为13个月,但该结果是否反映了真实的药物相关效应还是患者选择的偏差尚有待确认[118]。在一项近期的研究中,埃罗替尼和贝伐单抗联用(贝伐单抗是VEGF的单克隆抗体)的结果令人鼓舞,但是结果尚不明确[119]。尽管Her2/neu的过度表达和EGFR突变在HCC中并不常见,但在HCC实验模型中同时抑制这两个受体(EGFR和Her2)的初步数据令人鼓舞,目前有一项II期临床试验(拉帕替尼)正对这一联合靶向治疗进行评价。
磷酸化S6免疫组化研究显示,几乎一半的HCC患者存在Akt/mTOR信号传导通路激活。这一激活现象可能是由于配体过度表达(例如EGF, IGF1, IGF2)导致的信号增加,也可能是癌基因( P13KCA)或者抑癌基因(PTEN)的突变所致。Akt激活后通过不同分子促进细胞存活,其中mTOR至关重要[120]。
雷帕霉素作为一个广为人知的mTOR抑制剂,已经在体外试验中证实对HCC具有抗肿瘤活性[121]。由于雷帕霉素己被批准用作肝移植后的免疫抑制剂,将其作为HCC肝移植后的一线抗排异药物可能更具防治意义。
不过,这一假说尚未经广泛证实,有待通过设计严密的临床试验加以探索。有关雷帕霉素类似物(如Everolimus、Temsirolimus)的临床前研究和早期临床研究目前正在进行中。
HCC是一种极度高血供的恶性肿瘤,即使在肿瘤直径尚不足2cm的疾病早期就可能观察到这一特点。正是基于这一特点,现代影像学技术如核磁共振成像才能对这一疾病具有很高的敏感性,可精确诊断30%的小HCC病灶(1-2cm)[ 15]。HCC中存在大量促血管生成因子的过度表达,如VEGF、PDGF和促血管生成素2 (angiopoietin 2);实际上,有研究提示血浆VEGF浓度可能具有预后价值。上述信息为抗血管生成疗法在HCC中的应用奠定了理论基础,包括单克隆抗体(贝伐单抗)或者小分子靶向药物(舒尼替尼,索拉非尼)等。
贝伐单抗(avastin)是一种被批准用于结直肠癌和乳腺癌后肝转移的人源化单克隆抗体。一项HCC II期临床试验表明贝伐单抗具有中度的抗肿瘤活性(客观有效率10%),约60%的患者疾病稳定维持超过4月。然而,治疗组共33名患者有5名出现显著不良事件:其中,有2例患者死于治疗相关的消化道出血事件;
目前正在接受II期临床试验评价的还有其他VEGFR抑制剂:舒尼替尼(Sutent)和BMS-582664。舒尼替尼是最近被FDA批准用于治疗肾癌的多激酶抑制剂。研究者已经报告了两项针对HCC患者的II期临床实验。在欧州/亚洲开展的以50mg/天为研究剂量的报道中,中位生存时间为10.5月,但伴有严重肝脏相关毒性和死亡(10%病例) ;而以37.5mg为每日剂量的美国研究中观察到的毒性相对较小[124]。
W n t信号通路的经典途径( W n t / β -catenin)在至少30%的HCC患者中存在激活现象,成为可能的有效阻断靶位;但目前尚没有药物可以在不产生明显毒副作用的基础上有效阻断这一通路。该通路上有多个分子作用靶位,包括Wnt配体,Frizzled受体和TLF/ β -catenin复合体。ICG-001是一种可干扰β-catenin和TLF间相互作用的小分子,临床前研究证实具有一定相关活性[125]。抑制蛋白酶体活化的药物在II期临床试验中均获得阴性结果,如批准用于治疗多发性骨髓瘤的硼替佐米(Velcade®)。此外,在癌细胞永生化(immortality)中起关键作用的端粒酶可能也是HCC的潜在治疗靶点:进行中的一些II期临床试验正在研究针对端粒酶逆转录酶(TERT)的免疫接种治疗。
HCC临床试验设计中新的观察终点
分子靶向药物的特殊作用机制为其II期和III期对照临床试验研究提出一个问题:应该如何选择主要终点和次要终点。显然,III期临床试验的主要终点应该是生存时间,而辅助治疗的研究则应该是至复发时间。由于这类药物的主要疗效基本为细胞抑制作用,因此客观有效率仅能作为II期临床试验中较次要的替代疗效指标。实际上已有研究表明,尽管贝伐单抗(Bevacizumab)治疗肝转移癌患者客观有效率不到10%,仍显示出显著生存获益,与埃罗替尼(Erlotinib)治疗晚期肺癌、索拉非尼治疗肾癌的情况相似。因此,II期临床试验所选择的主要终点必须要能准确反应出药物稳定疾病的相关临床效应。这些终点通常需要符合"至事件发生时间( time-to-event)"的格式。无进展生存时间(PFS)是大多数实体恶性肿瘤的最佳替代指标,但对于HCC却可能有很大弱点,因为它同时观察到因疾病进展和因任何其他原因所导致的死亡事件。所以,近期由美国肝病学会和欧洲肝病学会召开的共识研讨会(亚特兰大2006)一致推荐使用至疾病进展时间(time-to-progression,TTP;即自患者进入研究到出现影像学疾病进展的时间)作为II期临床试验的主要终点。
很不幸,从以上可以看出,由于有太多的治疗选择,使目前肝癌治疗有些混乱。病人肝癌治疗的选择的困哪性在于缺乏设计良好的,随机的比较各种治疗方式的临床试验研究。不管怎么说,目前应用中的一些有希望的治疗选择将会被证明是有价值的。
* 疾病全球的经济负担:1993年,世界卫生组织、世界银行和美国哈佛大学,联合开展了一项名为《全球疾病负担研究》(Global Burden of Diseases,GBD)的研究。该研究发展了“伤残调整生命年”(Disability Adjusted Life Year, DALY)的概念,以疾病/外伤造成的DALY减少为单位(DALYs),评估社会整体的疾病负担。 传统的疾病流行状况及其严重度的研究,多数以发病率/患病率、或者病死率/死亡率为参数,用以评估疾病负担时有一定弊端。容易造成对高发病率(如上呼吸道感染)或高死亡率的疾病负担过高估。  肝细胞癌(HCC)起源于肝细胞,占原发性肝癌的90%。根据2020年全球癌症发病率、死亡率和患病率(GLOBOCAN),全球HCC是第六大常见癌症,也是癌症相关死亡的第三大常见原因。HCC预后不佳的原因是HCC早期无症状,诊断较晚,
晚期HCC的其他一线治疗包括广谱酪氨酸激酶抑制剂(TKIs),如
然而,这些策略提供名义上延长生存曲线,引起广谱毒副作用,患者最终产生治疗耐药性。HCC中一些常见的突变,如端粒酶逆转录酶(TERT)、连环蛋白β 1 (CTNNB1)和肿瘤蛋白p53 (TP53)基因,仍然被认为是不可治疗的。 在这种情况下,确定合适的基因靶点和特定的基因传递方法为安全有效地治疗HCC创造了基因和免疫疗法的潜力。潜在的基因靶点和先进技术(如溶瘤病毒载体、纳米颗粒、嵌合抗原受体(CAR)-T细胞、免疫疗法、簇状规则间隔短回文重复序列CRISPR-相关蛋白9 (CRISPR/Cas9))等方面阐述了HCC治疗的现状,并对其治疗前景进行了展望。 名义上:做某事时用来作为依据的名称或称号。与事物的实际有别的名称。比如以革命的名义。还有其他意思是:表面上;形式上;仅限于称号或名目上。(百度) CRISPR(/'krɪspər/,Clustered Regularly Interspaced Short Palindromic Repeats)是原核生物基因组内的一段重复序列,是生命进化历史上,细菌和病毒进行斗争产生的免疫武器,简单说就是病毒能把自己的基因整合到细菌,利用细菌的细胞工具为自己的基因复制服务,细菌为了将病毒的外来入侵基因清除,进化出CRISPR-Cas9系统,利用这个系统,细菌可以不动声色地把病毒基因从自己的基因组上切除,这是细菌特有的免疫系统,是古菌和细菌抵抗病毒等外源遗传物质入侵的一种获得性免疫系统。(百度) 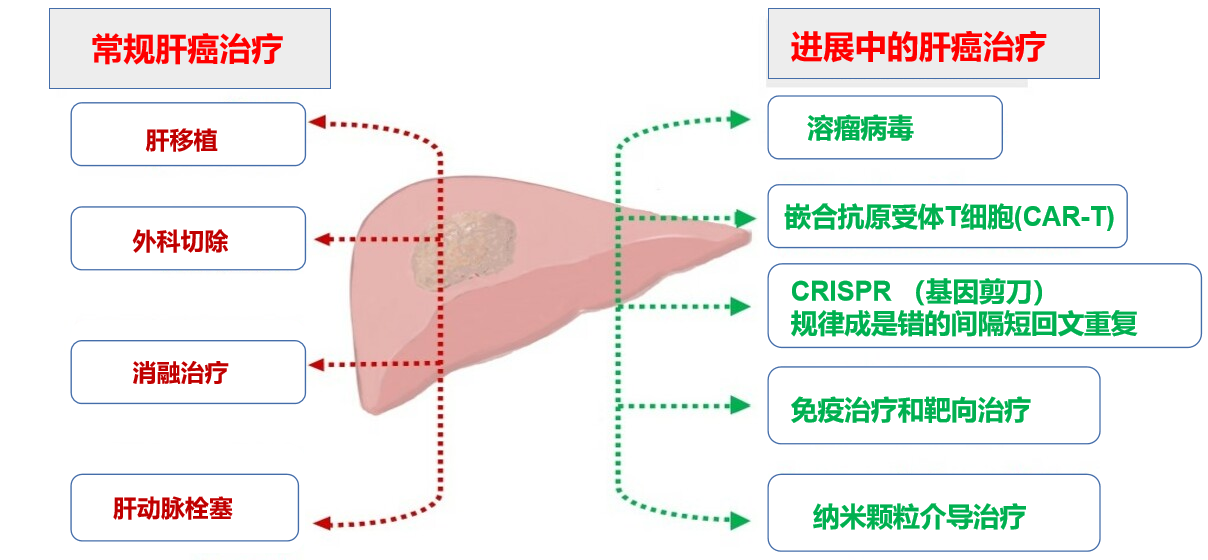 1. Ni, Y. H. et al. Hepatitis B virus infection in children and adolescents in a hyperendemic area: 15 years after mass hepatitis B vaccination. Ann. Intern. Med. 135, 796-800 (2001). 2. Chang, M. H. et al. Decreased incidence of hepatocellular carcinoma in hepatitis B vaccinees: a 20-year follow-up study. J. Natl Cancer Inst. 101, 1348-1355 (2009). 3. Hassan, M. M. et al. Risk factors for hepatocellular carcinoma: synergism of alcohol with viral hepatitis and diabetes mellitus. Hepatology 36, 1206-1213 (2002). 4. Ohki, T. et al. Obesity is an independent risk factor for hepatocellular carcinoma development in chronic hepatitis C patients. Clin. Gastroenterol. Hepatol. 6, 459-464 (2008). 5. Lok, A. S. et al. Incidence of hepatocellular carcinoma and associated risk factors in hepatitis C-related advanced liver disease. Gastroenterology 136, 138-148 (2009). 6. Chen, C. L. et al. Metabolic factors and risk of hepatocellular carcinoma by chronic hepatitis B/C infection: a follow-up study in Taiwan. Gastroenterology 135, 111-121 (2008). 7. Liaw, Y. F. et al. Lamivudine for patients with chronic hepatitis B and advanced liver disease. N. Engl. J. Med. 351, 1521-1531 (2004). 8. Matsumoto, A. et al. Efficacy of lamivudine for preventing hepatocellular carcinoma in chronic hepatitis B: A multicenter retrospective study of 2795 patients. Hepatol. Res. 32, 173-184 (2005). 9. Yuen, M. F. et al. Long-term lamivudine therapy reduces the risk of long-term complications of chronic hepatitis B infection even in patients without advanced disease. Antivir. Ther. 12, 1295-1303 (2007). 10. Cammà, C., Giunta, M., Andreone, P & Craxl, A. Interferon and prevention of hepatocellular carcinoma in viral cirrhosis: an evidence-based approach. J. Hepatol. 34, 593-602 (2001). 11. Nishiguchi, S. et al. Prevention of hepatocellular carcinoma in patients with chronic active hepatitis C and cirrhosis. Lancet 357, 196-197 (2001). 12. Yoshida, H. et al. Interferon therapy reduces the risk for hepatocellular carcinoma: national surveillance program of cirrhotic and noncirrhotic patients with chronic hepatitis C in Japan. IHIT Study Group. Inhibition of Hepatocarcinogenesis by Interferon Therapy. Ann. Intern. Med. 131, 174-181 (1999). 13. Papatheodoridis, G. V., Papadimitropoulos, V. C. & Hadziyannis, S. J. Effect of interferon therapy on the development of hepatocellular carcinoma in patients with hepatitis C virus-related cirrhosis: a meta-analysis. Aliment. Pharmacol. Ther. 15, 689-698 (2001). 14. Di Bisceglie, A. M. et al. Hepatitis C-related hepatocellular carcinoma in the United States: influence of ethnic status. Am. J. Gastroenterol. 98, 2060-2063 (2003). 15. Bruix, J. & Sherman, M. Management of hepatocellular carcinoma. Hepatology 42, 1208-1236 (2005). 16. Forner, A., Reig, M. E., de Lope, C. R. & Bruix, J. Current strategy for staging and treatment: the BCLC update and future prospects. Semin. Liver Dis. 30, 61-74 (2010). 17. Farinati, F. et al. Early and very early hepatocellular carcinoma: when and how much do staging and choice of treatment really matter? A multi-center study. BMC Cancer 9, 33 (2009). 18. Imamura, H. et al. Risk factors contributing to early and late phase intrahepatic recurrence of hepatocellular carcinoma after hepatectomy. J. Hepatol. 38, 200-207 (2003). 19. Llovet, J. M., Fuster, J. & Bruix, J. Intention-to-treat analysis of surgical treatment for early hepatocellular carcinoma: resection versus transplantation. Hepatology 30, 1434-1440 (1999). 20. Teh, S. H. et al. Hepatic resection of hepatocellular carcinoma in patients with cirrhosis: Model of End-Stage Liver Disease (MELD) score predicts perioperative mortality. J. Gastrointest. Surg. 9, 1207-1215 (2005). 21. Mazzaferro, V. et al. Liver transplantation for the treatment of small hepatocellular carcinomas in patients with cirrhosis. N. Engl. J. Med. 334, 693-699 (1996). 22. Yao, F. Y. et al. Liver transplantation for hepatocellular carcinoma: expansion of the tumor size limits does not adversely impact survival. Hepatology 33, 1394-1403 (2001). 23. D'Amico, F. et al. Predicting recurrence after liver transplantation in patients with hepatocellular carcinoma exceeding the up-to-seven criteria. Liver Transpl. 15, 1278-1287 (2009). 24. Yao, F. Y. et al. A prospective study on downstaging of hepatocellular carcinoma prior to liver transplantation. Liver Transpl. 11, 1505-1514 (2005). 25. Yao, F. Y. et al. Excellent outcome following down-staging of hepatocellular carcinoma prior to liver transplantation: an intention-to-treat analysis. Hepatology 48, 819-827 (2008). 26. Trotter, J. F., Wachs, M., Everson, G. T. & Kam, I. Adult-to-adult transplantation of the right hepatic lobe from a living donor. N. Engl. J. Med. 346, 1074-1082 (2002). 27. Vakili, K. et al. Living donor liver transplantation for hepatocellular carcinoma: Increased recurrence but improved survival. Liver Transpl. 15, 1861-1866 (2009). 28. Vilana, R. et al. Tumor size determines the efficacy of percutaneous ethanol injection for the treatment of small hepatocellular carcinoma. Hepatology 16, 353-357 (1992). 29. Lin, S. M., Lin, C. J., Lin, C. C., Hsu, C. W. & Chen, Y. C. Radiofrequency ablation improves prognosis compared with ethanol injection for hepatocellular carcinoma < or =4 cm. Gastroenterology 127, 1714-1723 (2004). 30. Chen, M. S. et al. A prospective randomized trial comparing percutaneous local ablative therapy and partial hepatectomy for small hepatocellular carcinoma. Ann. Surg. 243, 321-328 (2006). 31. Lau, W. Y. & Lai, E. C. The current role of radiofrequency ablation in the management of hepatocellular carcinoma: a systematic review. Ann. Surg. 249, 20-25 (2009). 32. Livraghi, T. et al. Sustained complete response and complications rates after radiofrequency ablation of very early hepatocellular carcinoma in cirrhosis: Is resection still the treatment of choice? Hepatology 47, 82-89 (2008). 33. Lü, M. D. et al. Surgical resection versus percutaneous thermal ablation for early-stage hepatocellular carcinoma: a randomized clinical trial [Chinese]. Zhonghua Yi Xue Za Zhi 86, 801-805 (2006). 34. Llovet, J. M. et al. Arterial embolisation or chemoembolisation versus symptomatic treatment in patients with unresectable hepatocellular carcinoma: a randomised controlled trial. Lancet 359, 1734-1739 (2002). 35. Lo, C. M. et al. Randomized controlled trial of transarterial lipiodol chemoembolization for unresectable hepatocellular carcinoma. Hepatology 35, 1164-1171 (2002). 36. Alba, E. et al. Transcatheter arterial chemoembolization in patients with hepatocellular carcinoma on the waiting list for orthotopic liver transplantation. AJR Am. J. Roentgenol. 190, 1341-1348 (2008). 37. Chan, A. O., Yuen, M. F., Hui, C. K., Tso, W. K. & Lai, C. L. A prospective study regarding the complications of transcatheter intraarterial lipiodol chemoembolization in patients with hepatocellular carcinoma. Cancer 94, 1747-1752 (2002). 38. Dhanasekaran, R. et al. Comparison of conventional transarterial chemoembolization (TACE) and chemoembolization with doxorubicin drug eluting beads (DEB) for unresectable hepatocelluar carcinoma (HCC). J. Surg. Oncol. 101, 476-480 (2010). 39. Lammer, J. et al. Prospective randomized study of doxorubicin-eluting-bead embolization in the treatment of hepatocellular carcinoma: results of the PRECISION V study. Cardiovasc. Intervent. Radiol. 33, 41-52 (2010). 40. Geschwind, J. F. et al. Yttrium-90 microspheres for the treatment of hepatocellular carcinoma. Gastroenterology 127 (Suppl. 1), S194-S205 (2004). 41. Sangro, B. et al. Radioembolization using 90Y-resin microspheres for patients with advanced hepatocellular carcinoma. Int. J. Radiat. Oncol. Biol. Phys. 66, 792-800 (2006). 42. Roberts, L. R. & Gores, G. J. Hepatocellular carcinoma: molecular pathways and new therapeutic targets. Semin. Liver Dis. 25, 212-225 (2005). 43. Llovet, J. M. et al. Sorafenib in advanced hepatocellular carcinoma. N. Engl. J. Med. 359, 378-390 (2008). 44. Cheng, A. L. et al. Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma: a phase III randomised, double-blind, placebo-controlled trial. Lancet Oncol. 10, 25-34 (2009). 45. ClinicalTrials.gov Sorafenib as adjuvant treatment in the prevention of recurrence of hepatocellular carcinoma (STORM) [online], www.clinicaltrials.gov/ct2/show/NCT00692770 (2010). 46. ClinicalTrials.gov A phase II randomized, double-blind, placebo-controlled study of sorafenib or placebo in combination with transarterial chemoembolization (TACE) performed with DC bead and doxorubicin for intermediate stage hepatocellular carcinoma (HCC) [online],www.clinicaltrials.gov/ct2/show/NCT00855218 (2010). 47. The World Gastrointestinal Organization WGO practice guideline—hepatocellular carcinoma (HCC): a global perspective [online], http:// www.worldgastroenterology.org/ hepatocellular-carcinoma.html (2009). 48. Bruix, J. et al. Clinical management of hepatocellular carcinoma. Conclusions of the Barcelona-2000 EASL conference. European Association for the Study of the Liver. J. Hepatol. 35, 421-430 (2001). 49. Josep M. Llovet, M.D.et al. the SHARP Investigators Study Group. Sorafenib in Advanced Hepatocellular Carcinoma N Engl J Med 2008;359:378–90
50. Kudo M: Radiofrequency ablation for hepatocellular carcinoma: updated review in 2010. Oncology 2010;78:113–124
51. Mazzaferro V, Regalia E, Doci R, et al: Liver transplantation for the treatment of small hepatocellular carcinomas in patients with cirrhosis. N Engl J Med 1996;334:693–699
52. EASL-EORTC Clinical Practice Guidelines in HCC J.Hepatol.2012; 56:908-943 53. Nathan H, Cancer 2012 54. Lin KJ et al. BJS 2012 55. Lau et al, Ann Surg Oncol 2010 56. Bruix J, Gastroenterology 1996 57. Ripoll C, Gastroenterology 2007 58. Hidaka M et al. BJS 2012;99:1284–1289 59. Roayaie S and Mazzaferro V Hepatology 2012 60. Cucchetti A, et al. Ann Surg. 2009;250:922-8 61. Teh SH, Gastroenterology 2007 62. Wheeler, Proc Soc Exp Biol Med 1958 63. Fan ST, J Hepatobiliary Pancreat Sci 2010 64. Imamura H, JHP 2005 65. Lisotti A, Hepatology 2013 66. Truant S, JACS 2007 67. Yoo P J Clin Gastroenterol 2013;47:S11–S15 68. Sasaki A. Cancer 2005; Shi M. World J Surg 2004
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

