|
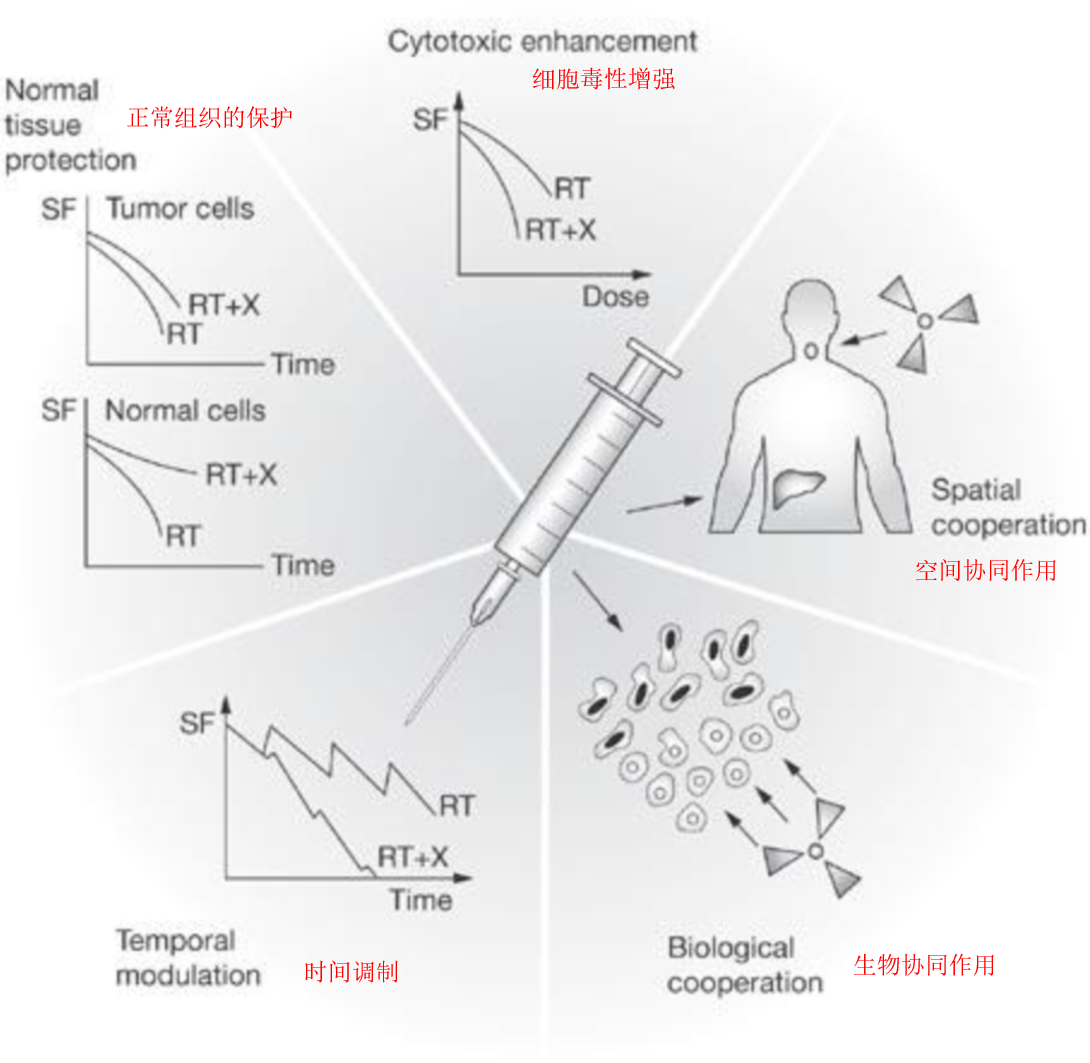
常组织保护
已提出几种药物可对正常细胞提供细胞保护或调节正常组织的细胞毒性反应。直到最近,这一研究领域的工作还集中在自由基清除剂上,但随着对放疗分子病理学(特别是晚期正常组织效应)认识的提高,我们突出了几种可减少或避免晚期毒性的新型干预措施。这些策略明显不同于试图改善疾病结局的策略,因为它们针对的是正常细胞和组织,而不是肿瘤。根据确切的作用机制,调节正常组织反应的药物在细胞毒性治疗之前、期间或之后给予可能有效。我们认为,旨在改善明显临床损害的药物不属于这一类(图2)。临床目的是在不影响肿瘤控制的情况下,降低早期和/或晚期副作用的发生率、严重程度或持续时间。这些药物主要在非肿瘤动物的正常组织模型中进行体内试验。在可移植的啮齿类动物或异种移植肿瘤中可以证明对肿瘤的不同影响。许多临床前或早期临床试验中的策略都属于这一类别,例如,在早期有反应的正常组织中刺激干细胞增殖,如角质细胞生长因子以改善黏膜炎,或者使用氨磷汀进行细胞保护。第四十一条、第四十二条
细胞毒性增强
该策略旨在通过调节细胞DNA损伤的诱导或修复来增强细胞杀伤。因此,细胞毒性增强子改变了体外细胞生存曲线。一些靶向损伤识别和修复的药物也可能是时间调制的候选药物。具有附加细胞杀伤特性的药物可能被视为细胞毒性增强的临界情况,但除非它具有主动的生物靶向性,否则它不会比单纯的辐射剂量增加更有优势。生物合作需要细胞毒性增强子主动靶向肿瘤细胞。
为了增强细胞毒性,药物必须在照射时存在,即两种方式应同时给药,因为利用这一机制的药物直接改变了辐射诱导的细胞杀伤或修复的初始阶段(图2)。最佳调度应根据个体患者的药代动力学进行优化。例如,长春瑞滨结合微管蛋白并抑制微管形成,从而使细胞被阻滞在辐射敏感的G2/M期24最近的一项研究表明,长春瑞滨的药代动力学和药效学存在较大的患者间差异,患者之间的药物清除率差异超过4倍25这一发现应根据已证实的长春瑞滨对辐射细胞杀伤的细胞毒性增强的浓度和孵育时间的依赖性来观察,这与其作用机制一致。24, 26, 27
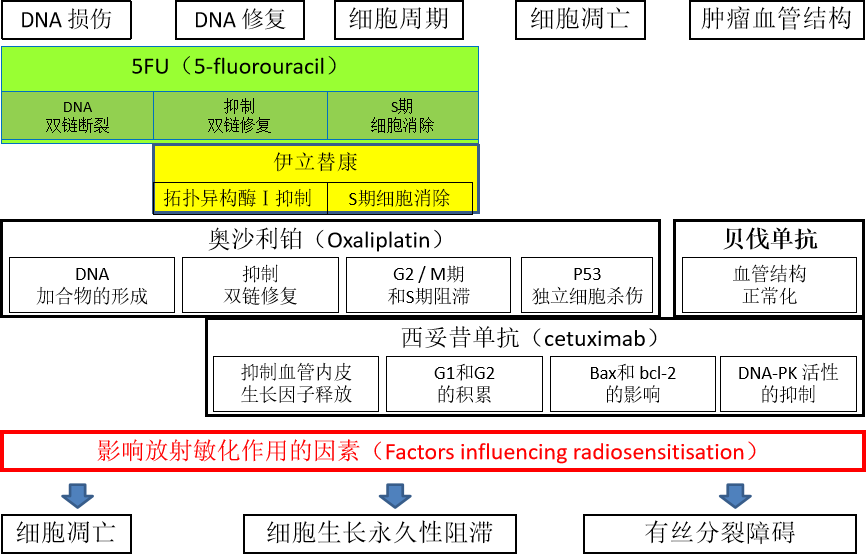
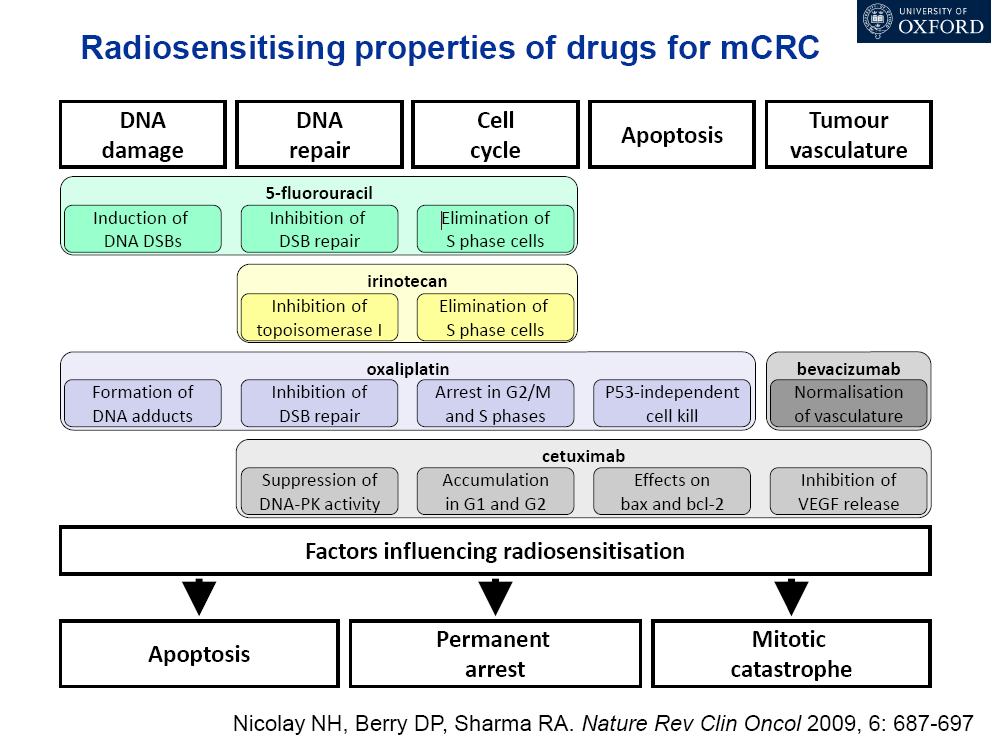
主要临床终点是局部区域肿瘤控制,因为放疗增强了局部效果。通常从体外细胞存活试验中寻求原理证明,因为有一种具有这种机制的药物被提议通过辐射影响直接的细胞杀伤。例如,将卤化嘧啶(如5-氟尿嘧啶)并入DNA似乎增强了辐射对DNA损伤的初始诱导28几十年来,5-氟尿嘧啶联合放疗治疗胃肠道恶性肿瘤(如直肠、胰腺)为执业肿瘤科医师提供了标准方案。另一个例子是突变的Ras与体外放射抵抗之间的关系,已有研究表明法尼酰基转移酶抑制剂可阻断突变的Ras的作用,这反过来又可在体外降低放射抵抗29最近已经在非小细胞肺癌细胞系中描述了这种相互作用(即通过单次2 gy剂量的紫杉醇效应的化学增强)30
生物合作
这一术语指的是针对不同细胞群的策略,或采用不同的机制来杀伤细胞或延缓肿瘤的再生。一个例子可能是靶向乏氧肿瘤细胞的药物,从而补充辐射的作用,而在氧合良好的细胞中辐射作用更大。
这两种方法可以同时或序贯给药(图2)。主要临床终点是局部区域控制,因为目的是增强放疗的局部效果。这一终点与靶向播散性疾病的药物相反,后者将提供“空间合作”。根据辐射和药物联合的作用机制,这些方法在体外或体内进行测试。例如,针对低氧微
|