CIREL:CIres REgistry for Lifepearl Microspheres
研究简介CIREL是一项全欧洲的前瞻性、观察性(非干预)研究,收集了经动脉化疗栓塞(TACE)装载伊立替康(LP-IRI)的LifePearl微球治疗结肠直肠癌(CRC)合并肝转移性疾病患者的数据。该研究观察患者整个癌症治疗期间的真实使用情况,并收集了关于安全性和毒性、有效性和治疗相关生活质量的广泛数据。数据的收集旨在形成一个证据基础,从中可以得出结论,如何改善患者的选择和优化治疗方案,以最终改善使用LifePeal微球进行TACE治疗的患者的治疗结果。 Lifepeal 微球
泰尔茂2018年宣布Lifepeal 微球作为欧洲的III类器械被批准。该批准还扩大了可加载的化疗药物,包括爱达柔比星Idarubicin和表柔比星Epirubicin。LifePearl®III类器械用于治疗原发性和继发性肝癌,它包括一系列具有生物相容性、亲水性、精确校准和能够以受控方式加载和释放化疗药物的微球。
自2015年推出以来,LifePearl®微球已在欧洲、中东和非洲应用于大约8000种TACE。Lifepeal 在各种科学期刊上发表了五篇论文,并在介入放射学大会上发表了多次演讲。
最近的一项研究表明,在用于经动脉化疗栓塞的11种抗癌药物中,基于三种HCC细胞系进行该治疗的最佳体外候选药物【Bulin M 2011】。
由于Lifepeal 高亲脂性,去甲柔比星比其他蒽环类化合物更有效地穿透细胞膜。
批准在LifePearl® 器械中装载额外的化疗药物,这为进行药物洗脱微球TACE(Drug-eluting microspheres transarterial chemoembolization)的介入放射科医生提供了更多的治疗选择。
LifePearl®是当时唯一CE标记的III类器械的药物洗脱微球,能够装载四种化疗药物:阿霉素(Doxorubici)、去柔吡星(Idarubicin)、表阿霉素(Epirubicin)和伊立替康(Irinotecan)。
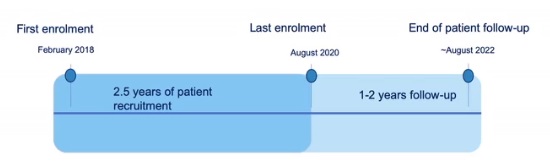
法国蒙彼利埃的尼斯中央医院大学(CHU)Boris Guiu 教授 说经批准的Lifepeal®CE标记是日常实践中HCC-TACE优化方案的第一步和重要的一步。 LifePearls® 可以完全和快速加载阿霉素类药物,并延时释放。与阿霉素和表阿霉素相比,阿柔霉素对HCC癌细胞株的疗效更大,这一点尤为重要。 CIREL横跨欧洲大陆,目标是在最初两年半的时间内招募多达150名患者,至少随访12个月,将于2022年2月结束。指导委员会同意,该登记不仅将创建一个重要的数据集,可能极大地影响TACE的患者选择,而且如果成功,可能会刺激对介入肿瘤程序的进一步研究。  CIREL 指导委员会 研究终点 Endpoints
主要用法
|
 |
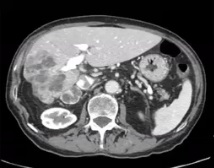 |
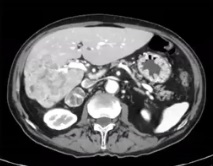
| 治疗前 | 治疗后6月随访 |
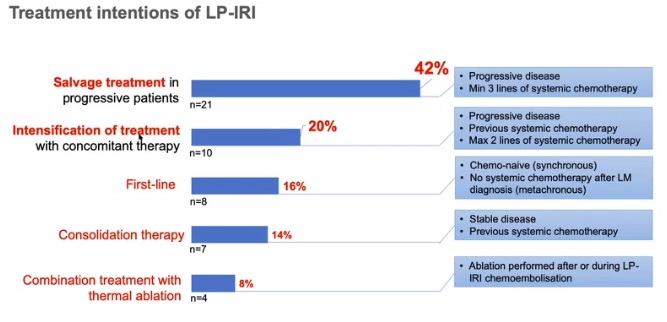
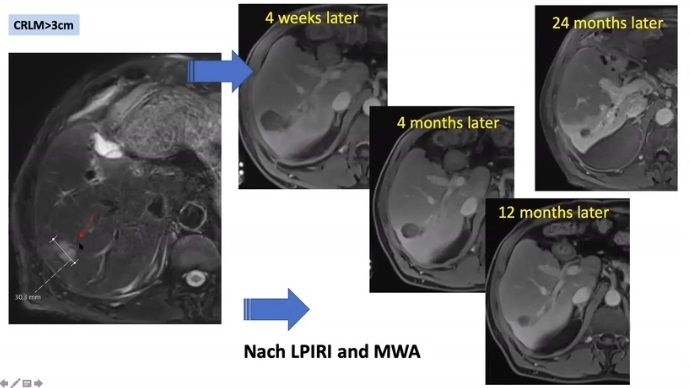
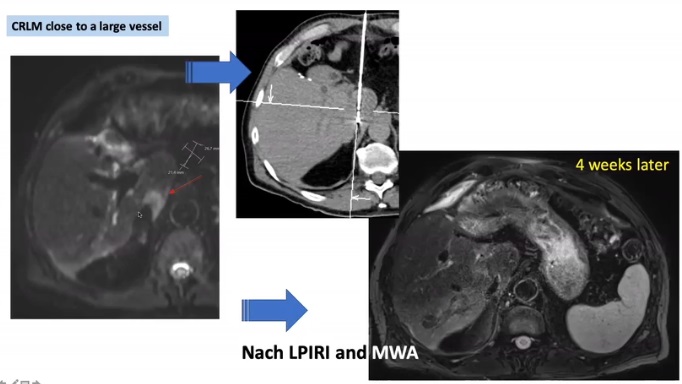
第二次中期分析
· 主要目标
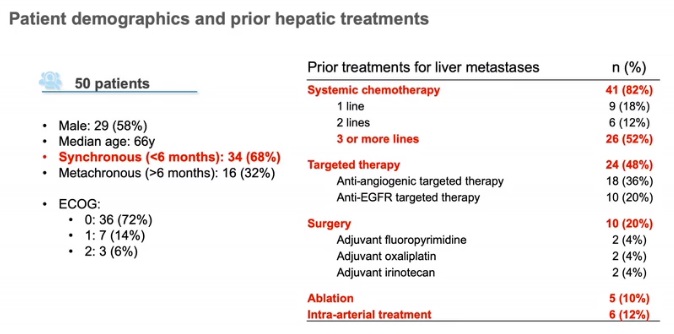
CIREL的主要目的是通过应用预定义的治疗意图分类,前瞻性地捕捉LPIRI在结直肠癌肝转移中的真实应用。
次要目标
次要目标
| 次要目标 | 评价依据 |
| 安全性 | CTCAE 4.03 和 5.0 |
| 生活质量 | EORTIC 评分手册 v 3.0(EORTC QLQ-C30) |
 、、
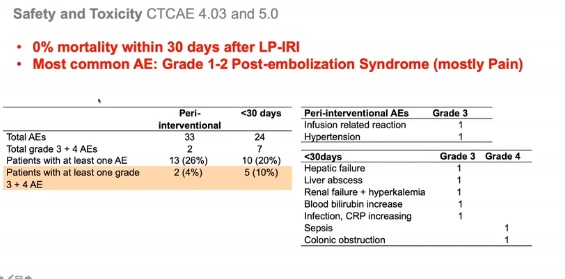
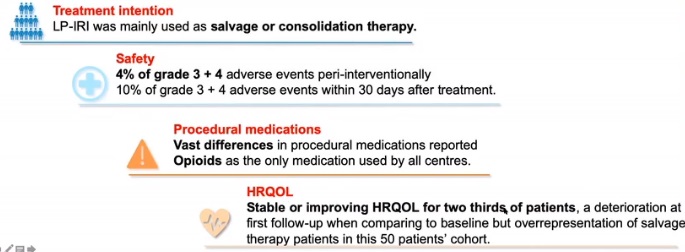
、、安全性和毒性
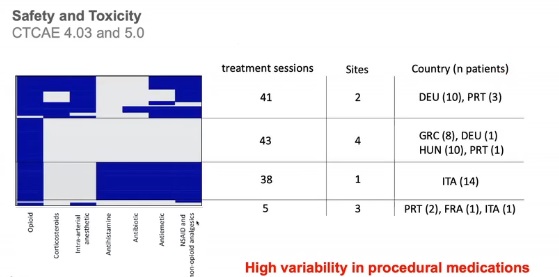
用药高度异质性
生活质量:大部分病人生活质量下降
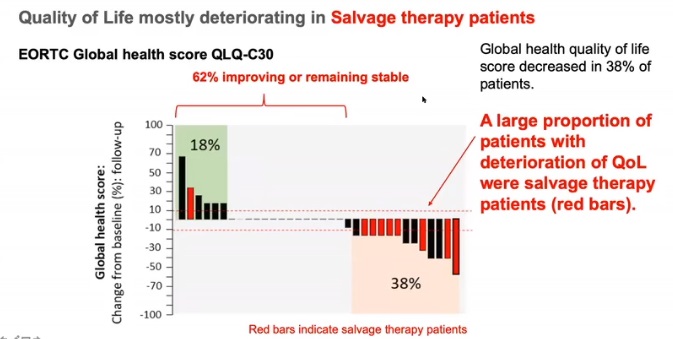
结论
未来
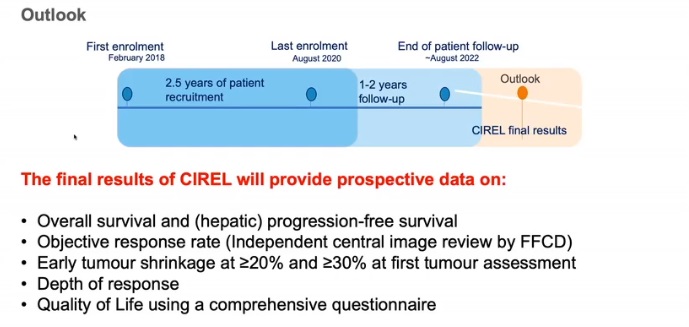
整体生存率和肝无进展生存率的关系,肝内无进展生存率提高,是否意味着整体生存率的增加
客观反应率(由独立的影像中心评价)
初次肿瘤评估,早期肿瘤缩小≥20%和≥30%
反应的深度
应用综合问卷调查生活质量