我们可以从肝癌栓塞的病理中学习到什么?1. 描述和解释不同组织病理学的中期HCC的TACE结果 2. 确定TACE在不同组织病理学方面的潜在优势 3. 目的:为中期HCC患者行TACE的患者选择标准提供建议
肝细胞癌(HCC)影像学诊断的规范化已经取得了很大的进展。肝脏影像学报告和数据系统(LI-RADS)和其他国际指南通过结合使用众所周知的影像学特征,如动脉期高增强(APHE)、快进快出(wash out)和囊状外观 (即常规HCC中通常出现的包膜特征),实现了HCC诊断的高精度【Erkan 2019】。有充分的证据表明,无创诊断HCC是足够的,不需要病理证实。因此,全世界的放射科医生在确定患者是否有资格接受移植和切除以及是否适合替代疗法方面发挥着核心作用。
尽管这种模式的转变提高了放射学的重要性,但它降低了活检的作用,以牺牲其他成像、病理和分子数据为代价,这些数据可能会根据风险对患者进行分层,预后和治疗反应,确定个体化治疗,并加速新药的发现。事实上,尽管HCC的影像学诊断有了很大的进步,但大多数HCC患者的预后仍然很差,特别是那些肿瘤分化差或疾病分期较晚的患者,这些患者不适合局部治疗【Marrero JA 2018】。
HCC是一种具有广泛生物学变异性的原发性肝癌,从具有极低转移潜力的早期HCC到高度侵袭性疾病表型。目前的诊断系统和相关的管理算法提供了 “一刀切” 的建议,没有纳入现有预后数据的全部财富。例如,在美国,活检证实的影像学归类为LR-M的HCC与符合LR-5 (明确HCC) 标准的HCC的治疗方法相同,尽管文献中越来越多的证据【AC C 2015】表明这些肿瘤具有不同的生物学表型和预后,因此可能受益于不同的治疗方法。
为了改善HCC患者的预后,我们必须超越诊断,认识到驱动生物表型的分子、影像学和病理变异性。本文的目的是回顾HCC的病理和分子特征及其相关的影像学特征,并阐明将这些特征整合到放射学-病理-分子表型中的愿景,从而更好地指导个体化治疗。
超越诊断:LI-RADS和预后
LI-RADS是肝脏成像报告和数据系统,为肝癌高风险患者CT和核磁MRI提供了解释和报告指南。
LI-RADS分级主要基于病灶直径及四项肝癌特异性影像学表现:动脉期增强;强化后的静脉期洗脱;边缘强化;病灶增长超过阈值。该分级对于存在肝癌高风险的人群较为适用。
通过LI-RADS分级可以将肝癌划分为5级,
LI-RADS分级划定了肝癌在影像学上的诊断标准,使得诊断更为准确。
LI-RADS算法允许HCC的诊断,阳性预测值接近100%。诊断是基于主要特征的组合,包括大小,非边缘动脉期出现高强化 APHE(Arterial phase hyperenhancement, APHE),非外周快进快出和增强包膜。大于10mm的病变,结合这些特征,可能被归类为LR-5,并几乎完全确定地被诊断为HCC。LI-RADS还定义了LR-M特征(靶样和非靶样),用于诊断缺乏典型HCC特征的病变中的恶性肿瘤。对于不符合LR-5或LR-M标准的不确定结果,辅助特征旨在帮助确定每个患者恶性肿瘤和HCC的相对风险(4)。有关LI-RADS当前特征的更多信息,美国放射学会网站提供了LI-RADS核心、要点和词汇(5)。
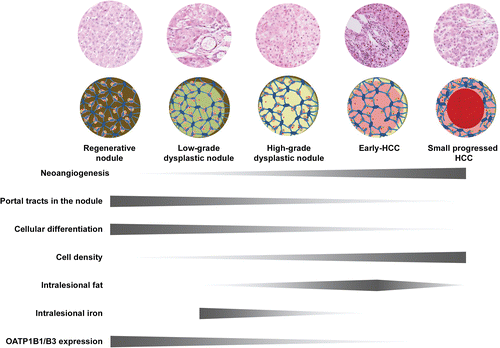
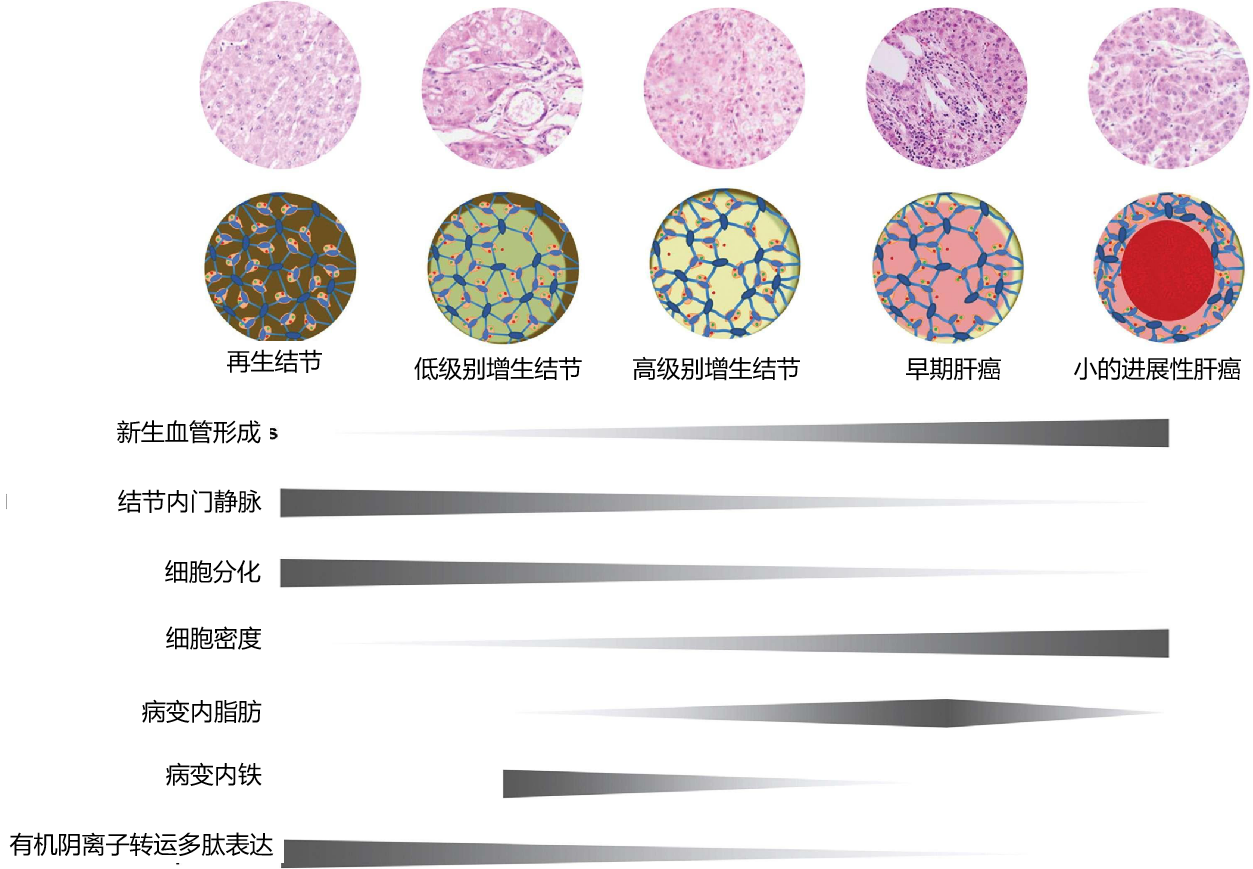
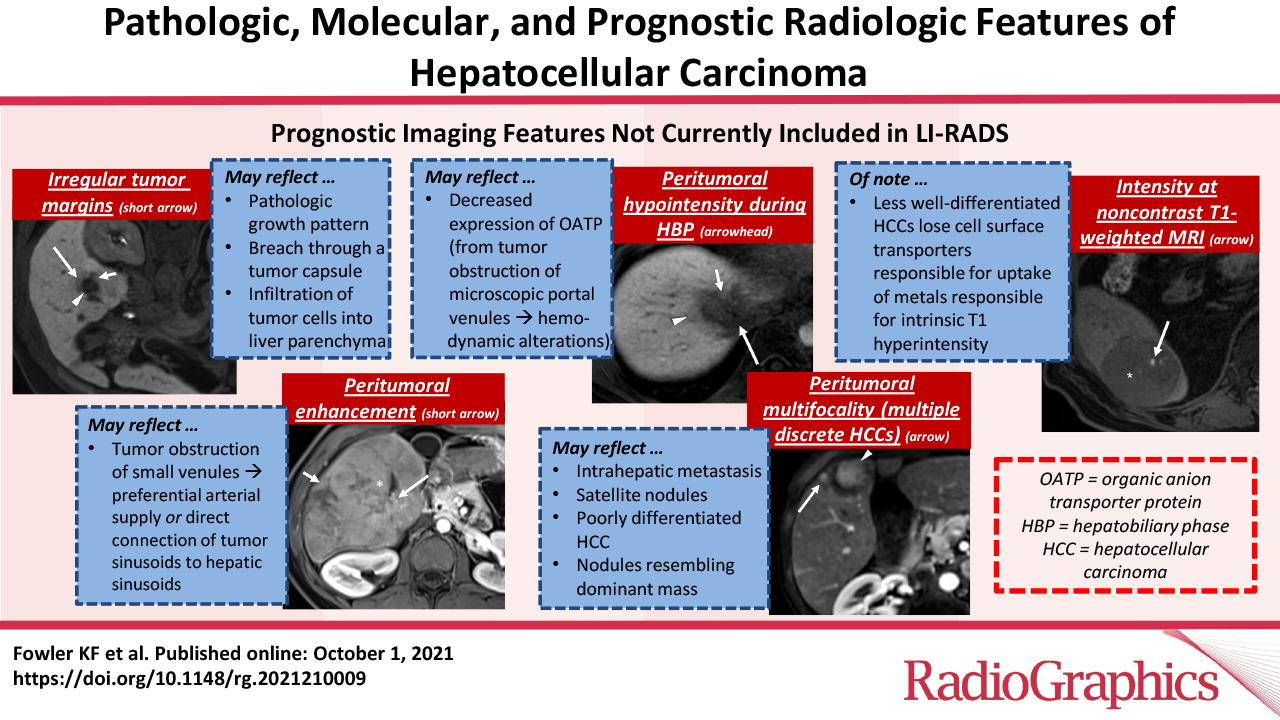
LI-RADS已经生成了用于HCC诊断的标准化术语词典,但该词典尚未包含与预后和风险分层相关的特征(表1)(6-18)。尽管LI-RADS算法不包括这些影像学特征,如肿瘤周围肝胆期(HBP)低密度、肿瘤边缘不光滑等已显示出作为临床结果预测因子的潜力(6-18)。其中一些影像学特征与组织学分级的分化、微血管侵袭(MVI)和与生物侵袭性相关的分子改变(图1)有关(19)。以下章节重点介绍了关于影像特征的新知识,这些特征可以作为肿瘤侵袭性或惰性的生物标志物。在深入研究这些特征与HCC特定生物学表型的关系之前,我们将通过对肝癌发生及其组成部分的简要讨论,重点介绍影像学特征与HCC发展阶段的关系,从预后良好的早期肿瘤到预后较差的晚期肿瘤。
肝癌发生和HCC
肝细胞或胆管细胞是大多数原发性肝癌的起源细胞。不太常见的是,原发性肝癌可能起源于干细胞(即具有成为胆管细胞或肝细胞潜能的全能未分化细胞)。
肝细胞癌在肝硬化中发展的有利途径是通过肝癌发生,这是一个肝细胞变为恶性的过程。这一过程被假设为从肝硬化结节到发育不良结节再到HCC的多步骤进展。
在肝癌发生过程中,分子改变和组织学改变通常具有影像学相关性【Huh J 2015】。有兴趣将概念转向HCC的分子分类,本文后面的部分讨论。请记住,并非所有HCC都遵循典型的肝癌发生,影像学特征并不总是与分子和组织学变化同步发展。
分子变化 Molecular Changes
进行性分子改变作为一系列开关,开启促进细胞增殖和自主生长的途径,关闭修复机制、程序性细胞死亡或检查点调节【Oh BK 2003;Muraoka M 2020】。这些事件可能是由DNA的遗传改变或表观遗传突变引起的,这些突变改变了基因表达的方式,而DNA序列却没有改变。表观遗传改变包括甲基化、组蛋白修饰或非编码RNA的突变,这些突变可以上调或下调基因的表达。
肝癌的发生包括多种多样的突变。一种常见的突变是端粒酶逆转录酶(TERT telomerase reverse tranase)启动子突变,可在癌前低级别和高级别发育不良结节中检测到,并在早期HCC中扩增【Nault JC 2014】。其他突变发生较晚,在肝癌发生过程中更为零星,包括β-连环蛋白突变。这些“驱动”事件促进了不受管制的增长【Torrecilla S 2017】。HCC的复杂可变突变景观是一个正在进行的研究领域,稍后将进行更深入的讨论。
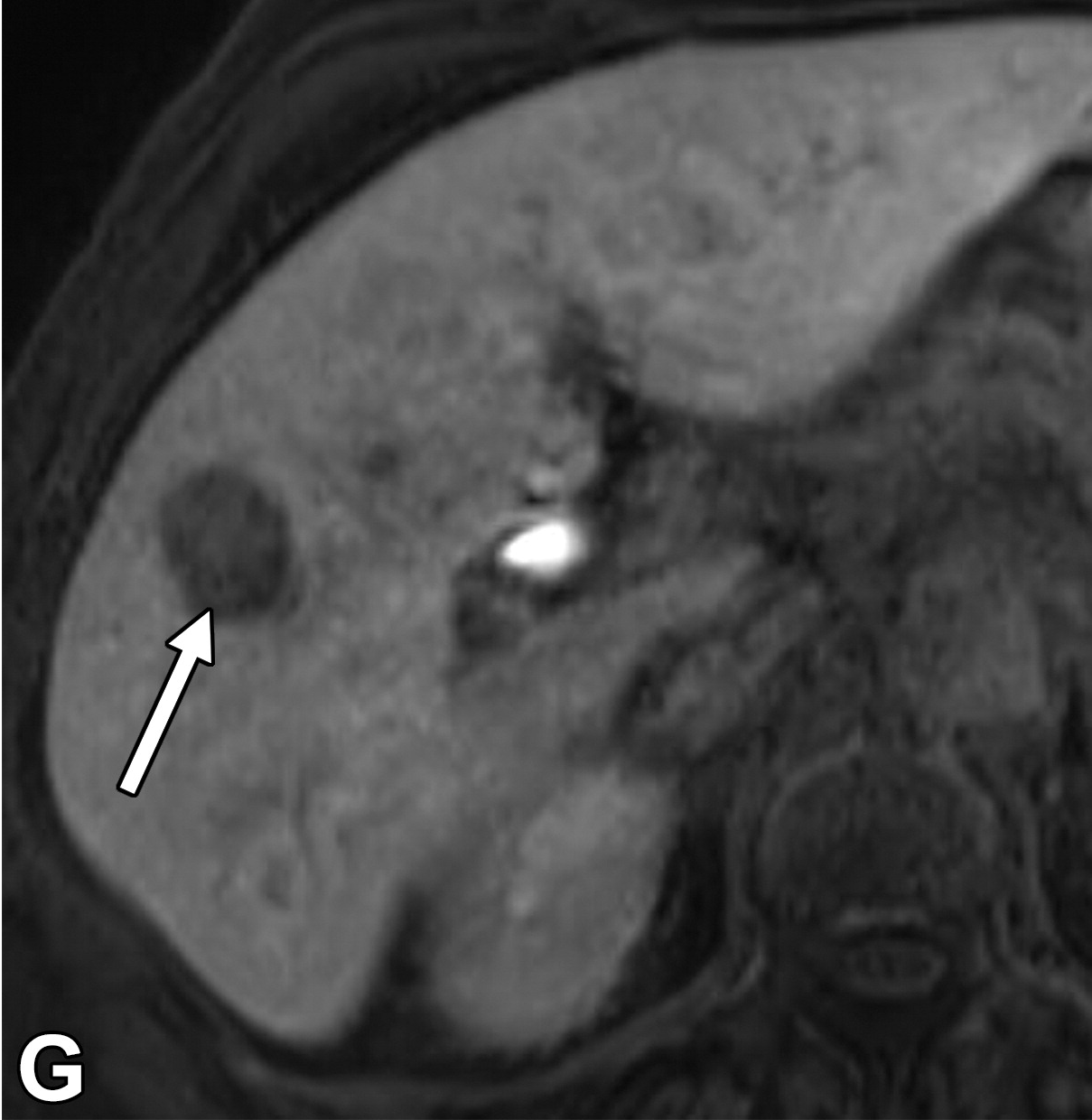
组织学改变和影像关系 Histologic Changes and Imaging Correlates肝癌发生的分子事件驱动组织学变化,可分为新血管生成、细胞密度和分化增加以及细胞转运蛋白功能改变等大类。图2显示了肝癌发生过程中组织病理改变的时间发展和一些相关的影像学表现【Huh J 2015】。例如,新生血管生成导致APHE,门脉三联体可视化不佳或缺失(即“门脉三联体缺失”)导致了后生期的冲洗现象。细胞密度增加导致扩散受限,有机阴离子转运蛋白1B3 (OATP1B3)表达减少导致MRI上HBP低(下图)。在肝癌发生过程中,这些变化表现在肝硬化和发育不良结节中。 67岁酒精性肝硬化患者发生HCC
Hepatocarcinogenesis 肝癌的发生: 肝癌是一个连续发生的统一体 (HCC as a continuum)
肝硬化和发育不良结节
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
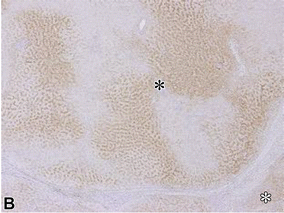 |
| 轴向HBP MR图像显示一个10mm的肿块(箭头),均匀增强,略大于背景肝脏 | 显微照片显示结节(黑色∗)中OATP表达的地图样模式与背景肝脏(白色∗)相似 |
随着持续的损伤和损伤,再生结节发生分子改变,转变为发育不良结节。发育不良结节有时与背景肝不同,在显微镜下显示细胞发育不良。它们通常在成像上也很独特(下图)。发育不良结节分为低级别和高级别结节,后者以细胞异型性和结构改变为特征。
52岁女性丙型肝炎肝硬化低级别发育不良结节
 |
 |
 |
| 动脉期(A)和门静脉期(B)磁共振增强图像显示一个18mm肿块(箭头),与肝实质相比呈等强度(A),并显示快进快出(B)。肿块分类为LR-3 (恶性肿瘤的中等概率)。 | 大体病理标本照片显示一个结节(箭头)明显大于其他结节,颜色与背景结节相似。 | |
71岁男性伴有隐源性肝硬化的高级别发育不良结节
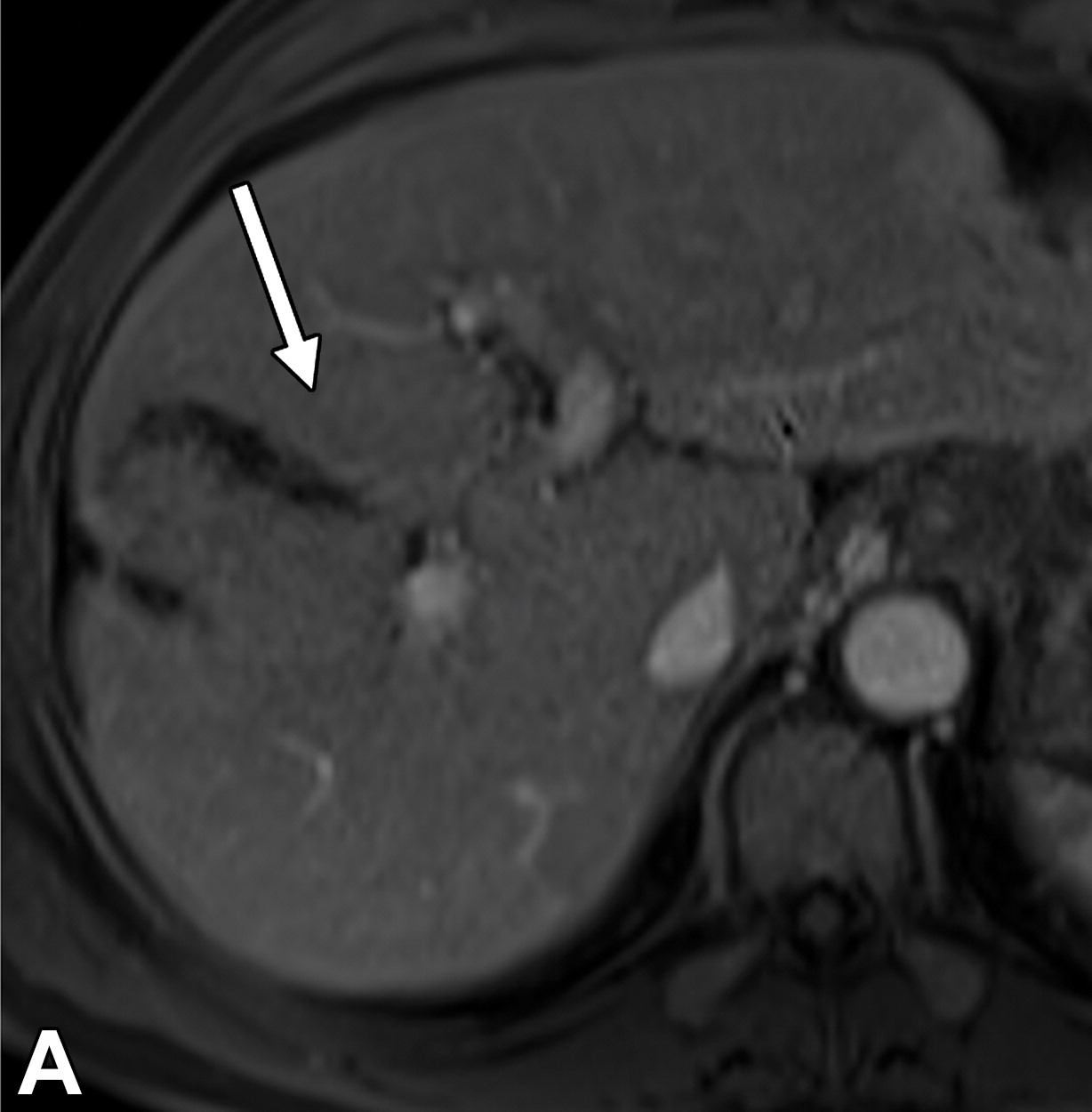 |
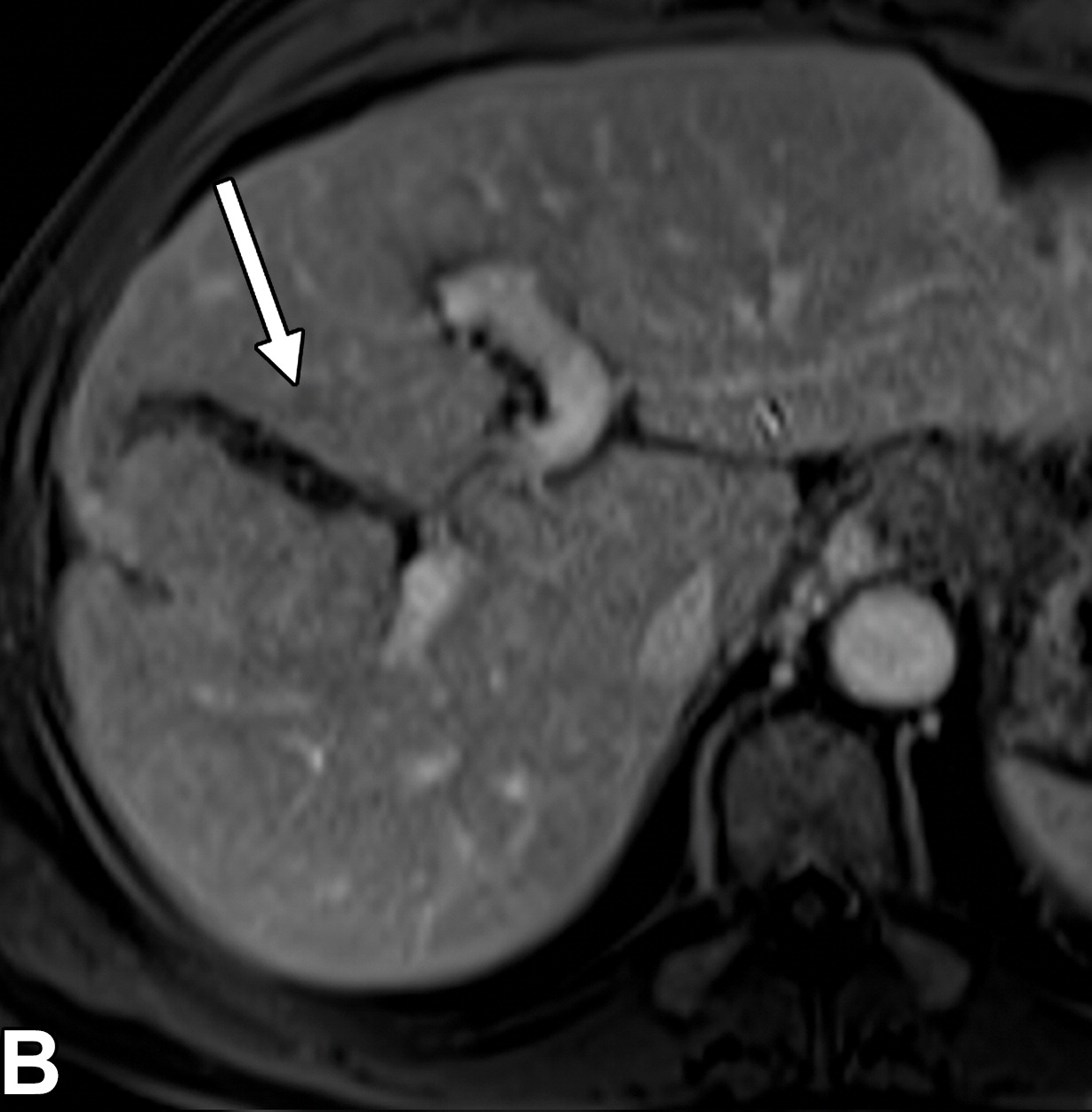 |
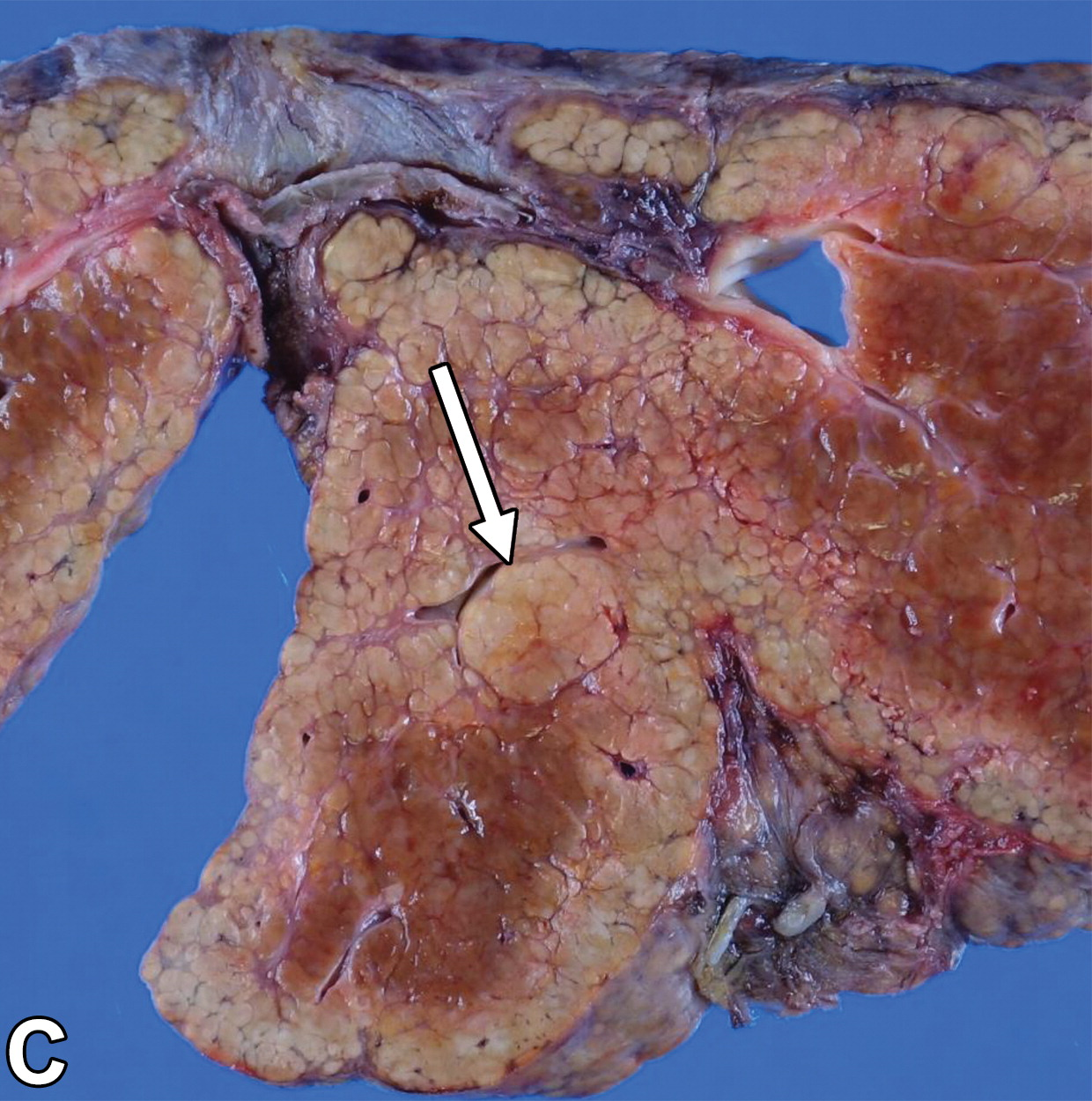 |
| 动脉期(A)和门静脉期(B)磁共振增强图像显示一个9毫米的结节(箭头),在动脉期与背景肝脏相比是等强度的,在门静脉期显示冲洗。结节分类为LR-3(中度恶性概率)。 | 大体病理标本照片显示结节(箭头)明显大于背景结节,颜色与背景结节相似 | |
早期肝癌
早期HCC是一种独特的实体,它被定义为一种模糊结节状(边缘不清)的小而分化良好的HCC,预后良好,转移潜力可忽略不计【Torbenson MS 2019】。在组织学检查中区分高级别发育不良结节和早期HCC是具有挑战性的。早期HCC与高级别发育不良结节的区别在于细胞密度增加、门静脉束减少和未配对动脉增加,这些差异可能是微妙的【HCC 国际共识 2009】。最重要的是,早期HCC的诊断是基于间质浸润,这在影像学上是无法识别的,但在病理检查中可以发现【Torbenson MS 2019】。组织学上,间质浸润是肿瘤细胞生长到邻近的纤维间隔和/或门静脉束。
新生血管生成改变了一些高级别发育不良结节和早期hcc的影像学表现。
Teaching Point:
Teaching Point:
背景肝和再生结节主要由门静脉供血(约占总血供的75%),少量由肝动脉供血。在新生血管形成过程中,促进毛细血管网形成的因子如血管内皮生长因子表达上调【Moon WS 2003】。
高级别异型增生结节和早期HCC的动脉血流和灌注往往低于肝实质【Sano K 2011;Bartolozzi C 2013】,原因是新生血管生成不成熟,正常肝动脉供应减少,而这与门静脉三联征的可见性降低相关(下图)。
55 男 丙肝 早期肝癌
随着新生血管形成更多的不配对动脉、门静脉三联征进一步丧失和窦状毛细血管化的发展,少部分高度异型增生结节和早期hcc可能出现APHE和廓清。同样,随着细胞异型性和转运蛋白表达下降的进展,早期HCC可能出现辅助影像学特征( 如肿块内脂肪、扩散受限或HBP低信号)。
进展性肝细胞癌
高级别异型增生结节和早期HCC的动脉血流和灌注往往低于肝实质【Sano K 2011;Bartolozzi C 2013】,原因是新生血管生成不成熟,正常肝动脉供应减少,而这与门静脉三联征的可见性降低相关(下图)。
55 男 丙肝 早期肝癌
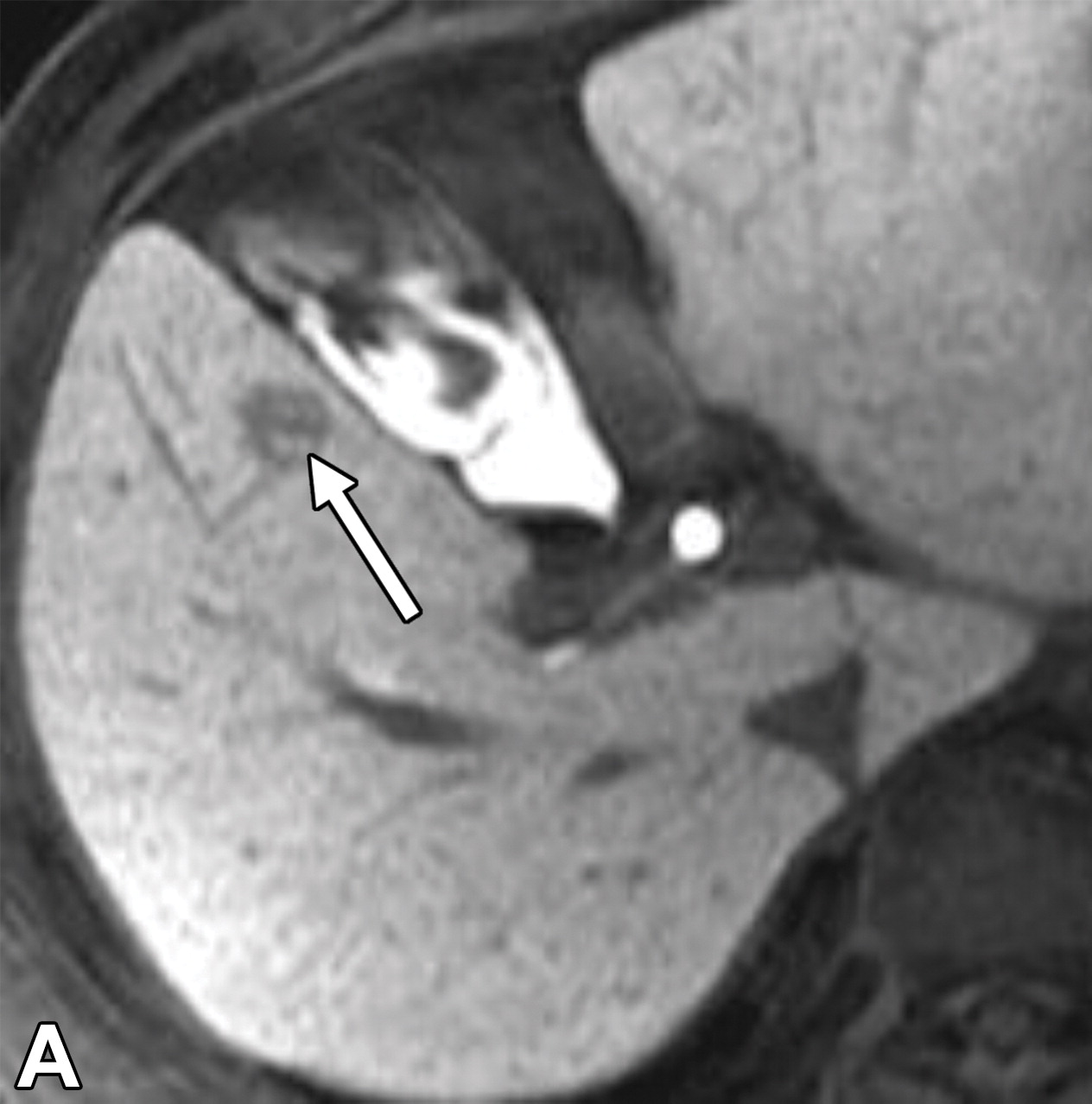 |
 |
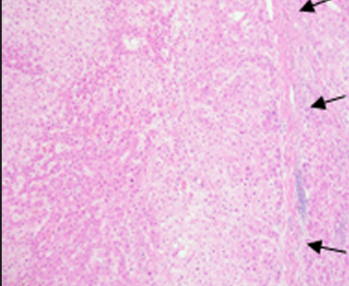 |
| (A) HBP MR图像显示一个12毫米的结节(箭头),与背景肝脏相比呈低信号。 | (B)病理标本的显微照片显示分化良好的HCC。浸润到门静脉间质。门静脉通畅。黑色箭头表示分化良好的细胞侵袭间质的小巢。该结节被归类为LR-3(恶性可能性中等) | |
随着新生血管形成更多的不配对动脉、门静脉三联征进一步丧失和窦状毛细血管化的发展,少部分高度异型增生结节和早期hcc可能出现APHE和廓清。同样,随着细胞异型性和转运蛋白表达下降的进展,早期HCC可能出现辅助影像学特征( 如肿块内脂肪、扩散受限或HBP低信号)。
正常肝细胞表达OATP1B3(有机阴离子蛋白1B3),这是一种负责将胆盐摄取入肝细胞的转运蛋白。OATP1B3还在钆塞酸二钠(拜耳制药, 一种肝胆MRI对比剂)的摄取中发挥作用。在大多数肿瘤中,OATP1B3表达在肝癌发生过程中下调【Kitao A 2020】,在高级别不典型增生结节和早期HCC中伴随HBP信号强度降低,并进一步减少摄取,导致从中分化到低分化HCC的进展(下图)。
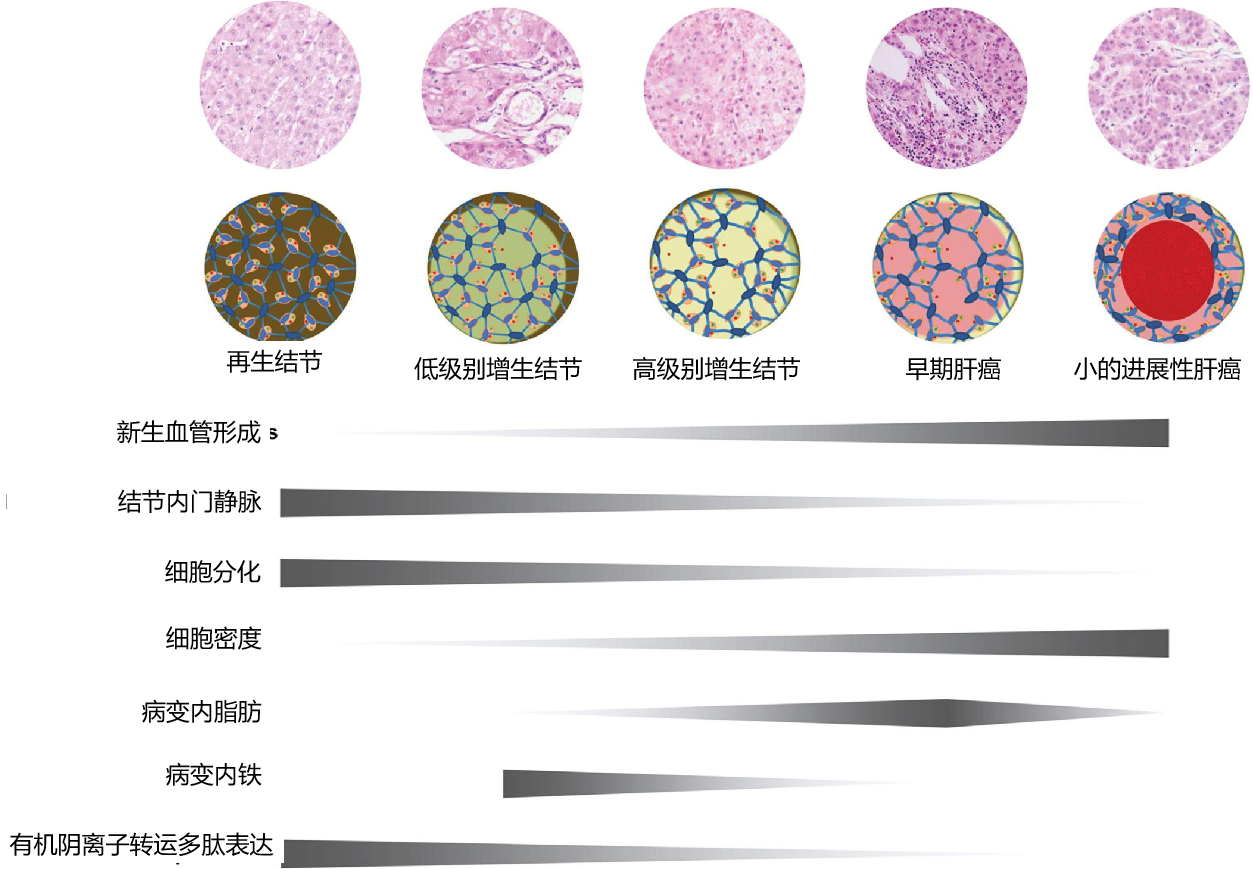
据推测,OATP1B3减少发生在多步骤肝癌发生的早期,而不是在新血管生成的早期。因此,高级别异型增生结节和早期HCC在发生APHE前可表现为HBP(肝胆期)低信号,影像学表现为HBP低信号结节而无APHE。因此,没有APHE的HBP低信号结节被认为是HCC进展期的前体,因为它们在病理学检查中经常被确定为高度不典型增生结节或早期HCC。

据推测,OATP1B3减少发生在多步骤肝癌发生的早期,而不是在新血管生成的早期。因此,高级别异型增生结节和早期HCC在发生APHE前可表现为HBP(肝胆期)低信号,影像学表现为HBP低信号结节而无APHE。因此,没有APHE的HBP低信号结节被认为是HCC进展期的前体,因为它们在病理学检查中经常被确定为高度不典型增生结节或早期HCC。
正常肝细胞也表达负责铁摄取的转铁蛋白转运蛋白。在再生结节和发育不良结节中,这些转运蛋白可能上调,导致影像学上的铁性结节。随着癌变的进展,转运蛋白的表达通常减少,而铁的使用增加,导致病变肝脏的铁相对于背景肝脏减少,这是恶性肿瘤的一个辅助特征。在随访检查中识别铁含量丢失的铁性结节是很重要的,因为这可能表明其转化为HCC【Huh J 2015】。
与正常肝细胞相似,早期HCC有脂肪堆积的倾向,并且随着结节的大小和分化的进展而减少。
与正常肝细胞相似,早期HCC有脂肪堆积的倾向,并且随着结节的大小和分化的进展而减少。
进展性肝细胞癌
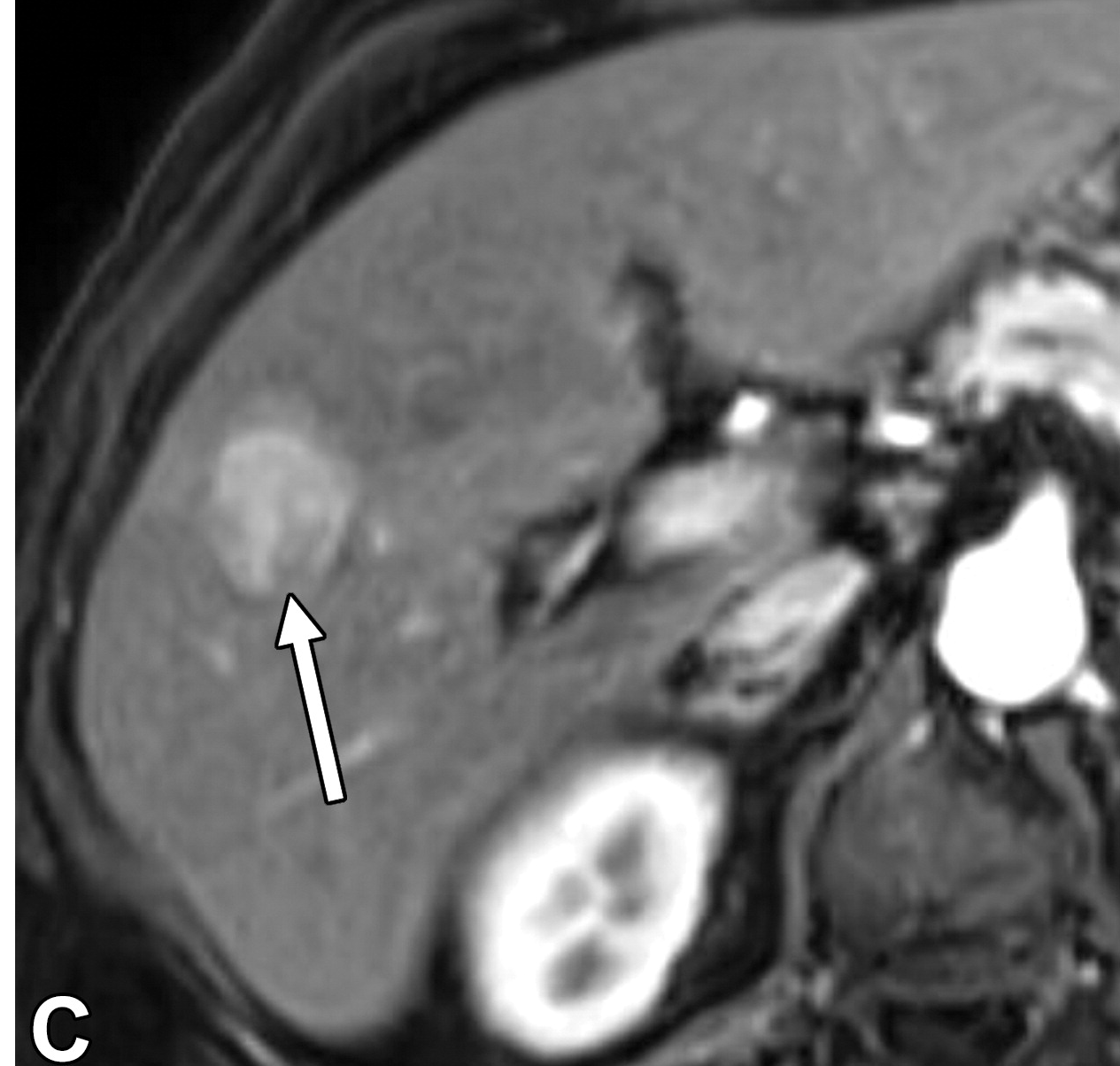
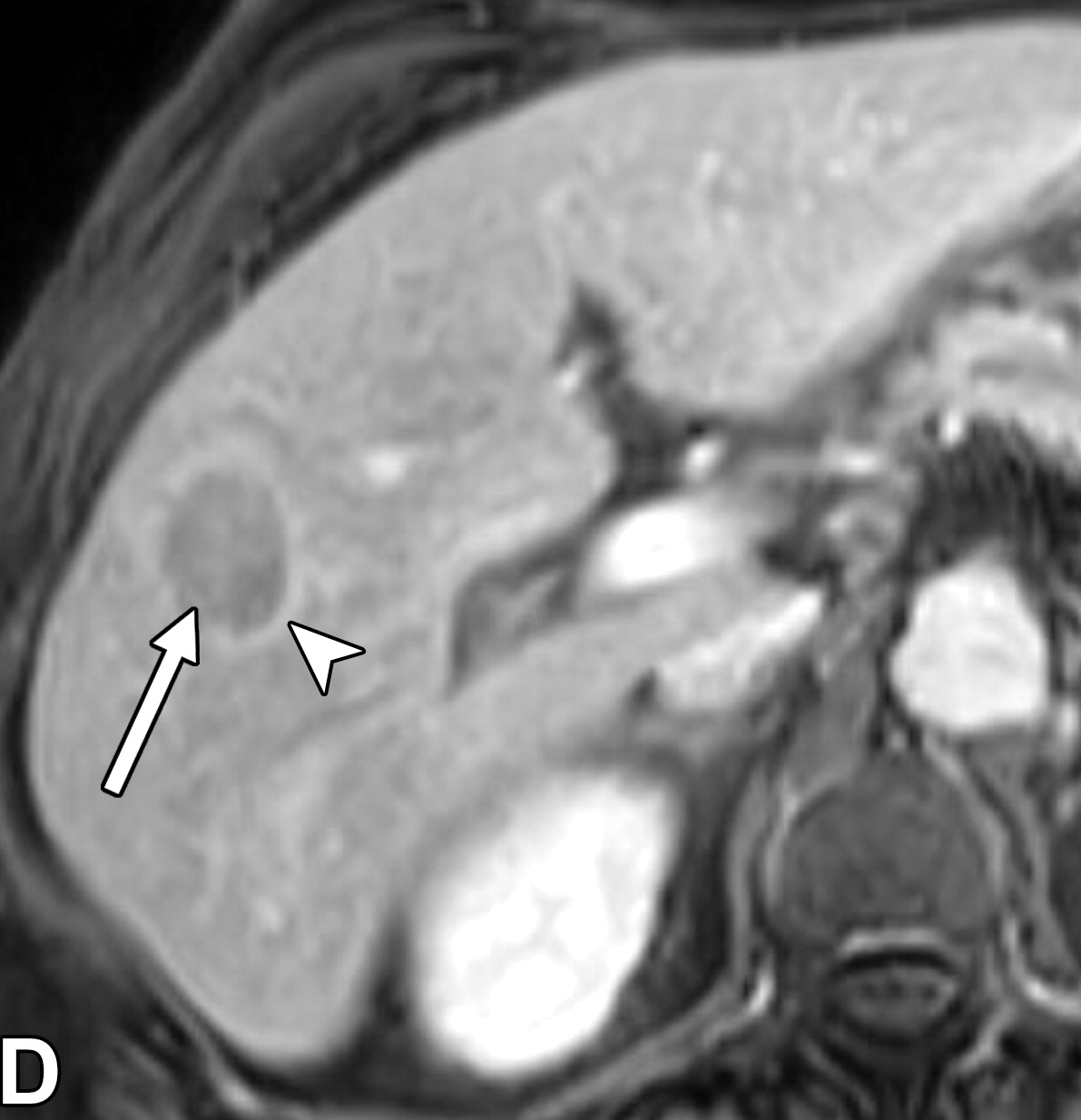
进展期HCC明显呈结节状,明显恶性,能够侵犯血管并转移,并具有HCC的标志性主要特征(图)。
结节中结节的外观是恶性肿瘤的辅助特征,被认为反映了肿块内的克隆分化,可以诊断早期分化良好的HCC,表明从边缘病变进展为明显的HCC。更大、更具侵袭性的HCC可能表现为马赛克状结构、纤维间隔,并可能出现出血或坏死(下图)【Choi BI 1990】。进行性分子改变导致分化程度越来越低的恶性肿瘤、获得血管侵袭性标签、转移,并最终发生肝外扩散。
进展期HCC的影像学特征
 |
 |
 |
 |
 |
 |
 |
 |
结节中结节的外观是恶性肿瘤的辅助特征,被认为反映了肿块内的克隆分化,可以诊断早期分化良好的HCC,表明从边缘病变进展为明显的HCC。更大、更具侵袭性的HCC可能表现为马赛克状结构、纤维间隔,并可能出现出血或坏死(下图)【Choi BI 1990】。进行性分子改变导致分化程度越来越低的恶性肿瘤、获得血管侵袭性标签、转移,并最终发生肝外扩散。
进展期HCC的影像学特征
 |
 |
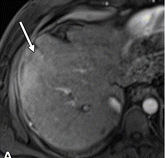
| 轴位MR图像显示结节中结节为一个18mm的结节,内有一个较小的有APHE的内部结节(箭头)和一个较大的无APHE的背景结节(箭头) | 轴位MR图像显示镶嵌外观,一个43毫米的结节,有多个内部室,APHE(箭头)被纤维分隔(箭头)。 |
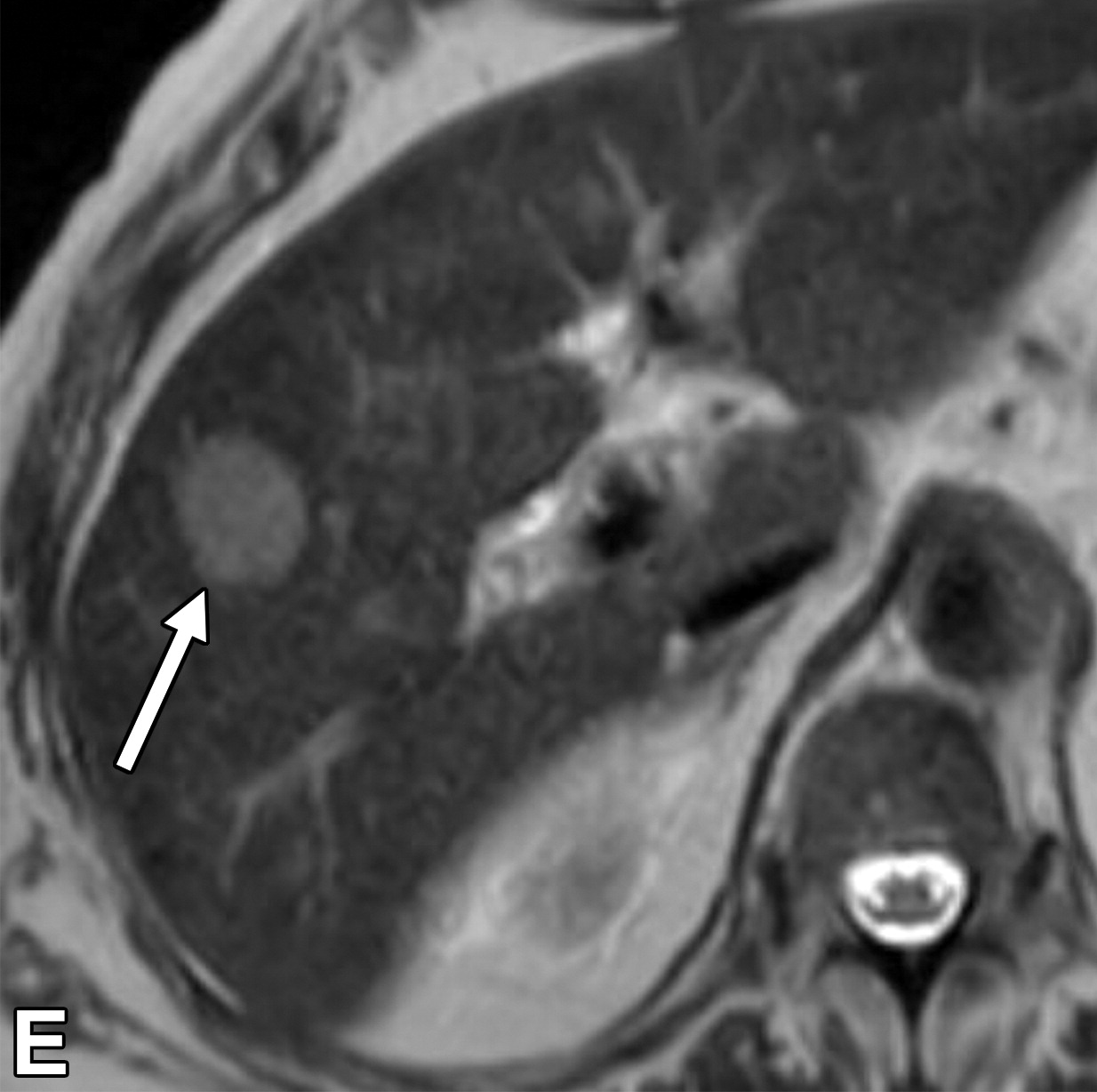
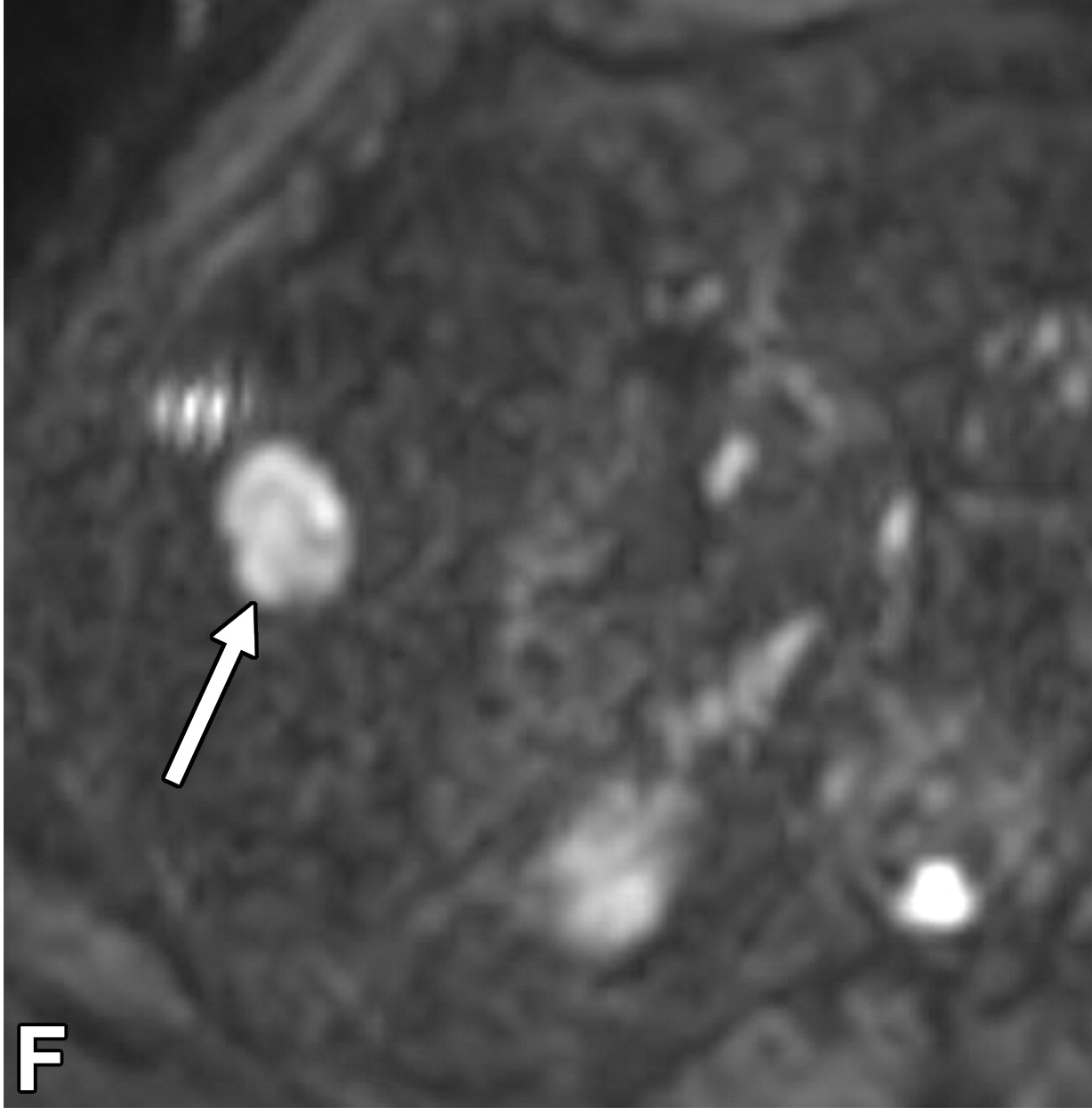
 |
 |
 |
| 轴位平扫CT图像,显示融合性多灶性肿块内边界不清的高密度区域(箭头),这是典型的出血。 | 轴位动脉期 | 门静脉期( |
 |
 |
不是所有的肝癌都一样 Not All HCCs Are Eaual!!!
都是由病理和分子特征驱动的生物变异| 9种 组织病理(亚)型 |
 |
| 按照WHO分类(2019/第五版) |
教学要点:
HCC的组织学分级、生长模式和侵袭性与生物学侵袭性相关,并已被证明与影像学特征相关。由于不同的基因改变,进展期HCC具有广泛的生物学多样性。
HCC的组织学分级、生长模式和侵袭性与生物学侵袭性相关,并已被证明与影像学特征相关。由于不同的基因改变,进展期HCC具有广泛的生物学多样性。
HCC的某些分子改变和特殊的病理亚型与较好的或较差的预后相关。其中一些改变和亚型的影像学特征正在显现。以下部分详细介绍了HCC的生物学变异性和相应的影像学特征。
组织学分级
Histologic Grading
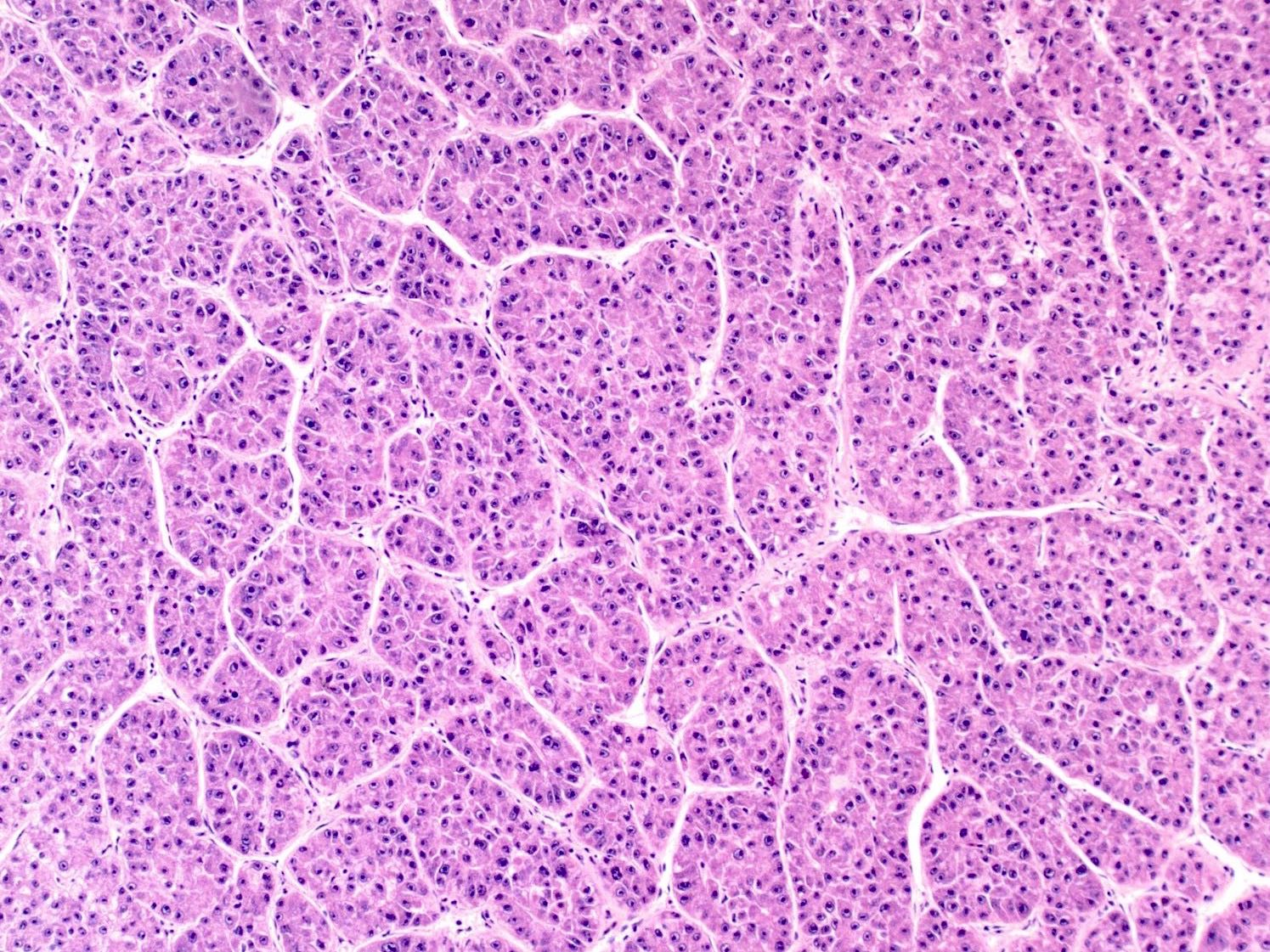
Edmondson-Steiner系统是最常用的组织学分级系统,于1954年首次发表,并被证明是HCC患者生存的预测指标【Zhou L 2008 】。该系统允许根据苏木精-伊红染色的组织学检查对相对于正常成熟肝细胞的分化程度进行分级。世界卫生组织(WHO)分级系统是对Edmondson-Steiner分级系统的四层调整,分级范围从高分化到低分化【Torbenson MS 2019】。前者在组织学检查中类似于成熟的肝细胞,而后者可能远离其肝细胞起源,需要使用免疫组织化学分析来确认【Torbenson MS 2019】。中分化HCC具有明显的恶性,具有中度的核异型性,在形态学上可识别为肝细胞。
肿瘤组织学分级是HCC患者生存的重要预测因素【Han DH 2013;Zhou L 2011】。在影像学诊断方面,在接受活检的患者中,通常无法获得来自HCC组织学分级的预后数据。因此,研究人员的目标是确定与肿瘤分级相关并可能预测肿瘤分级的无创影像学特征。肿瘤较大、廓清、包膜破裂、晕状强化、低表观扩散系数和HBP低信号与肿瘤分级【Yoneda N 2019;Li X 2016;Witjes CD 2012;Zhang L 2020; Iguchi T 2009】相关。这些特征与分化较差的HCC的相关性并不令人惊讶,因为它们是癌变的后期表现。
肝内生长模式
Intrahepatic Growth Patterns
HCC的生长模式从局限的小结节到浸润性恶性肿瘤【Torbenson MS 2019】。以下各段描述了病理学定义的模式,以及目前已知的与它们的影像学相关的情况,尽管这在很大程度上仍然是一个知识缺口。
病理上,较小的肿瘤分化较好,具有明显的结节样外观,而较大的肿瘤表现出不同的生长方式,包括结节伴结节周围生长、融合性多结节生长、大块生长和弥漫性生长。最具侵袭性的是弥漫型,即肿瘤向周围组织扩散。这种模式的HCC也被称为肝硬化型HCC,因为微小的肿瘤结节与肝硬化患者的再生结节的病理外观相似(38)。弥漫性生长模式与不良预后、血管侵犯和肝内转移相关。与直觉相反,这种生长模式的存在并没有直接促进美国癌症联合委员会(American Joint Committee on Cancer, AJCC)分期(39)。
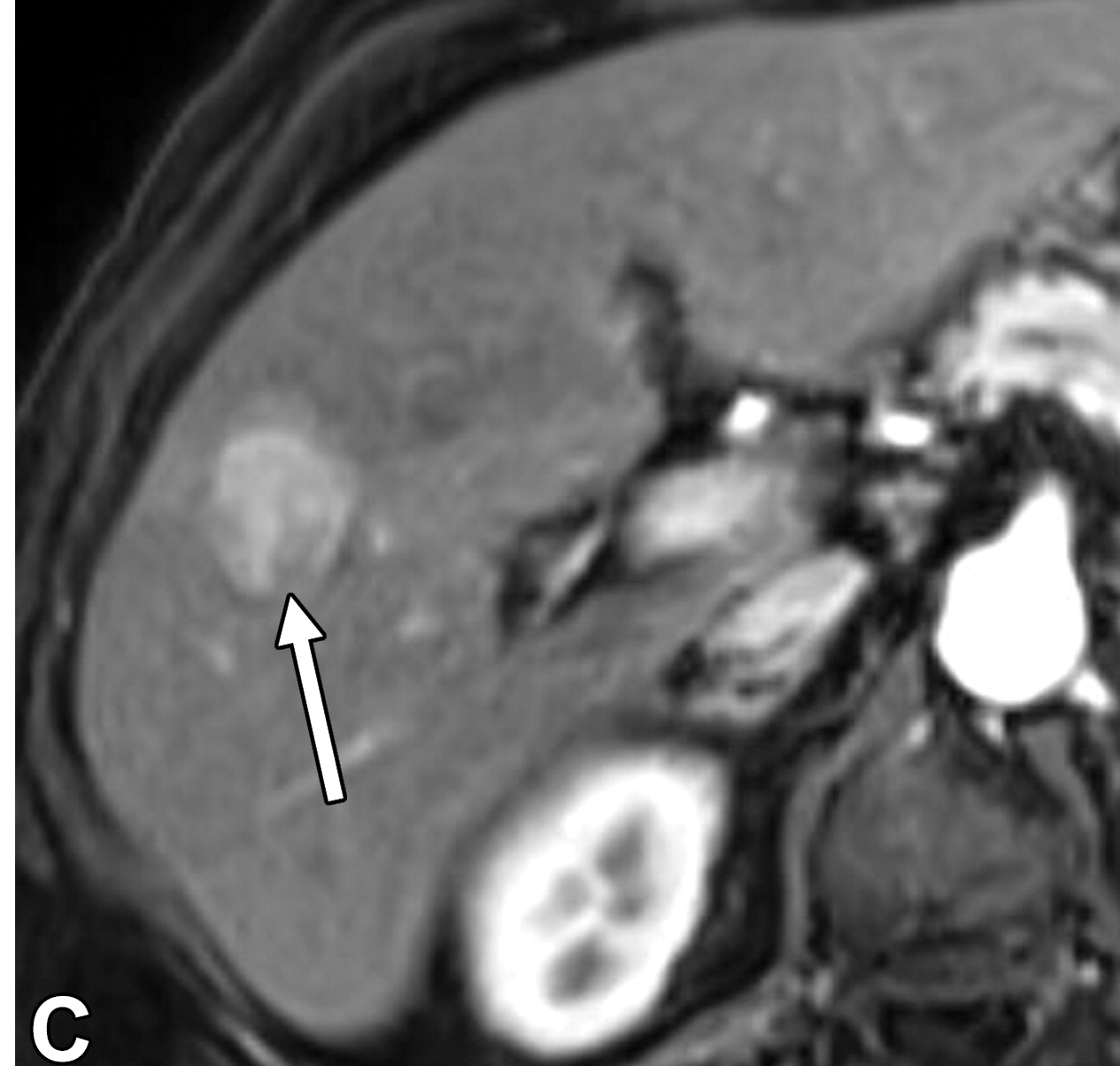
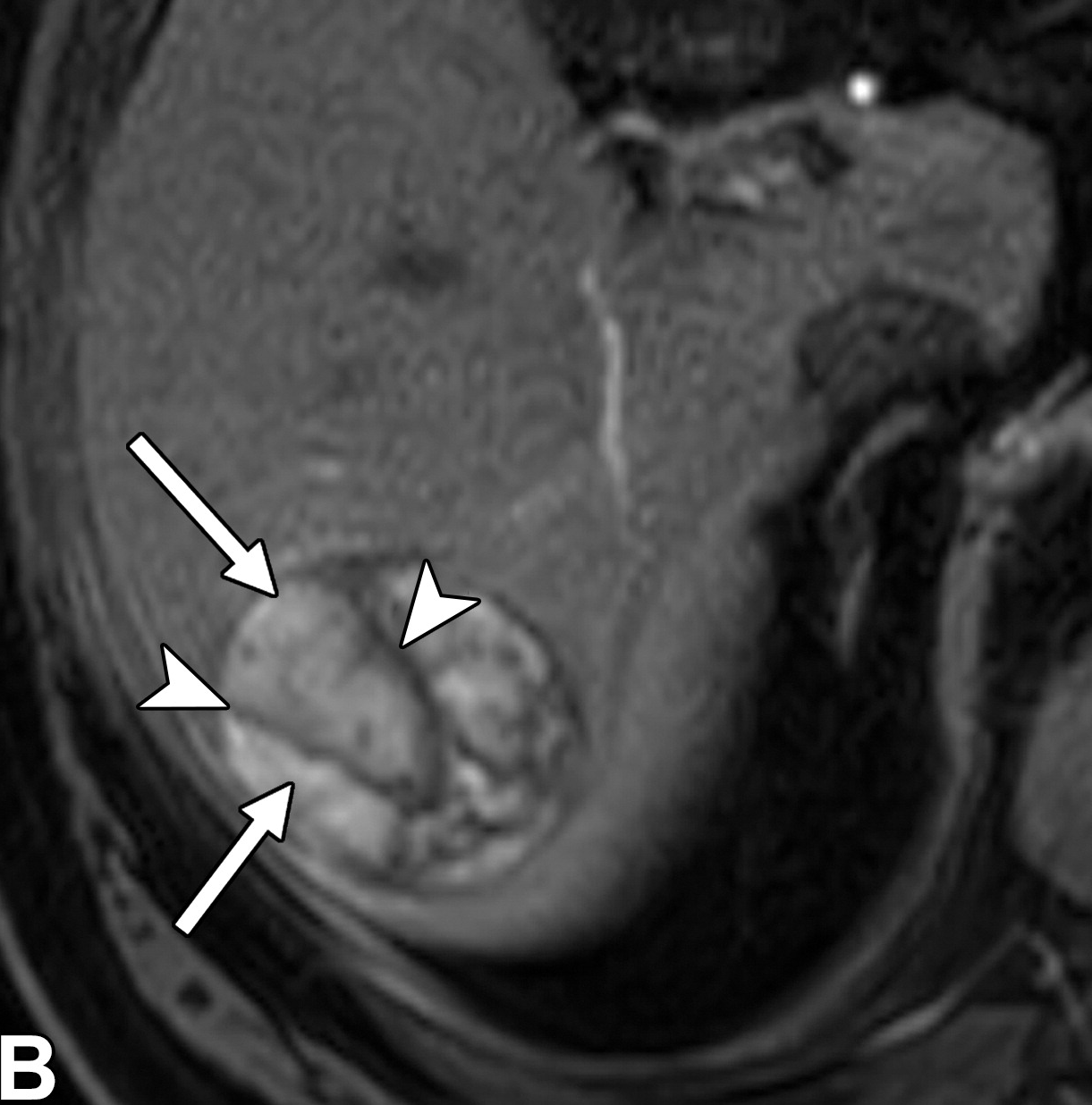
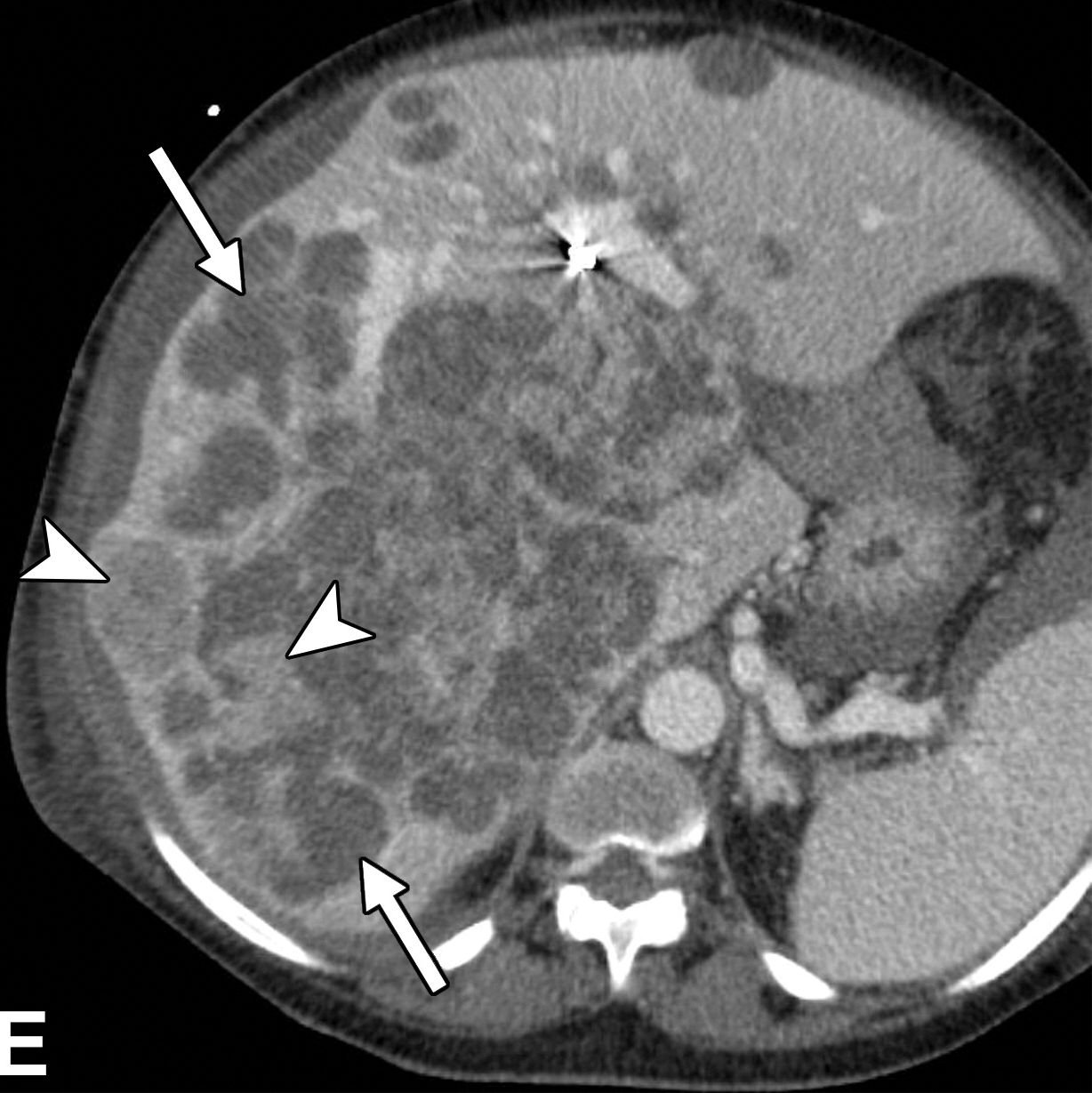
高达三分之一的HCC患者(40例)具有多灶性。多病灶可能是由于多个hcc并行发展(即多中心疾病)或由于主要肿瘤的肝内转移。后者预示着较差的预后,因为每个肿瘤都是明显的恶性肿瘤,能够发生血管侵犯和转移。卫星结节是肝内转移的一种形式(图9,E6),其中转移沉积在母肿瘤附近。卫星结节的发生可能是由于直接通过肿瘤包膜的侵袭或通过血行播散。根据LI-RADS,卫星结节具有与优势结节相似的影像学特征,位于优势结节边缘2 cm以内。
男,53 丙肝 卫星结节
很少有数据比较病理生长方式和影像学表现,生长方式和影像学的相关性也不完全清楚。男,53 丙肝 卫星结节
 |
| 一名患有丙型肝炎肝硬化的53岁男性患者的卫星结节。轴位动脉期MR图像显示一个31毫米的肿瘤(箭头),非环形高增强。与主肿瘤相邻的是一个9毫米的卫星结节(箭头)。 |
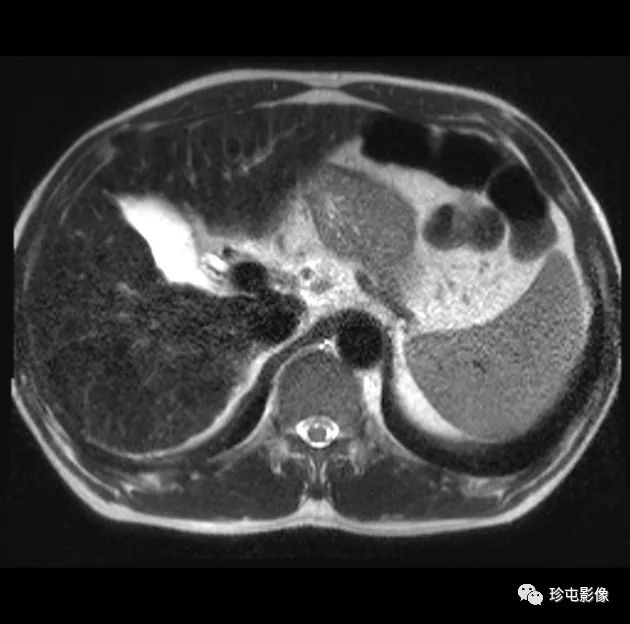
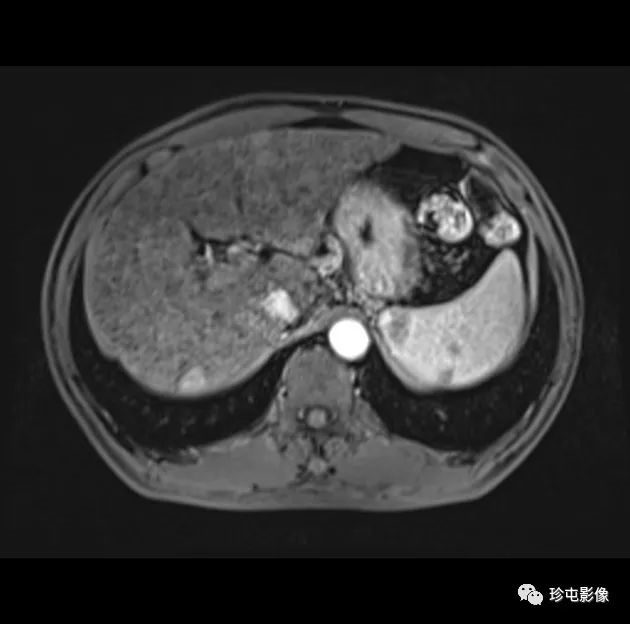
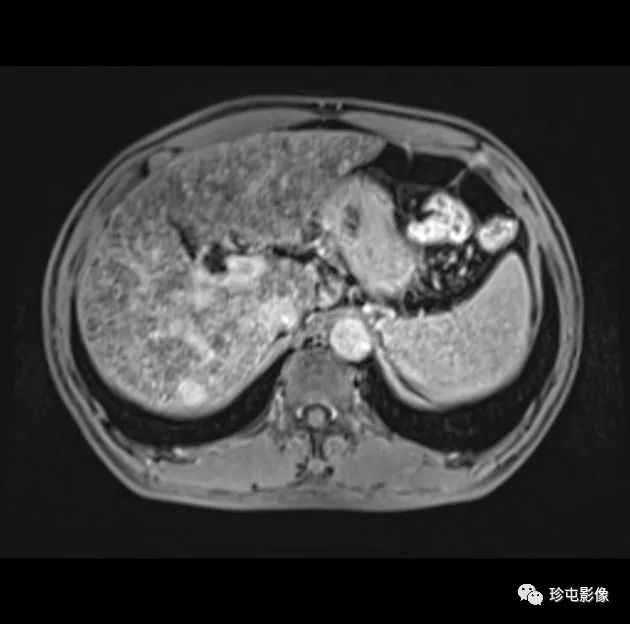
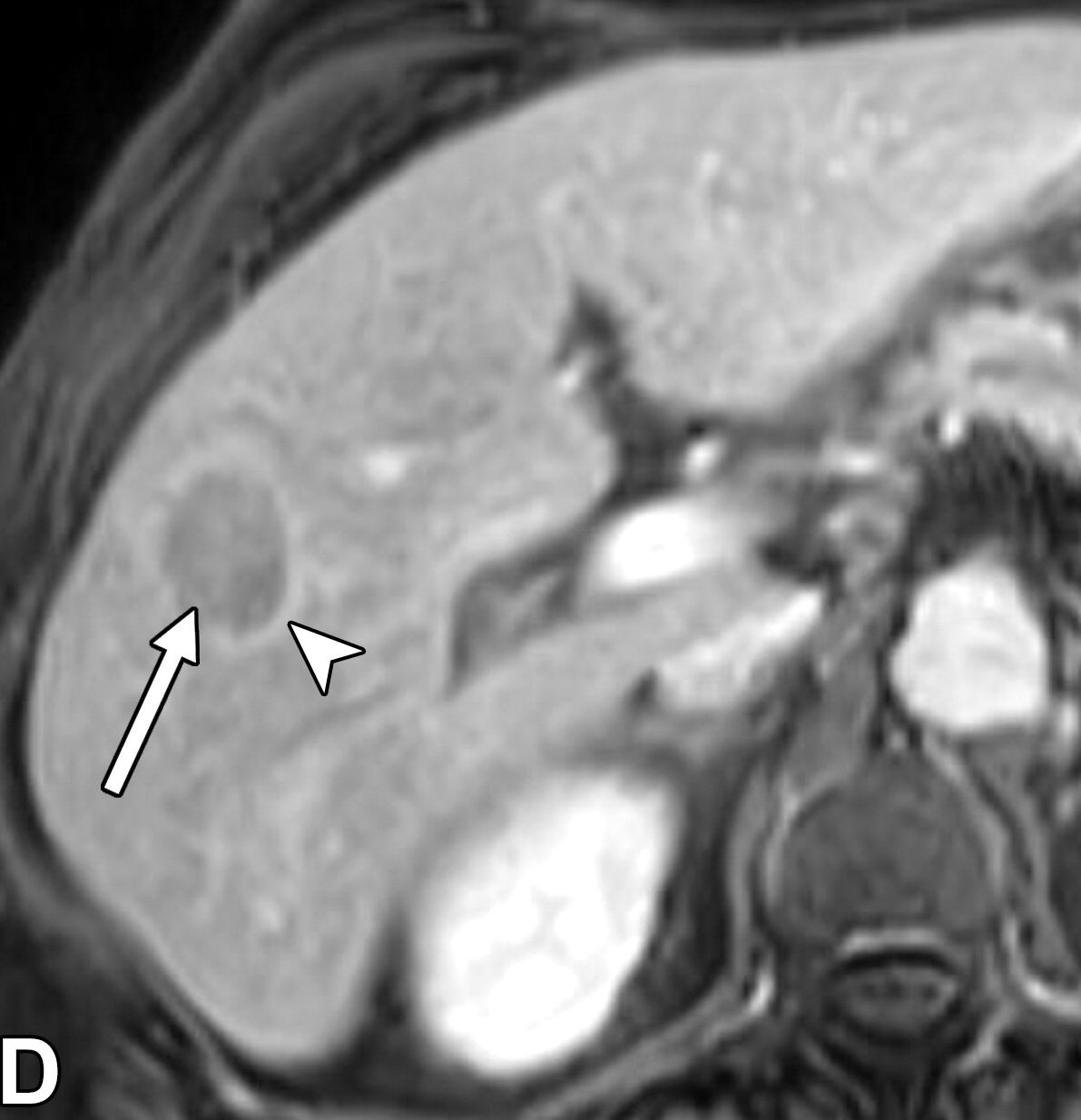
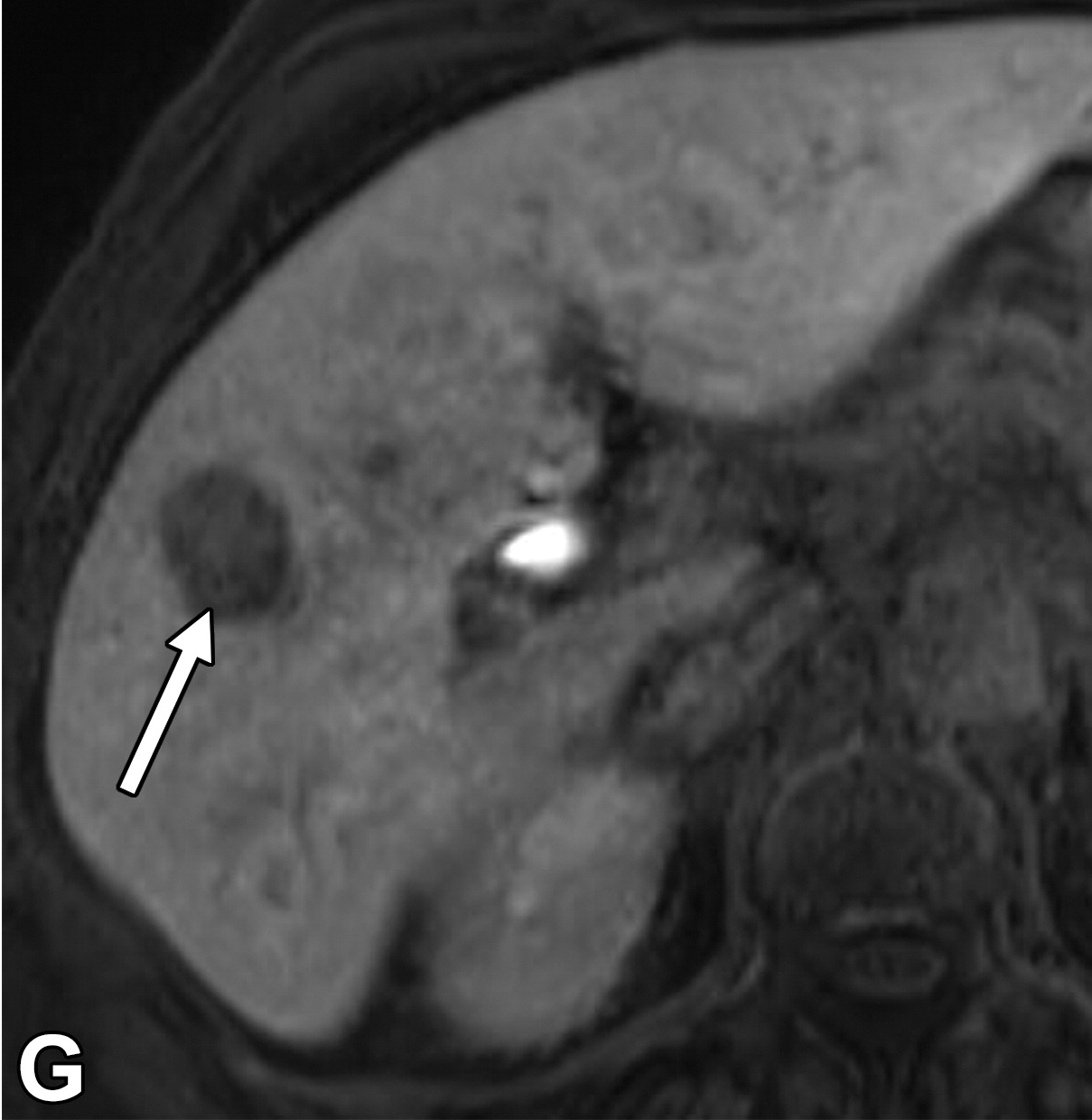
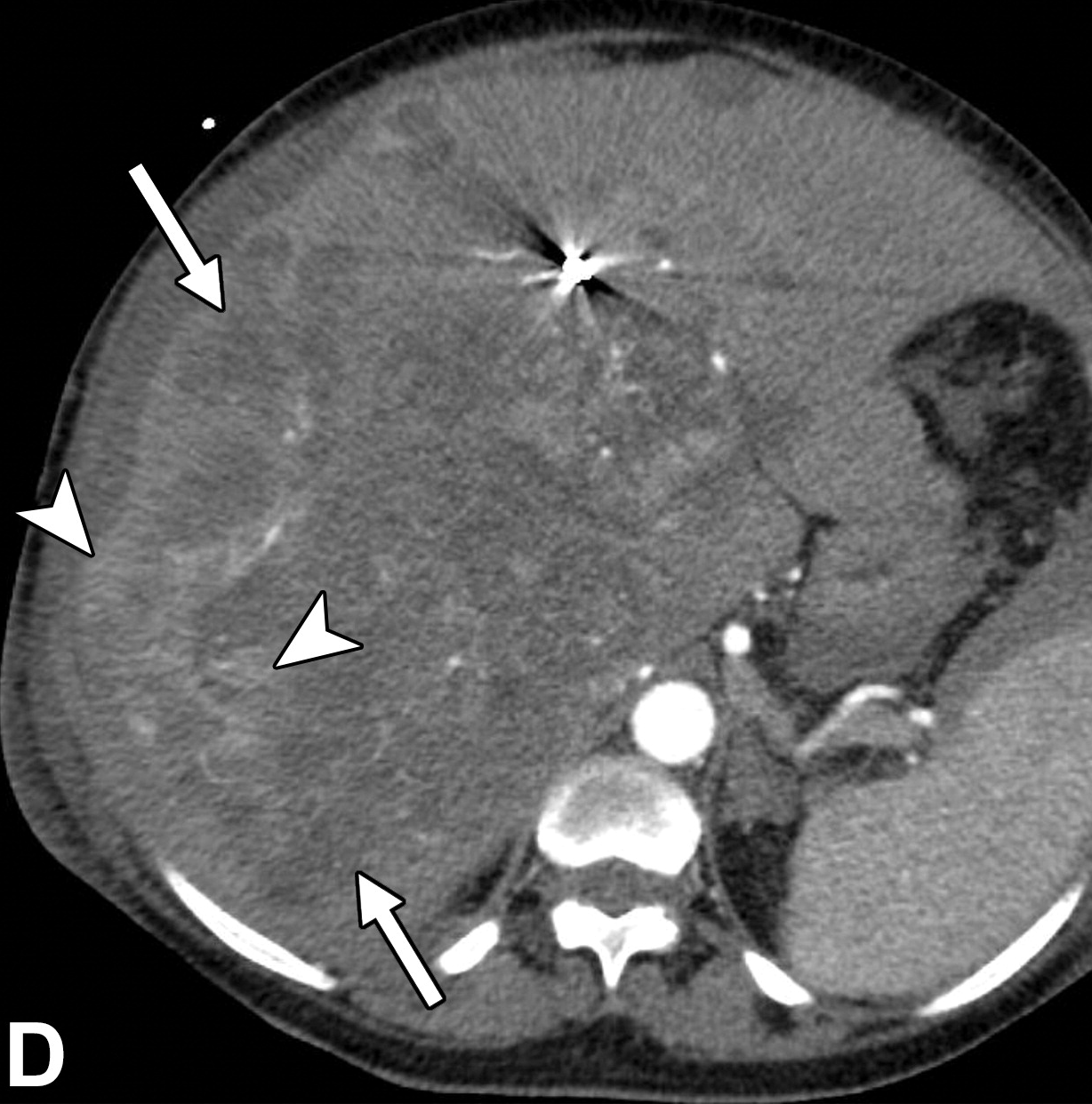
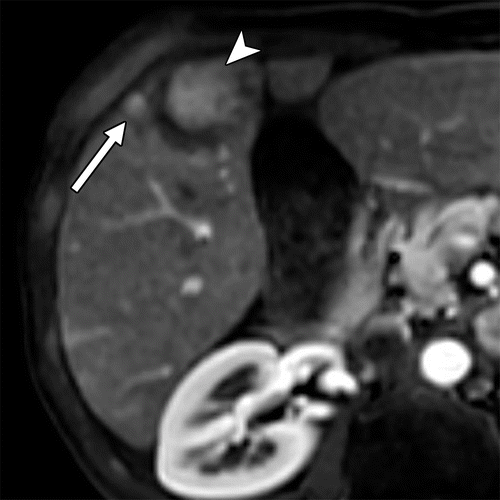
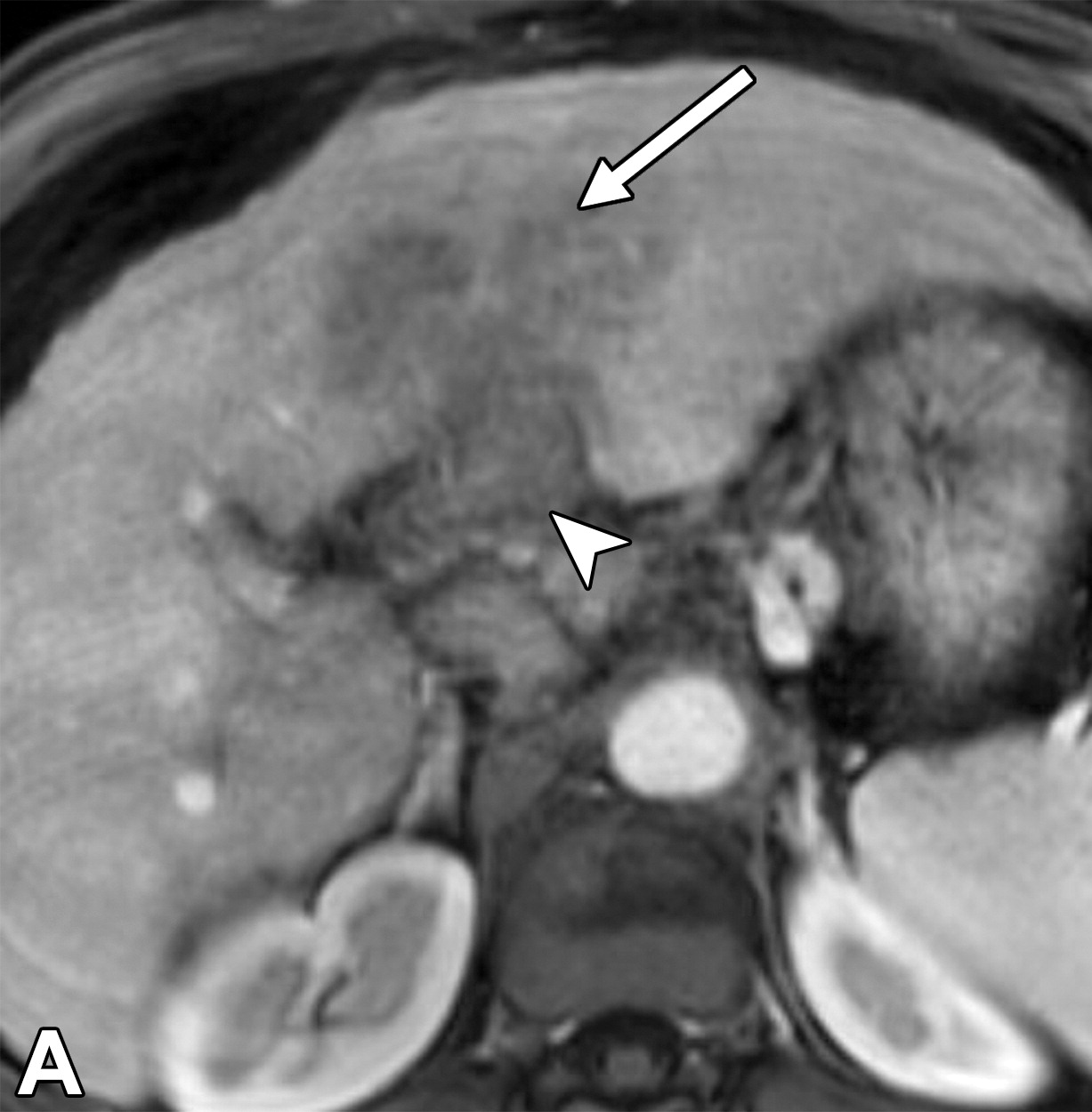
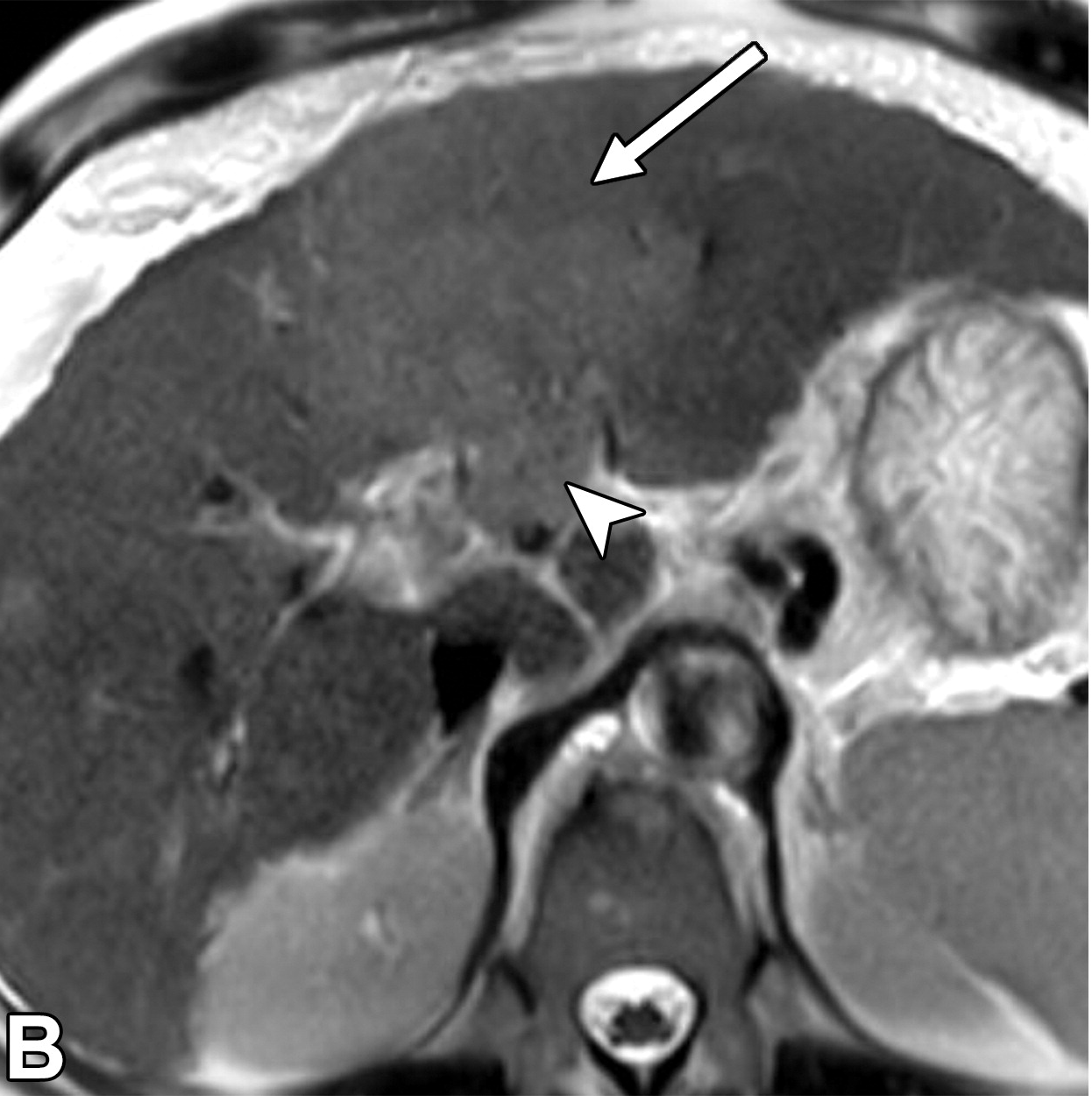
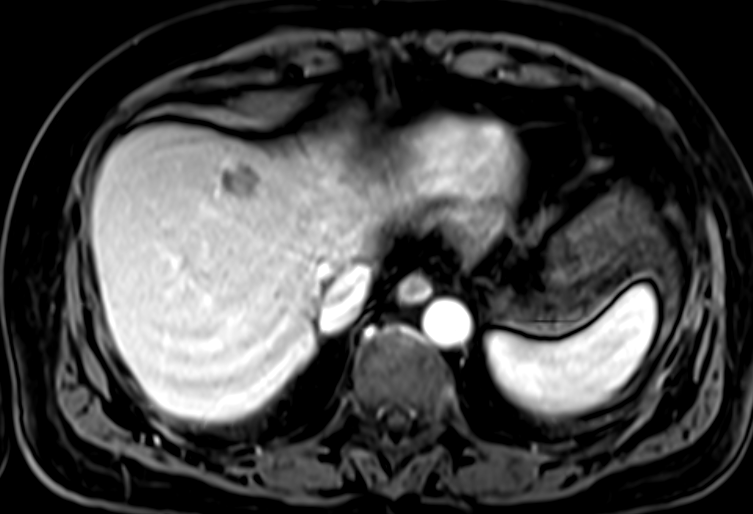
肝细胞癌弥漫性(类似肝硬化)生长在影像学上可能表现为“浸润性肝细胞癌”(下图)。根据LI-RADS,浸润性表现为非靶样LR-M特征,定义为无边界的边界,认为代表恶性肿瘤伴浸润性生长。浸润性HCC可能难以在影像学上从背景肝中区分,并且常伴有静脉内肿瘤、卫星病灶和肝外转移(41)(图10,E7)。
58岁男性丙型肝炎肝硬化患者的浸润性HCC伴大血管侵犯,
 |
 |
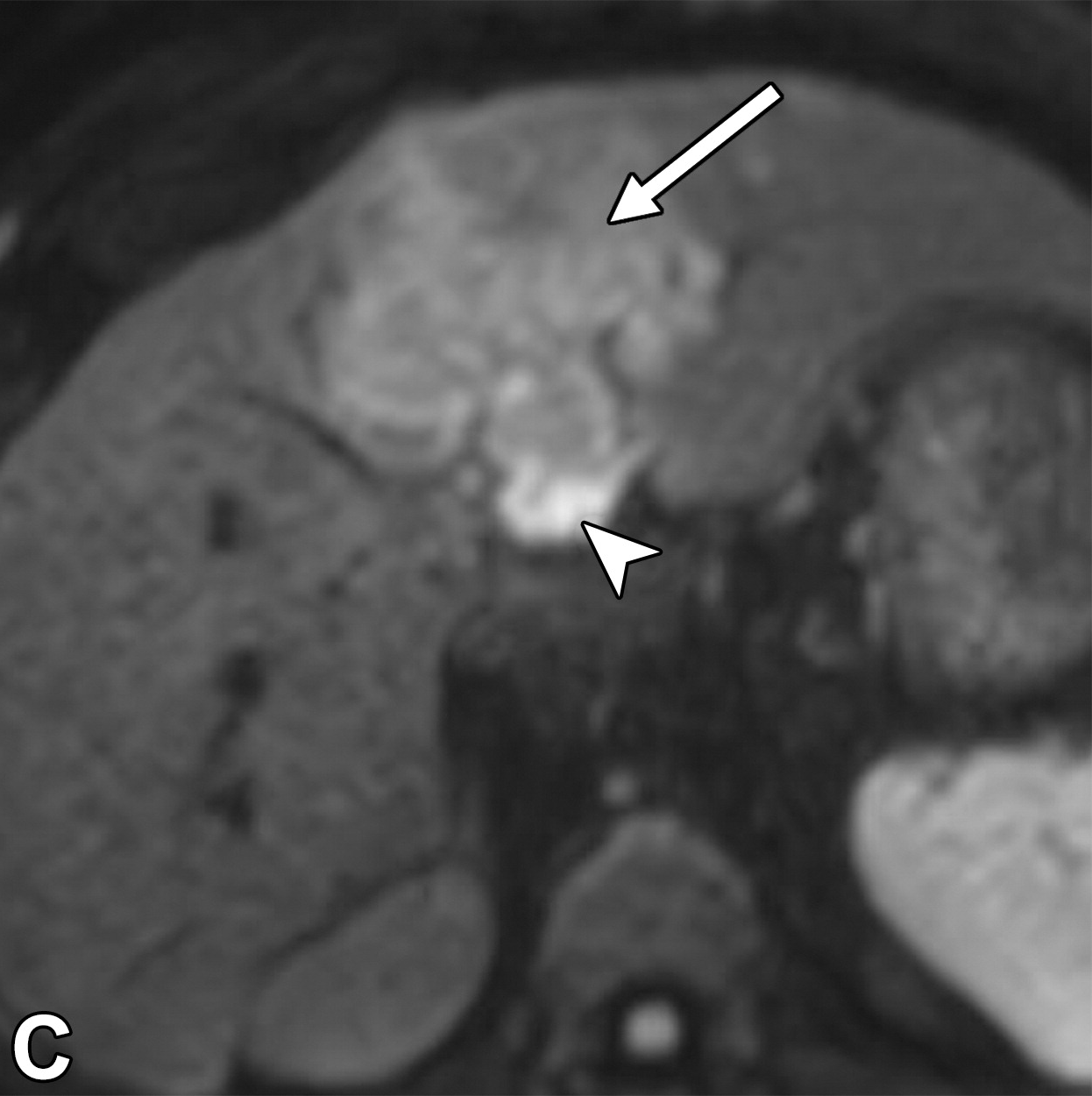 |
| 轴位门静脉期:MR图像显示一个边界不清的实质肿块(箭头) | T2加权 | 扩散加权 |
,T2高信号(A),扩散受限(B)和廓清(C),一个具有类似影像学特征的增强肿块(箭头)延伸至门静脉左侧,代表静脉内的肿瘤。注意,肿块在t2加权(B)和扩散加权(C)图像上最明显。该患者的其他影像学特征见图E7。肿块分类为LR-TIV(明确静脉内肿瘤)。
血管侵犯
血管侵犯是指肿瘤细胞通过纤维间质和内皮细胞浸润到血管腔内。这发生在显微镜下,伴有小门静脉或血窦的侵犯。由于肝小静脉在肝癌发生的早期就被破坏,因此肝小静脉的侵犯较少发生。一些生长方式,如弥漫性生长方式,在概念上与血管侵犯相关。血管侵犯是一个多步骤过程,可能是HCC患者生存期较差的最重要驱动因素,其遗传和分子驱动因素尚未完全明确。一些研究表明,遗传改变和肿瘤微环境因素(如免疫细胞浸润)促进了血管浸润表型的发展【Krishnan MS 2021】。
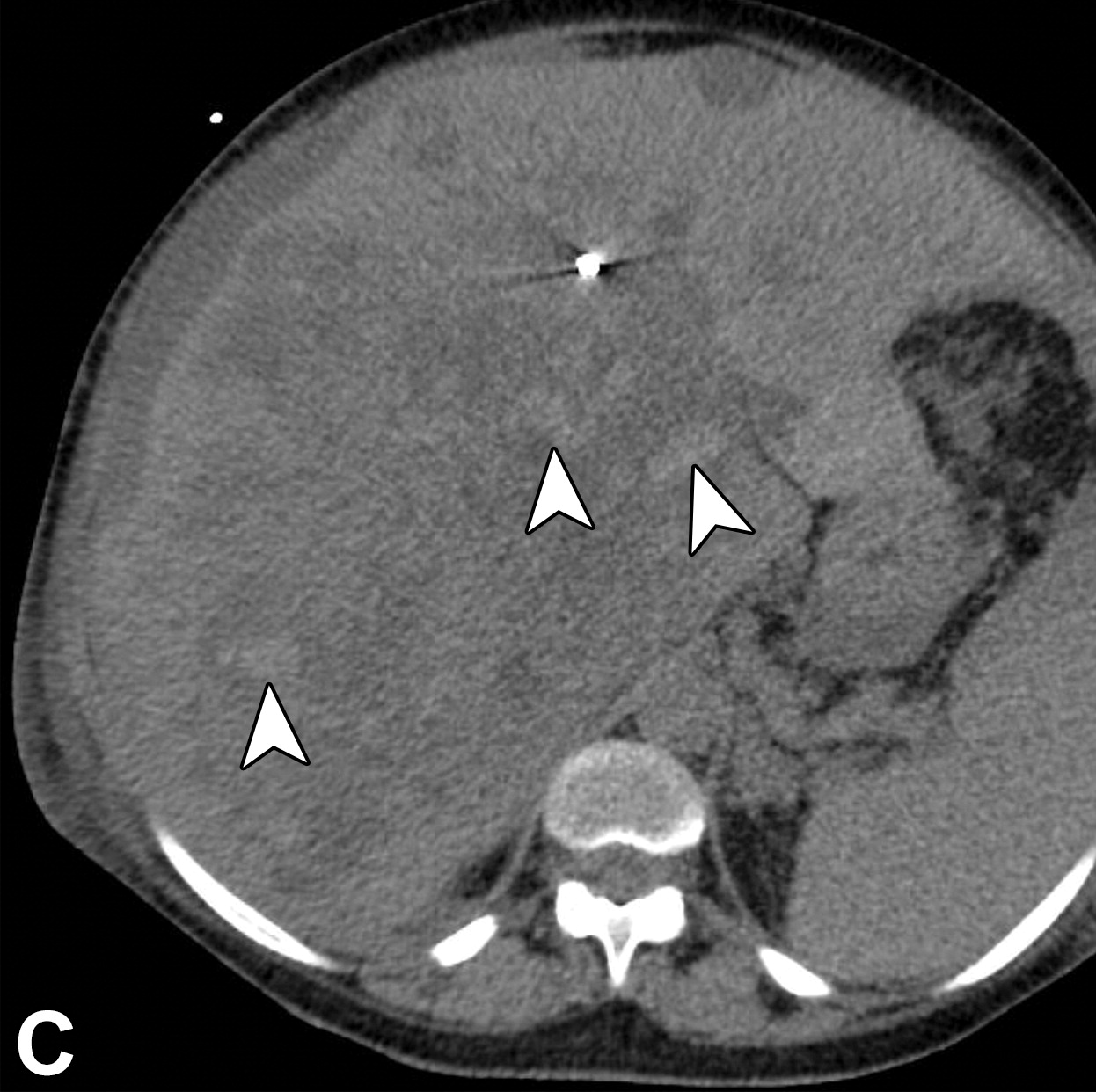
血管侵犯决定了肝癌的转移潜能,可以预测肝内转移的发生和早期复发。大体病理检查可见大血管或宏观血管侵犯,影像学表现为静脉内肿瘤,定义为静脉内软组织明显强化(上图)。MVI仅在显微镜下可见(图)。

根据受累血管的数量、与原发肿瘤的距离以及是否累及带肌壁的血管,MVI可以进一步细分【Roayaie S 2009】。在最新的AJCC TNM分期系统中,MVI是T分期的重要决定因素【Chun YS 2018】。然而,组织学上诊断和量化MVI的最佳标准仍存在争议。

根据受累血管的数量、与原发肿瘤的距离以及是否累及带肌壁的血管,MVI可以进一步细分【Roayaie S 2009】。在最新的AJCC TNM分期系统中,MVI是T分期的重要决定因素【Chun YS 2018】。然而,组织学上诊断和量化MVI的最佳标准仍存在争议。
MVI并不少见。多中心数据显示,直径< 3 cm、2 ~ 5 cm、5 ~ 6.5 cm和> 6.5 cm的HCC中,MVI的发生率分别为25%、40%、55%和 63%【Pawlik TM 2005】。MVI是手术切除后早期复发、总生存率和移植后复发的重要预测因素【Sumie S 2014;Ho MC 2006】。为了准确诊断MVI,需要手术切除,而不是活检。因此,MVI的术前诊断是有限的,依赖于替代标志物。
为了在术前预测MVI,放射学研究集中于与MVI高度相关的影像学特征。这些特征包括肿瘤边界不光滑、包膜破裂、表观扩散系数低、肿瘤体积大、动脉早期瘤周强化和瘤周HBP低信号【Lei z 2016;Kim KA 2012】。虽然可能有价值,但推测的MVI特征需要前瞻性验证、标准化定义,以及在集成到LI-RADS和应用于临床之前提高不同阅片者之间的可靠性的未来工作【Min JH 2020】。
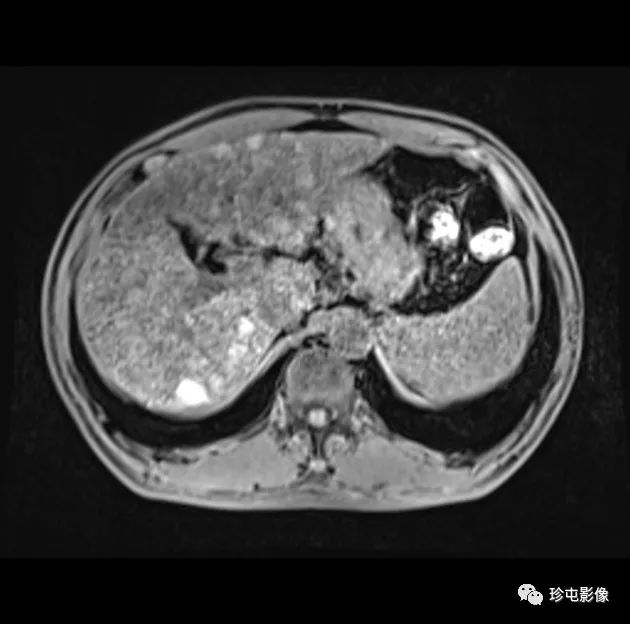
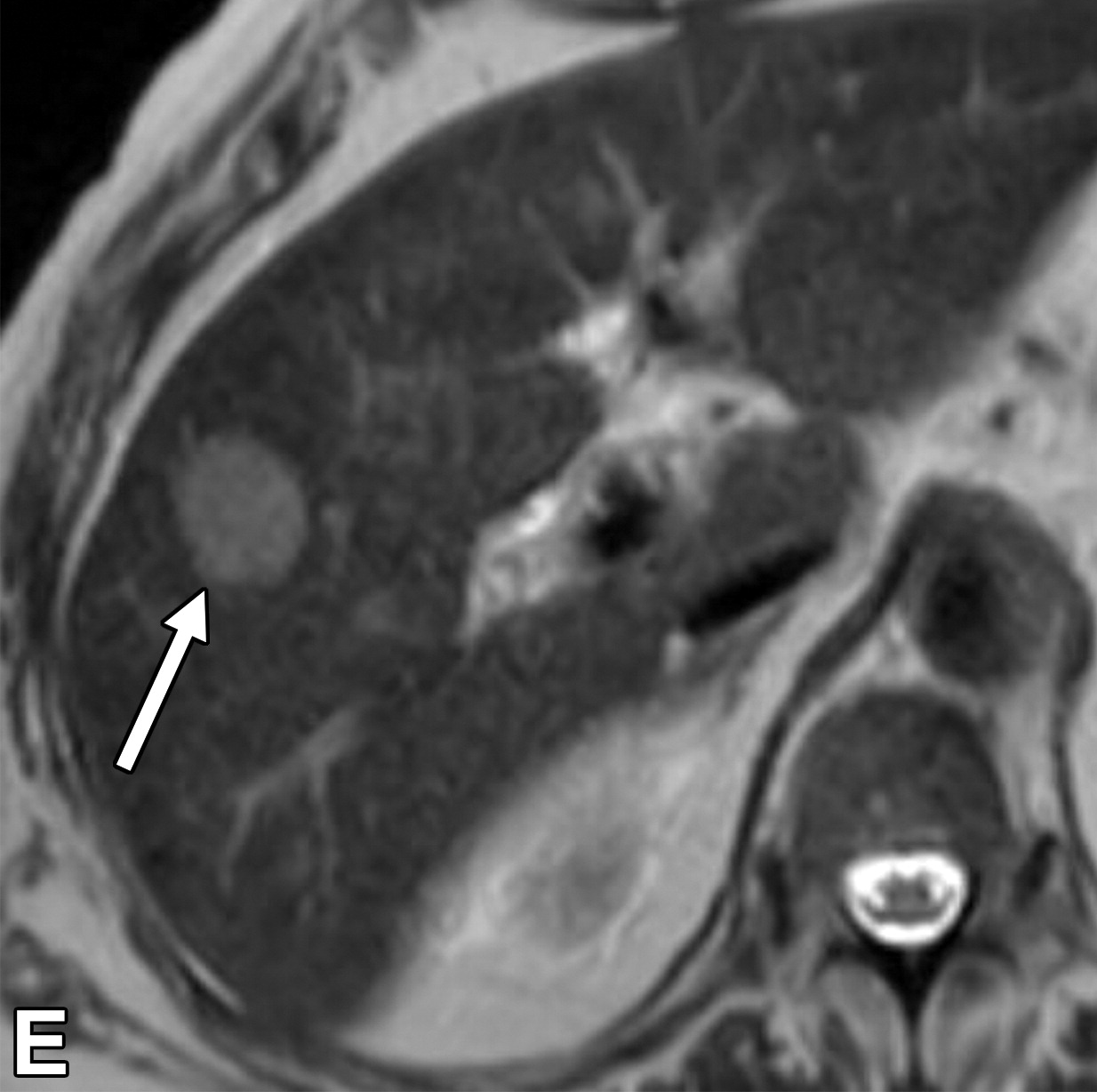
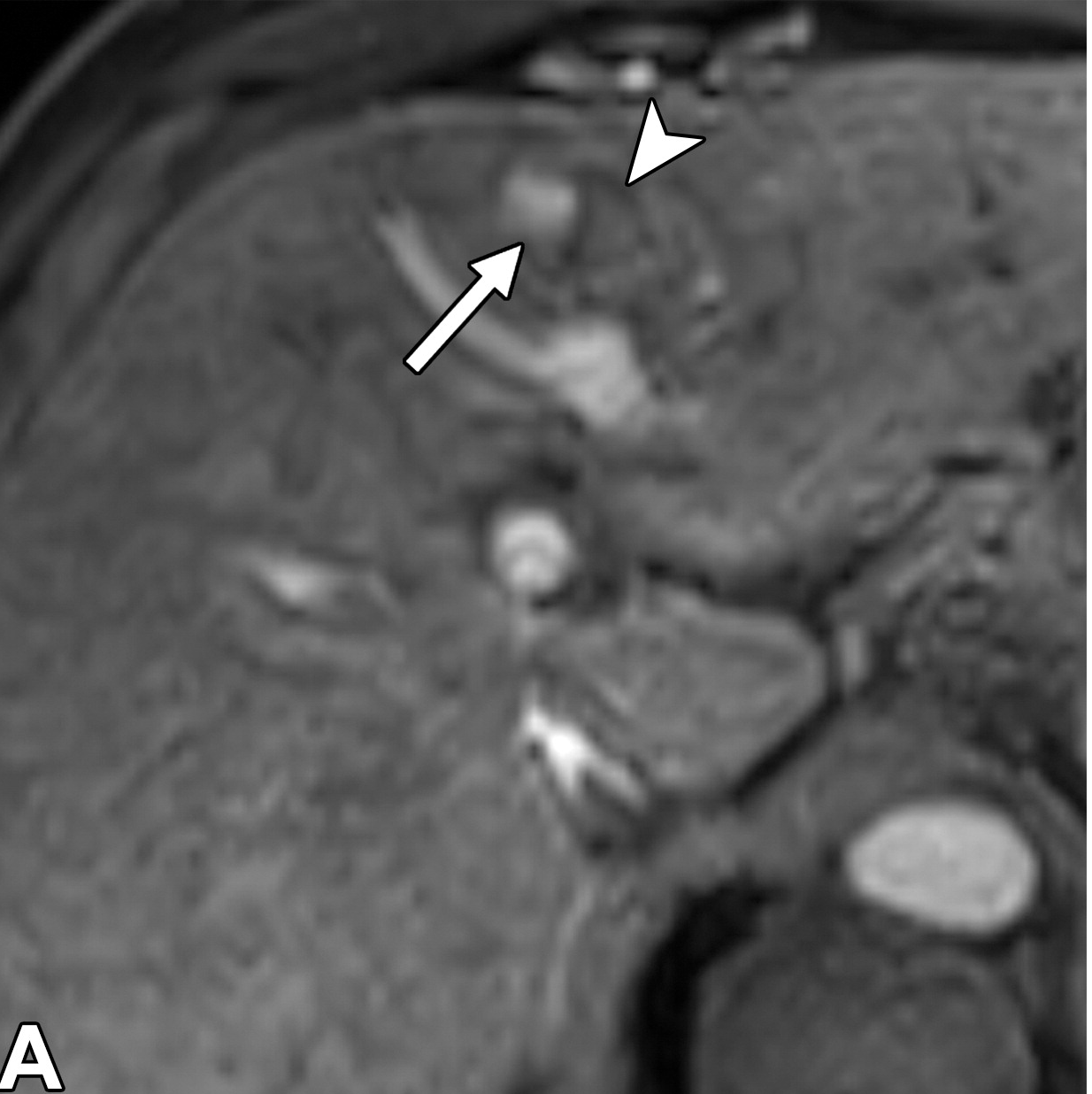
乙型肝炎肝硬化43岁男性HCC伴MVI动脉期
乙型肝炎肝硬化43岁男性HCC伴MVI动脉期
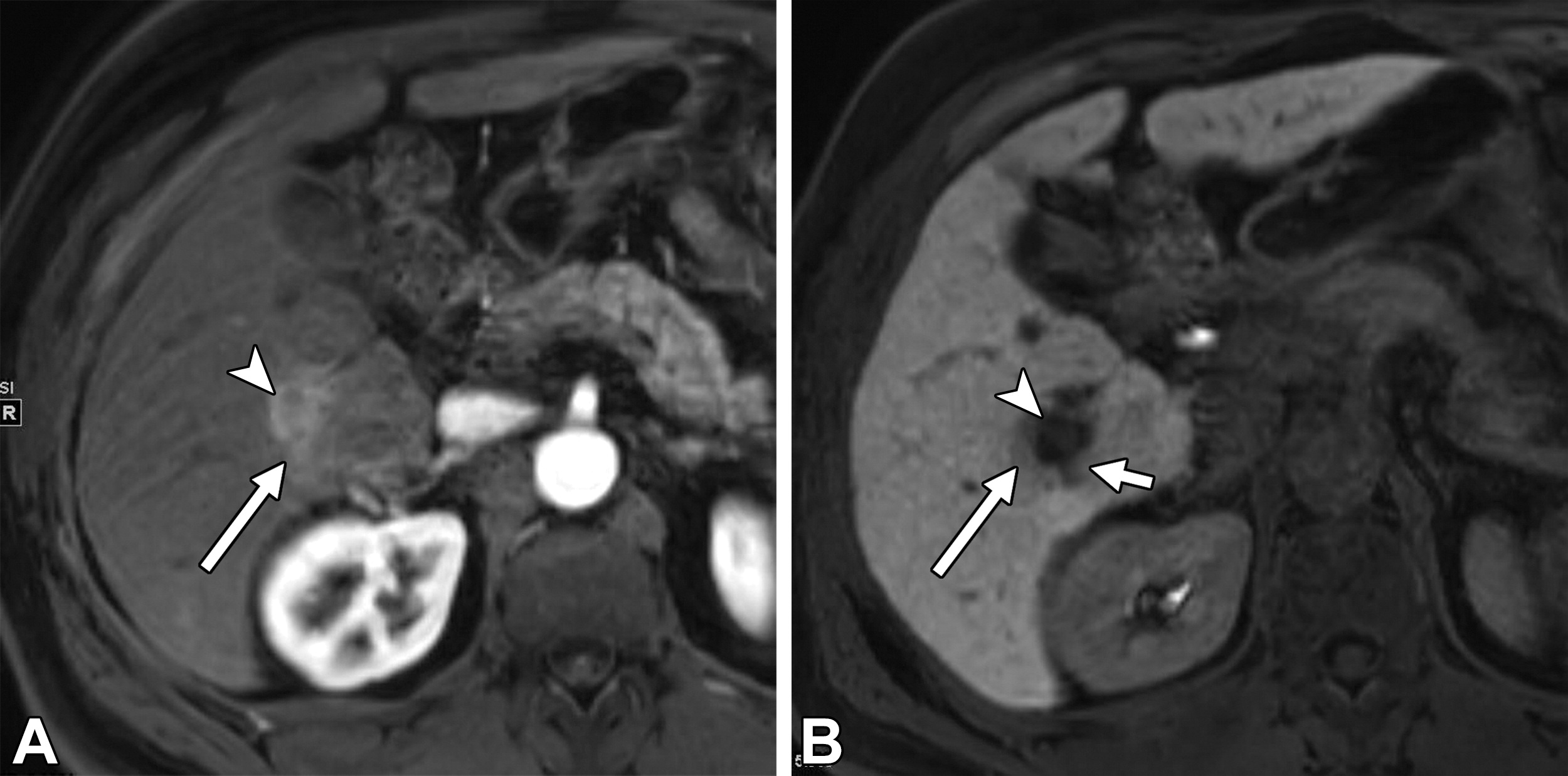 |
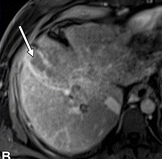
| (A)和HBP (B) MR图像显示一个直径17 mm的肿瘤(箭头),无边缘的APHE (A)和HBP (B)低信号。动脉期瘤周强化(A长箭头),肿瘤边缘不光滑(B短箭头),瘤周HBP低信号(B长箭头)。 |
- 常规肝癌(conventional HCC)占65%
- 65%常规HCC “未另说明”(NOS-HCC)"not-otherwise-specified" (NOS-HCC)
- 无明显的组织病理学特征no distinguishing histopathologic features
Hepatocyte-like模式 Hepatocyte-like pattern
嗜酸性粒细胞Eosinophylic
(宏观)小梁模式(macro)trabecular patternlittle
瘤内基质少intratumoral stroma
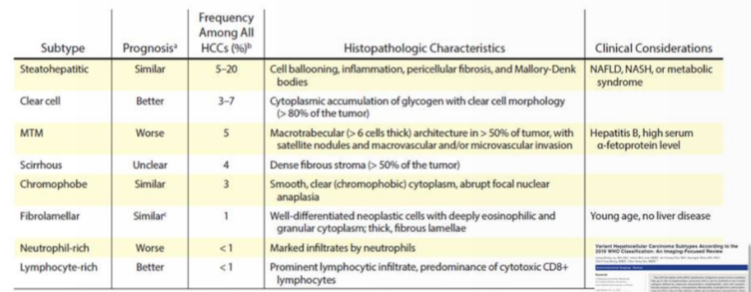
肝癌亚型
8种组织病理亚型
- 不同组织病理
- 不同影像学表现
- 不同的预后

肝细胞癌(HCC)是一种基于肿瘤分级、有无血管侵犯、病理和分子分类而具有不同生物侵袭性的恶性肿瘤。HCC的不同病理和分子表型对预后影响的认识和理解正在出现,治疗方法有望改善HCC的预后,否则仍然是一种致命的癌症。影像学在HCC的诊断中具有核心作用。然而,迄今为止,成像算法并没有根据其生物侵袭性纳入HCC的预后特征或亚分类。新出现的数据表明,一些影像学特征和进一步的放射学、病理学或放射学分子表型可以预测HCC患者的预后。
世界卫生组织第五版病理亚型
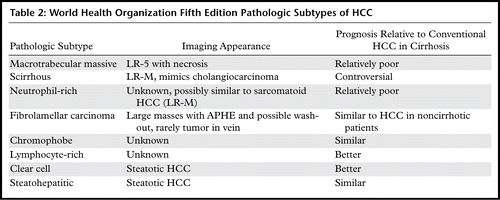

2019年世卫组织消化系统肿瘤分类第5版估计,高达35%的肝细胞癌(HCC)可分为按分子特征定义的八种亚型之一:脂肪肝型、透明细胞型、大小梁块状、硬化型、嫌色型、纤维板层型、富中性粒细胞型和富淋巴细胞型HCC。由于其独特的细胞和结构特征,这些亚型可能不会表现为动脉期高强化和冲洗外观,这是HCC的典型MRI特征,这给HCC等病变的无创诊断带来了挑战。此外,某些具有非典型影像学特征的亚型预后比其他HCC差。一系列不同的影像学特征可能有助于怀疑肝脏病变代表这些HCC亚型之一。在这篇综述中,我们根据2019年WHO分类描述了已报道的与各种HCC亚型相关的MRI特征,并重点介绍了目前对这些亚型的病理和分子基础的理解以及与临床实践的相关性。影像学结果区分良性肝脏病变和非HCC恶性肿瘤亚型。熟悉这些亚型及其影像学特征可能使放射科医生提示它们的存在,尽管仍需要组织学分析来确定诊断。
High light
• 2019年世卫组织分类中描述的变异HCC亚型(占HCC的35%)可能表现出HCC的非典型影像学特征。
• 某些具有非典型影像学特征的HCC亚型预后比NOS-HCC差。
• 熟悉HCC亚型及其影像学特征可以使放射科医生提示其存在,但仍需要组织学分析来确定诊断。
- 组织病理特征
- 细胞膨胀
- 炎症细胞周围纤维化 + Mallory-Denk小体
临床考虑 Clinical Consideration
- 非酒精性脂肪病(NAFLD)
- 非酒精性脂肪性肝炎(HASH)
- 与代谢综合征有关
成像 imaging
- 病变内脂肪
- 肝实质脂肪变性(常无肝硬化)
- APHE(动脉期非边缘性增强)和快进快出 (LR-5)
预后
- 类似的
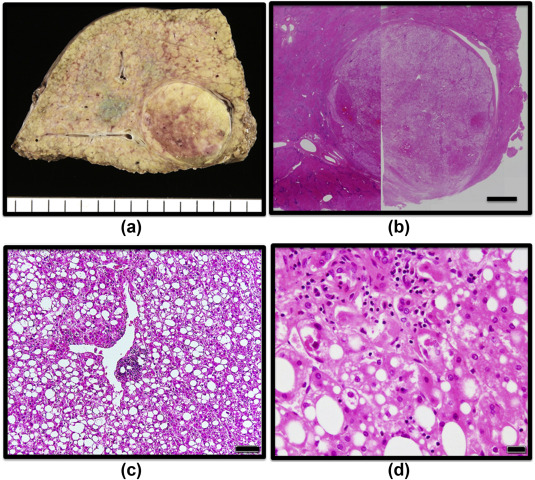
脂肪性肝细胞癌(5-20%) Steatohepatitic HCC (5-20%)
- 组织病理特征
- 细胞膨胀
- 炎症细胞周围纤维化 + Mallory-Denk小体
临床考虑 Clinical Consideration
- 非酒精性脂肪病(NAFLD)
- 非酒精性脂肪性肝炎(HASH)
- 与代谢综合征有关
成像 imaging
- 病变内脂肪
- 肝实质脂肪变性(常无肝硬化)
- APHE(动脉期非边缘性增强)和快进快出 (LR-5)
预后
- 类似的

 |
 |
 |
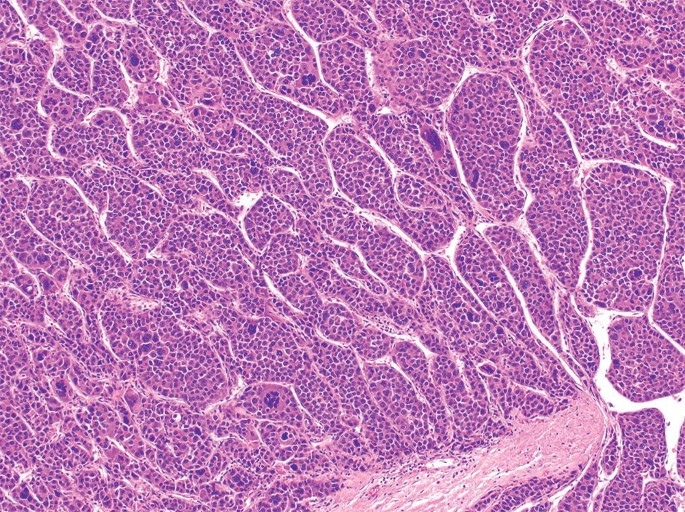
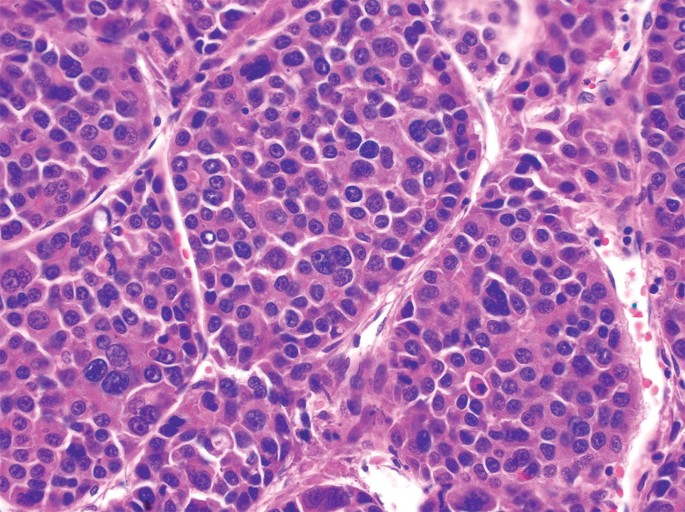
富粗梁型肝癌亚型 Macrotrabecular massive subtype -MTM –(5%)
组织病理特征 Histopathologic Characteristics
- 大于50%的肿瘤有大梁结构 Macrotrabecular architecture in >50% of tumor
临床考虑 Clinical Considerations
- 乙型肝炎 Hepatitis B
- a-胎蛋白水平高 High a-fetoprotein level
成像 Imaging
- 通常为LR5,坏死>20% Usually LR5 with necrosis>20%
- 混合性动脉低/高密度血管 Mixed arterially hypo/hyper-vasc
- 瘤内动脉Intratumoral artery
- 肿瘤边缘不光滑 nonsmocth tumor margin
- 冠状增强 corona enhancement
预后 Prognosis
- 差,早期血管侵润,早期转移,早期复发
 |
 |
 |
 |
 |
| Macrotrabecular-massive subtype of hepatocellular carcinoma in a 62y man. The lesion shows heterogeneous high signal intensity on T2WI and was first segmented in red (a). The component of intralesion fat exhibit high signal intensity on axial in-phase T1-weighted image (b). And the signal drop on the out-of-phase image (c). The rad-score of this lesion was -13.862 |


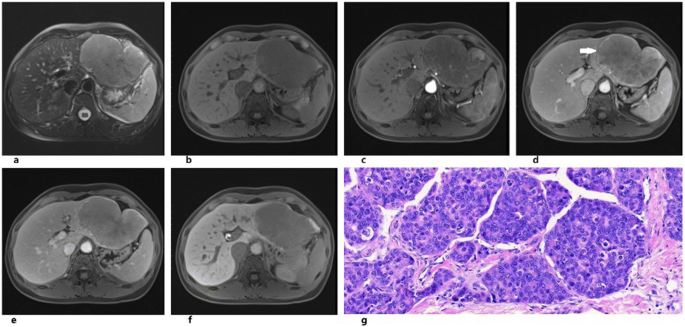

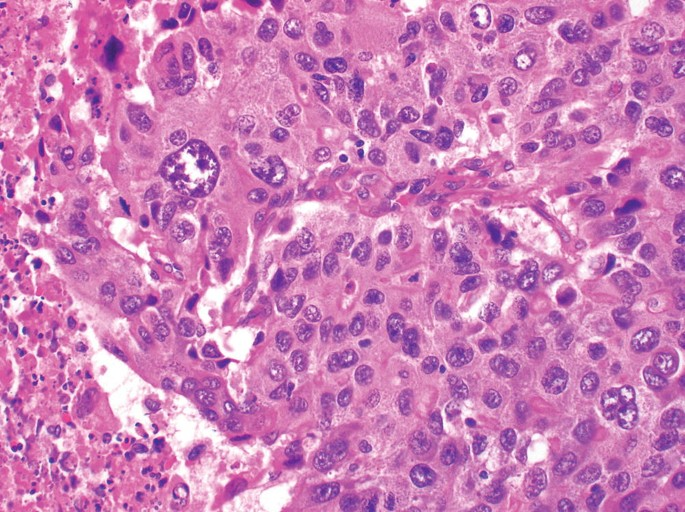
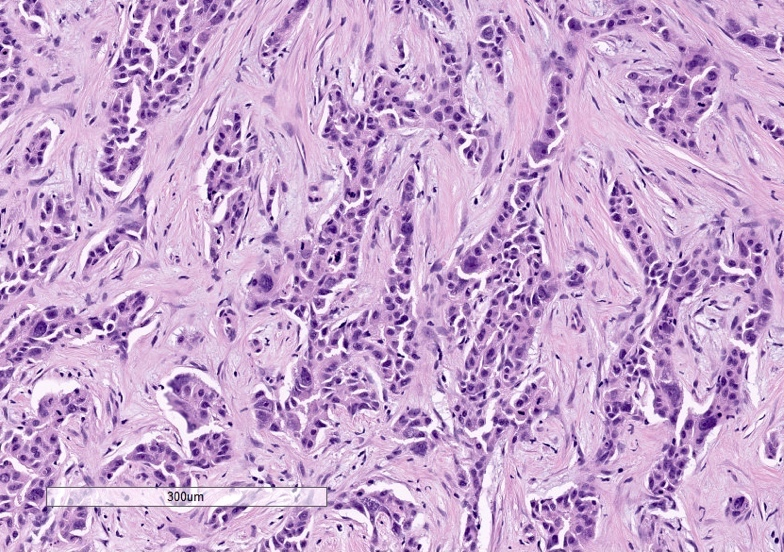
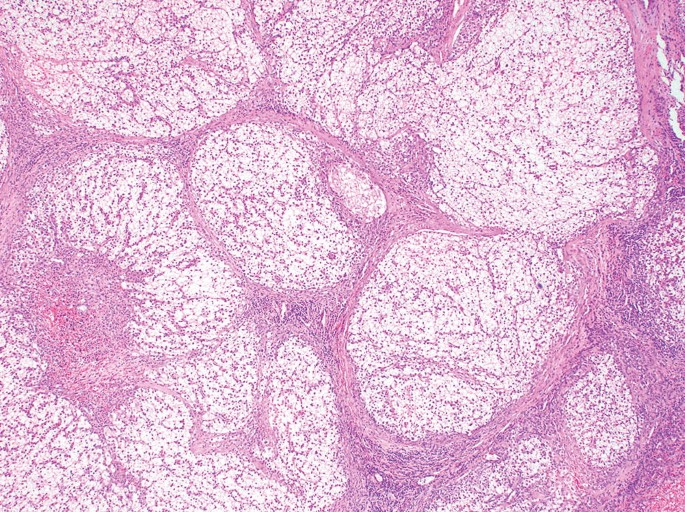
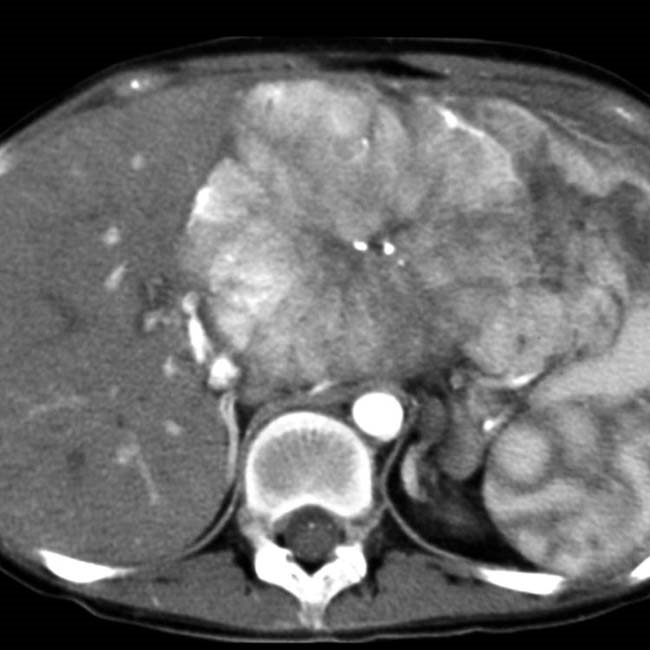
硬化性肝细胞肝癌 Scirrhous HCC (4%)
组织病理特征 Histopathologic Characteristics
- >50%的肿瘤有致密纤维化 dense fibrosis in >50% of the tuma
临床考虑 Clinical Considerations
- a-胎蛋白水平低 low a-fetoprotein level
成像 Imaging
- 非典型 atypicall
- 动脉期下肢强化(边缘) penpheral enhancement in the arterial phase (rim)
- 然后在平衡阶段进行渐进式同心充填 followed by progressive concentric filling in the equilibrium phase
- 中央T2低密度! central T2 hypointensity!
- 类似肝内胆管癌 can mimick iCC!!!
Prognosis
= 不明确(复发率较低,但OS较差) unclear (lower recurrence rates, but poorer OS)
 |
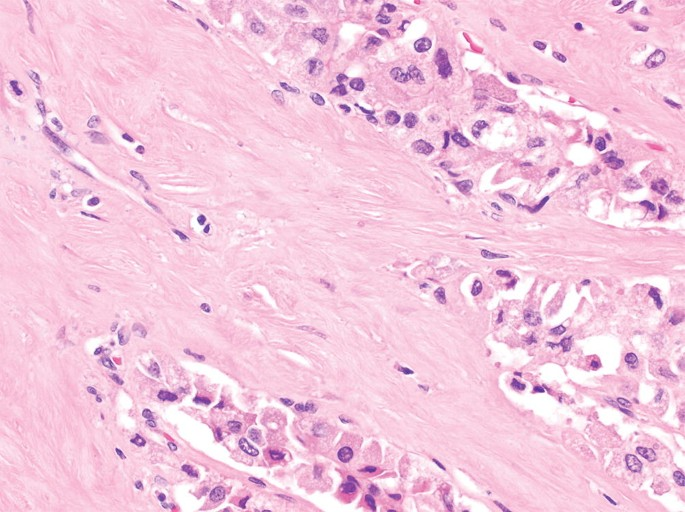 |
 |
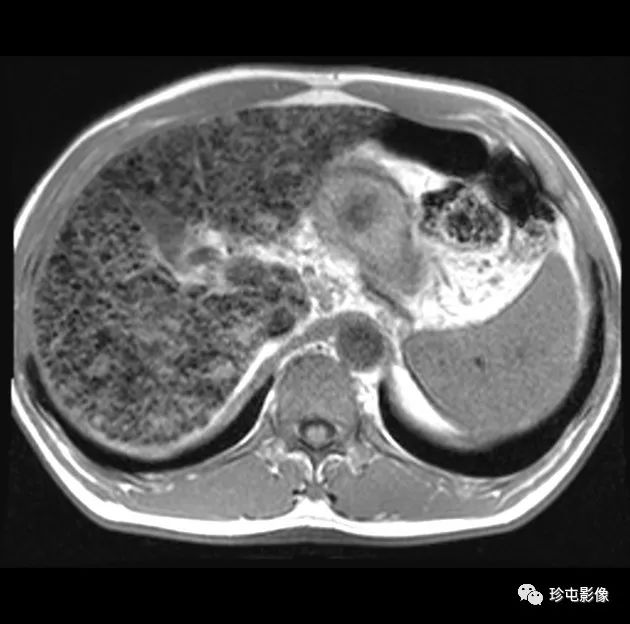
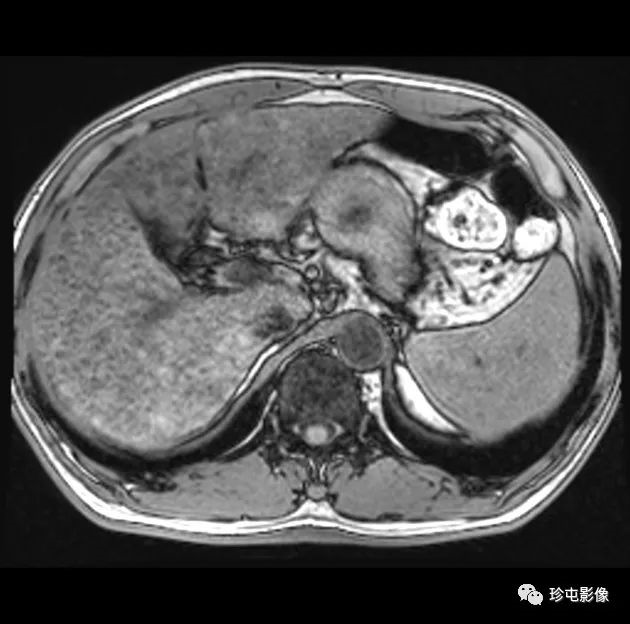
53岁男性乙型肝炎感染的肝硬化肝细胞癌
 |
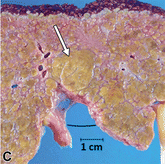
| (A, B)动脉期(A)和HBP (B) MR图像显示40毫米肿瘤,边缘APHE (A中箭头),HBP低(B中长箭头),肿瘤边缘不光滑(B中短箭头)和肿瘤周围HBP低(B中箭头)。一个靶样特征(边缘APHE)的存在导致LR-M(可能或肯定恶性,非HCC特异性)分类。(C)大体标本照片显示一个分叶状肿块,呈棕白色区域,反映出肝硬化肝细胞癌胶原结缔组织的高含量 |
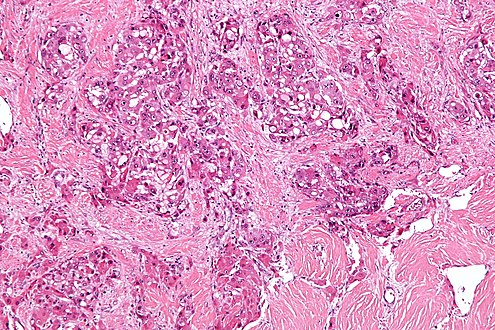
透明细胞性肝癌(3-7%)
Clear Cell HCC (3-7%)
组织病理特征 Histopathologic Characteristics
- >80%透明细胞(可能被误认为RCC!)>80% clear cells(can be mistaken as RCC!)
临床考虑 Clinical Considerations
-有和没有肝硬化 with and without cinhosis
影像 Imaging
-病变内脂肪(信号下降) Intralesional fat (signal drop)
-可能类似脂肪性肝细胞癌May mimick steatohepatitic HCC
-包膜 capsule
-动脉器边缘环形增强(APHE)+ (造影剂)快进快出 washou t (LR 6)
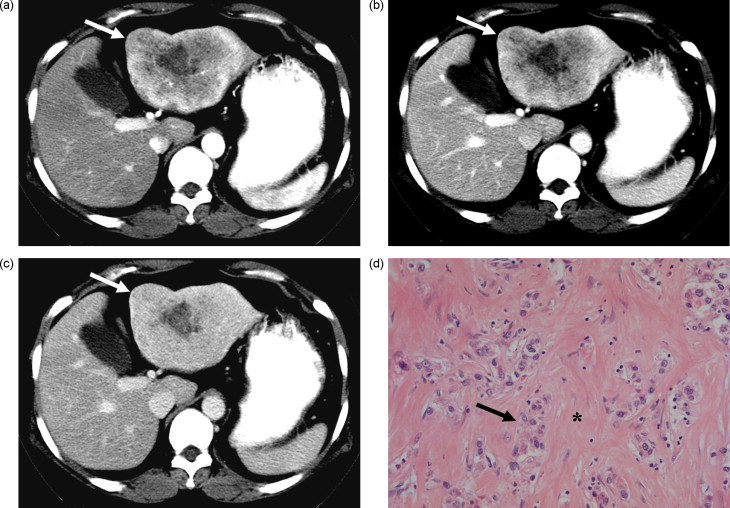
 |
| (A) 肝脏CT平扫示7节段低密度肿块,最大直径30mm。(B) 动态增强CT显示动脉期环状强化。(C)平衡期可见增强囊,病灶中心略有增强。 |
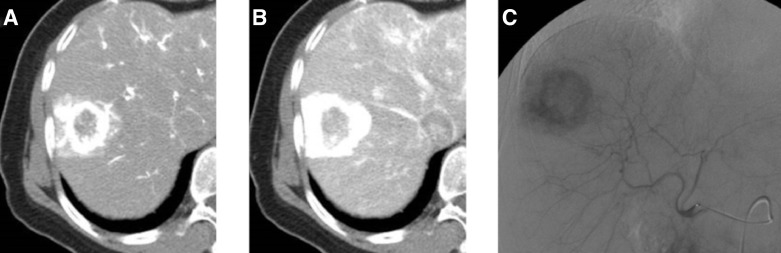 |
| (A) 肝动脉造影时CT显示边缘APHE,病变中心可见新生血管。(B) 肿瘤周围也可见电晕增强。(C) 普通肝动脉造影显示边缘强化。 |
预后 Prognosis
-Better (low vascular invasion, better OS after resection)
更好(低血管侵犯,术后OS更好)
 |
 |
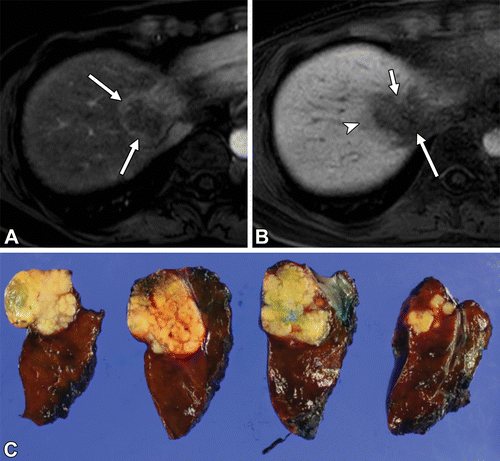
纤维板层性肝癌 Fibrolamellar HCC (1%)
组织病理特征 Histopathologic Characteristics
高分化肿瘤细胞厚的纤维状隔 Well-differentiated tumor cells thick, fibrous septae
 |
 |
临床考虑 Clinical Considerations
年轻 Young age,
没有肝病→通常切除 no liver disease→usually resection
影像 Imaging
肿块大非边缘性动脉期增强(APHE)和快进快出 (LR 5) Large masses with APHE and washout (LR 5)
中心疤痕 (不要与局灶性结节样增生)Central scar (not to confuse with FNHI)
 |
 |
预后 Prognosis
预后更好,因为年轻 Better (because of younger pts)
配对组相似 Similar in matched group ,

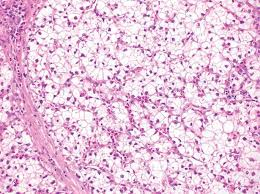
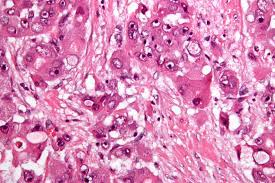
嫌色性肝细胞癌 Chromophobe Hepatocellular Carcinoma
病理特征:
组织学特征为细胞质浅(几乎苍白)、突出的局灶性核间变性(即在核细胞学阴性的肿瘤细胞中,小簇的肿瘤细胞有显著的间变性)和假性囊肿。它也与端粒酶非依赖的端粒酶维持机制相关,称为端粒的替代延长。
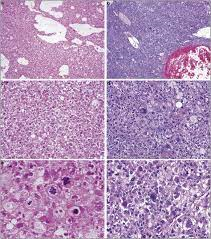
临床考虑
嫌色细胞肝癌是一种罕见的亚型,发生率为3%,通常发生于慢性乙型肝炎患者。据报道嫌色细胞肝癌的预后与NOS-HCC相似。ALT机制对同源重组的依赖可能有助于开发针对嫌色细胞肝癌的靶向治疗。
影像学特征
- 缺乏文献描述嫌色细胞肝癌的影像学特征。
MRI表现为5例嫌色细胞肝癌,CT表现为1例嫌色细胞肝癌,共6例,其中5例表现为APHE,门静脉期廓清,假包膜较厚,5例MRI表现为稍T1低信号,稍T2高信号。
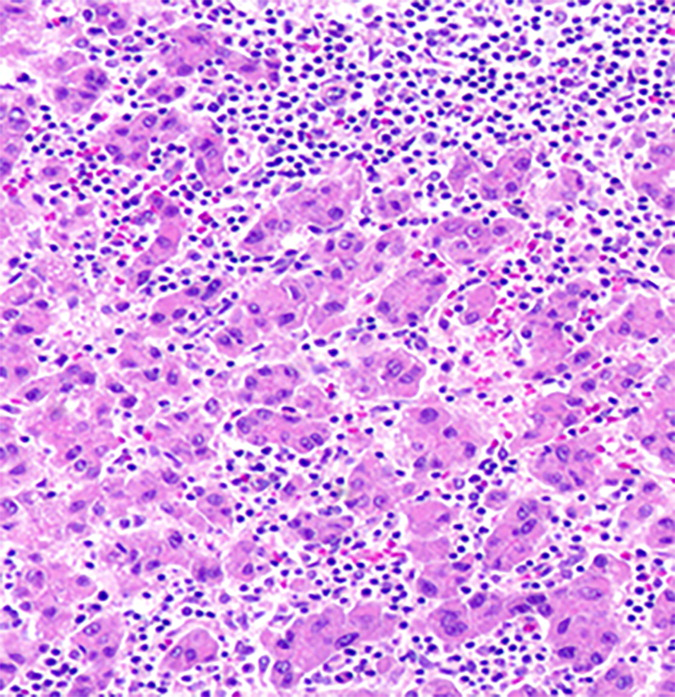
富含中性粒细胞性肝癌 Neutrophil-Rich Hepatocellular Carcinoma
病理特征-也被称为产生粒细胞集落刺激因子的HCC[55],
这种极其罕见的HCC亚型的发生率低于1%,目前报道的病例不到10例,大多数发生于老年患者。其特征是产生粒细胞集落刺激因子,导致广泛的中性粒细胞浸润。大多数报道的病例为低分化,并有局灶性肉瘤样分化。患者白细胞计数、血清白细胞介素6、c反应蛋白水平均明显升高。
这种极其罕见的HCC亚型的发生率低于1%,目前报道的病例不到10例,大多数发生于老年患者。其特征是产生粒细胞集落刺激因子,导致广泛的中性粒细胞浸润。大多数报道的病例为低分化,并有局灶性肉瘤样分化。患者白细胞计数、血清白细胞介素6、c反应蛋白水平均明显升高。
影像学特征
—现有的病例报告提供了关于富含中性粒细胞的HCC的影像学表现的信息缺乏。现有资料提示,该亚型在CT和MRI上表现与典型HCC相似。Joshita et al.报道了一例富含中性粒细胞的HCC,在CT平扫图像上表现为衰减降低,APHE和快进快出,早期和晚期均表现为周围弥漫性高增强。MRI显示肿瘤呈T1低信号、T2高信号,血管造影显示肿瘤血流丰富。Kohno等和Sakamoto等报道了富含中性粒细胞的HCC,其低密度中心提示坏死、APHE和快进快出。然而,Aita el al 。Nagata等描述了不典型的CT表现,前作者描述了CT上有壁强化的结节状囊性表现。
临床考虑:
富含中性粒细胞的HCC通常生长迅速,预后比NOS-HCC差。伴肉瘤样改变的病例通常比不伴肉瘤样改变的病例预后差。由于迄今报告的病例数量较少,关于最佳管理方法的信息不足。由于大多数报道的肿瘤确诊时已属晚期,手术切除总体无效。包括根治性手术、放疗和化疗的多模式治疗被建议为。
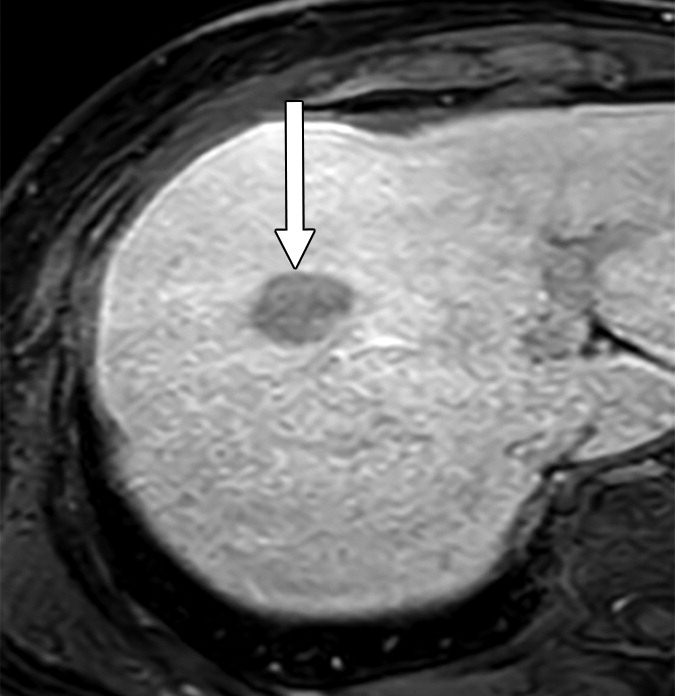
富含淋巴细胞性肝癌 Lymphocyte-Rich Hepatocellular Carcinoma
病理特征:
淋巴细胞丰富型HCC,又称淋巴上皮瘤样HCC,是一种非常罕见的HCC变体,发生率小于1%。
淋巴细胞浸润明显,淋巴细胞数量往往超过肿瘤细胞。
浸润淋巴细胞以细胞毒性CD8+淋巴细胞为主[2]。
肿瘤细胞通常细胞核大,核仁突出,胞浆嗜酸性丰富。
淋巴细胞丰富型HCC,又称淋巴上皮瘤样HCC,是一种非常罕见的HCC变体,发生率小于1%。
淋巴细胞浸润明显,淋巴细胞数量往往超过肿瘤细胞。
浸润淋巴细胞以细胞毒性CD8+淋巴细胞为主[2]。
肿瘤细胞通常细胞核大,核仁突出,胞浆嗜酸性丰富。

影像特征-关于富含淋巴细胞的HCC的影像特征信息匮乏,仅在少数病例报告中有描述。
与NOS-HCC相似。
表现为T1低信号、T2高信号、扩散受限、
增强呈APHE和快进快出。
与NOS-HCC相似。
表现为T1低信号、T2高信号、扩散受限、
增强呈APHE和快进快出。
 |
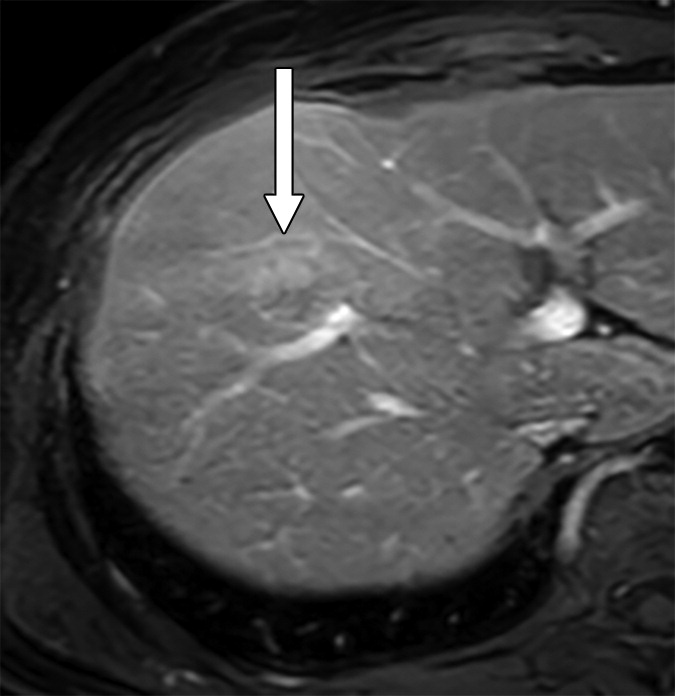 |
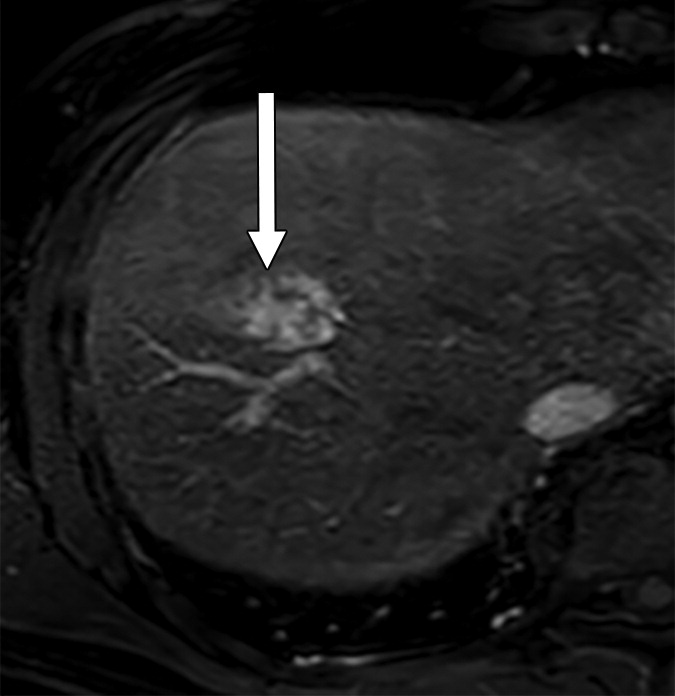 |
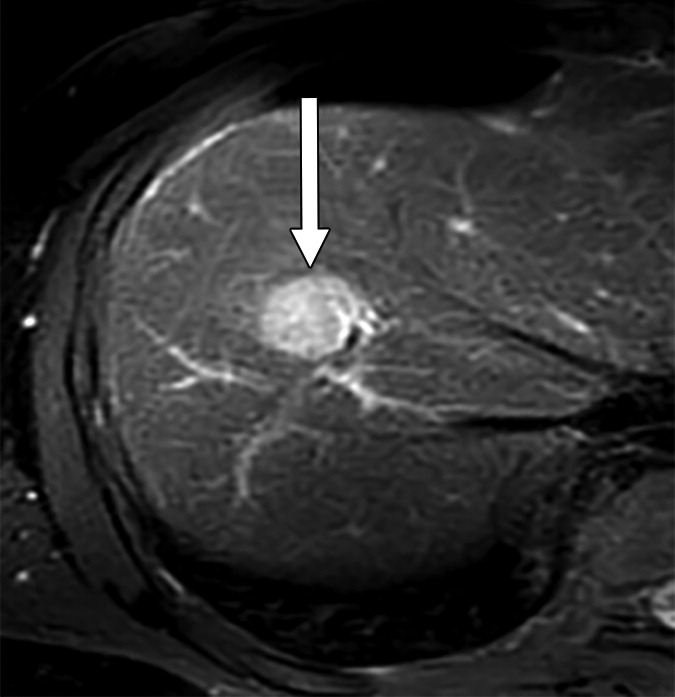 |
这些病理性改变和介入有什么关系? What has this to do with TACE or interventional radiology?
图示为增殖性和非增殖性肝癌的特征

ADC = apparent diffusion coefficient,
AKT = protein kinase B-1,
AP = arterial phase,
ARID1A = AT-rich interaction domain 1A
ATM = serine/threonine kinase
AXIN1 = axis inhibitor 1
CK19 = cytokeratin 19
CRP = C-reactive protein
CTNNB1 = β-catenin gene
EpCAM = epithelial cell adhesion molecule
FGF19 = fibroblast growth factor 19
GS = genomically stable
hyper = hyperintensity
hypo = hypointensity
IGF2 = insulinlike growth factor 2
iso = isointensity,
AK = Janus kinase
MAPK = mitogen-activated protein kinase
NOTCH = notch oncogene
Phospho-ERK = phosphorylation of extracellular signal-related kinase,
hosopho-S6 = phosphorylation of ribosomal protein S6
PI3K = phosphoinositide 3–kinase
RAS = Ras protein
RPS6KA3 = ribosomal protein S6 kinase A3,
STAT = signal transducer and activator of transcription
TGF-β = transforming growth factor-β
TIV = tumor in vein
TP53 = tumor protein p53
TSC = tuberous sclerosis (1 and 2).
肝细胞癌(HCC)可分为增殖性和非增殖性,这可能对常规经动脉化疗栓塞(cTACE)后的结局有影响。cTACE前常规不进行活检以识别增殖性HCC。
 |
|
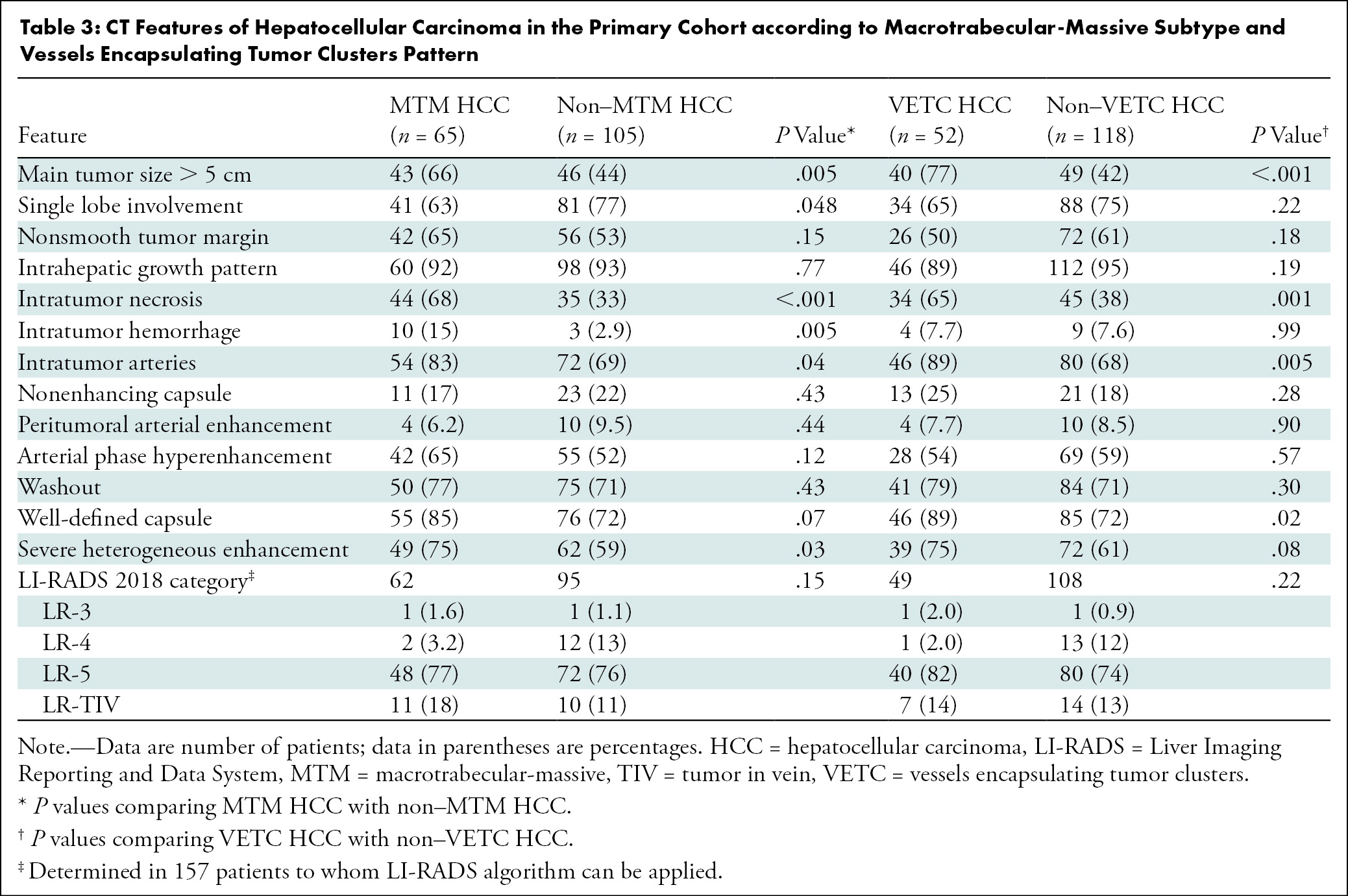
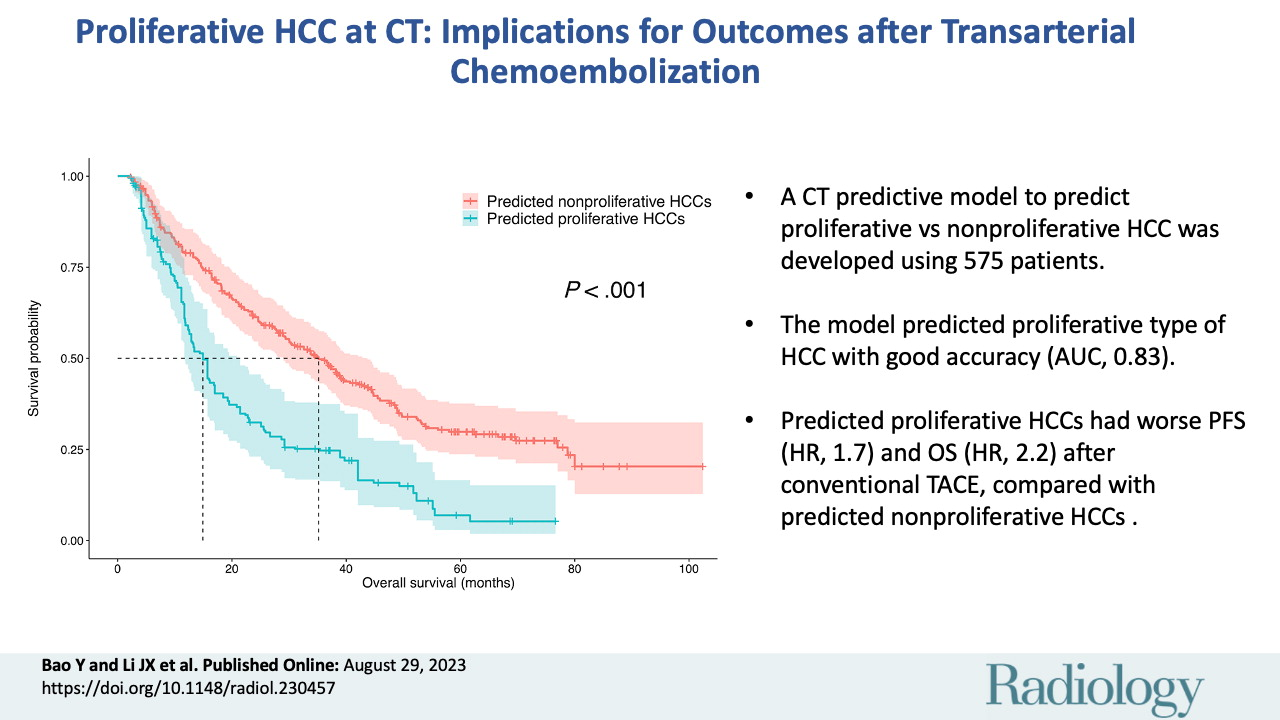
共计1,194例患者(男性1,021例;平均年龄54岁±12岁(SD);中位随访时间为29.1个月)。该预测模型名为SMARS评分,包括分叶状形态、马赛克结构、甲胎蛋白水平、动脉期边缘高增强和卫星病灶。在训练组和验证组中,SMARS评分的受试者工作特征曲线下面积分别为0.83和0.80。根据SMARS评分,预测增殖型hcc患者(n = 114)的肿瘤缓解率较低(48% vs 71%;P & lt;.001)和更差的PFS(6.6个月对12.4个月;P <.001)和OS(14.4个月对38.7个月;P <.001)高于非增殖性肝癌(n = 263)。【Yan Bao 2023 】
该预测模型具有较好的鉴别增殖性hcc的性能。根据SMARS评分预测增殖型肝癌患者cTACE术后预后较预测非增殖型肝癌患者差。
肝癌的组织病理
SMARS 评分
SMARS 评分
- S shape of the tumor (肿瘤形状)
- M mosaic architecture (马赛克结构) 【】
- A stands of AFP level (AFP水平)
- R rim APHE (边缘APHE)
- S satellite lesion (卫星病变)
在肝癌诊疗过程中,由于影像学的进步,我们很少依赖穿刺活检,临床的现实是肝癌更为复杂。BCLC定义TACE的适应症是BCLC B期,此一分组呢的肝细胞肝癌,肿瘤荷载和肝功能是异质性的。还包括许多另外的肿瘤特征
- 肿瘤生长类型
- 多血管性
- 血管解剖(是否有利于TACE
- 其它
患者从TACE获益是非常不同的
决定TACE应用概况
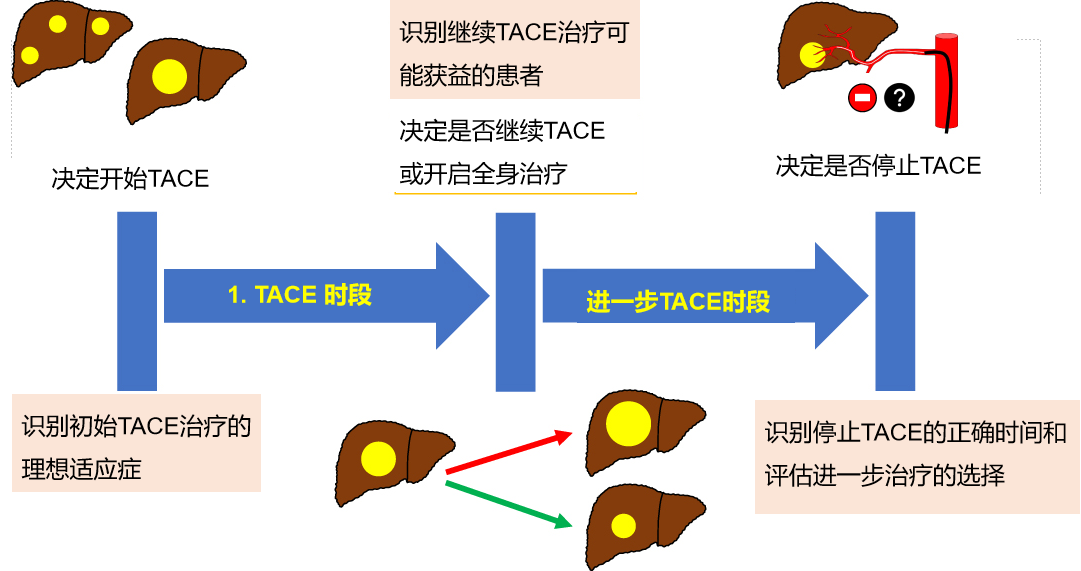
a) 确定最佳人选开始初始TACE治疗,
b) 尝试在TACE治疗过程中支持决策,
c) 在何时停止TACE提供最后指南信息。
开始TACE治疗: 哪些患者是TACE的最佳候选者?
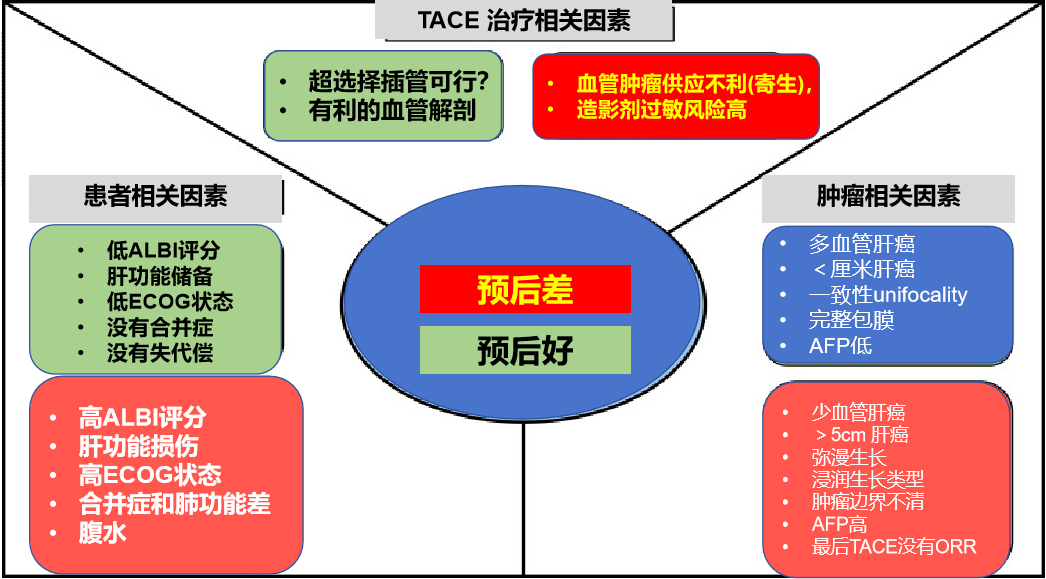
在定义的BCLC B期患者队列中,中位OS约为2.5年【Golfieri 2014】。如果更严格地遵循TACE的纳入标准,生存率可提高至4年【Burrel M 2012】。 这些差异强调了选择最适合TACE的患者的必要性。然而,尽管西方指南提出了建议,但在临床现实中,是否开始TACE治疗的决策仍然是一个复杂的决策,有多种可能的影响因素。
UP TO 7 最初适用于肝移植,但与TACE术后的中位OS 有良好的相关性
在过去十年中,已经确定了几个预测因素。肿瘤影像特征可以提供重要的依据。首先,肿瘤大小和病变数量的重要特征与患者的预后相关【Galle2018; Lo CM 2002;Burrel M 2012】。此外,较大的肿瘤与TACE疗效较差和较高的栓塞后综合征风险相关。栓塞后综合征描述了包括发热、恶心、呕吐和右上象限疼痛在内的一系列症状,发生于高达80%的患者。它是TACE后最常见的不良事件,也是导致住院时间延长的急性住院治疗的主要原因【Kogut MJ 2013】。常用的肿瘤大小临界值为5 cm。特别是up- 7标准 (结合了肿瘤大小和病变数量,最初设计用于评估肝移植的适用性)与TACE后的中位OS有良好的相关性【Maxaferro 2009】。
肝癌影像学肿瘤生物学相关特征未被纳入BCLC分期系统
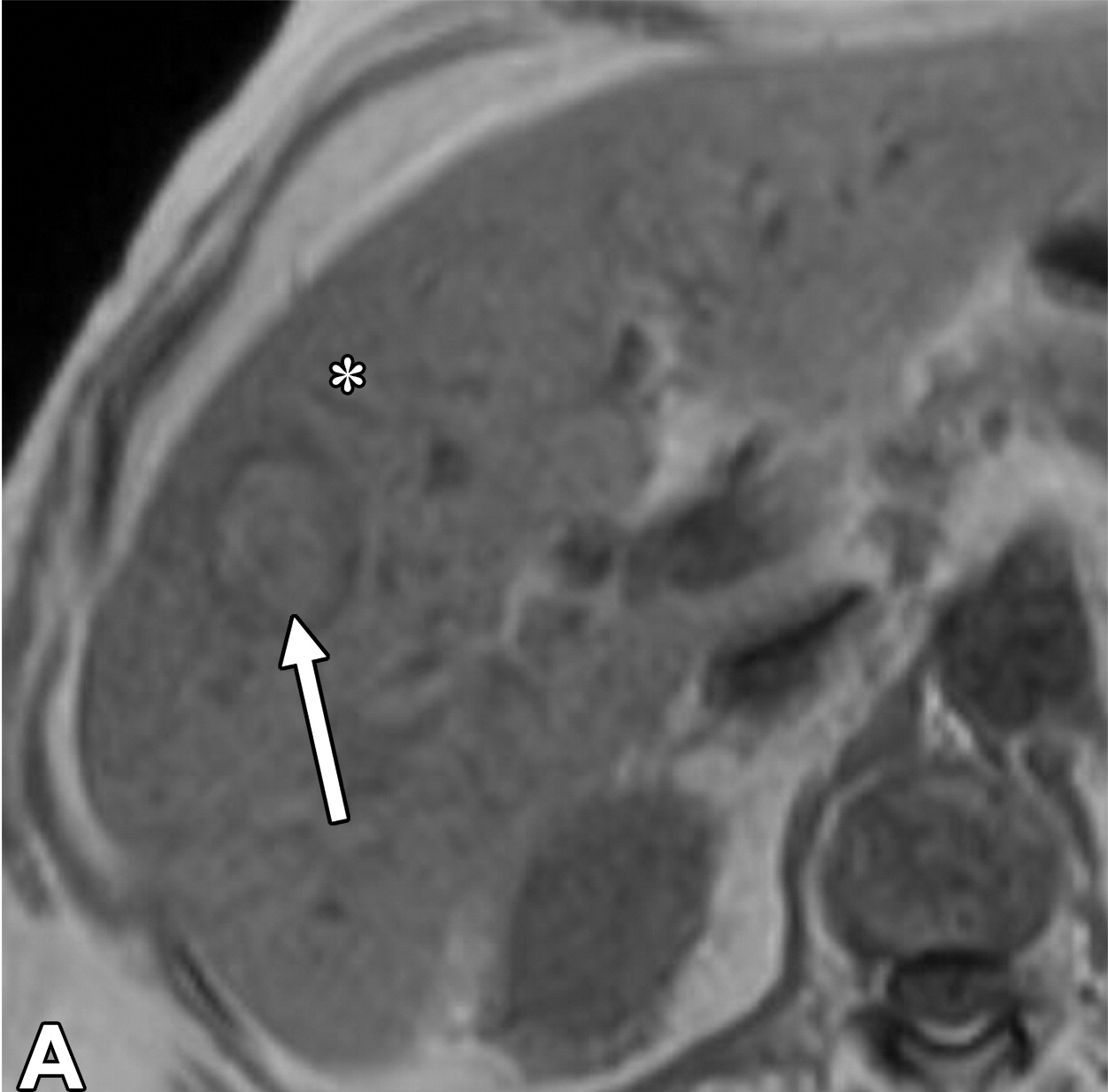
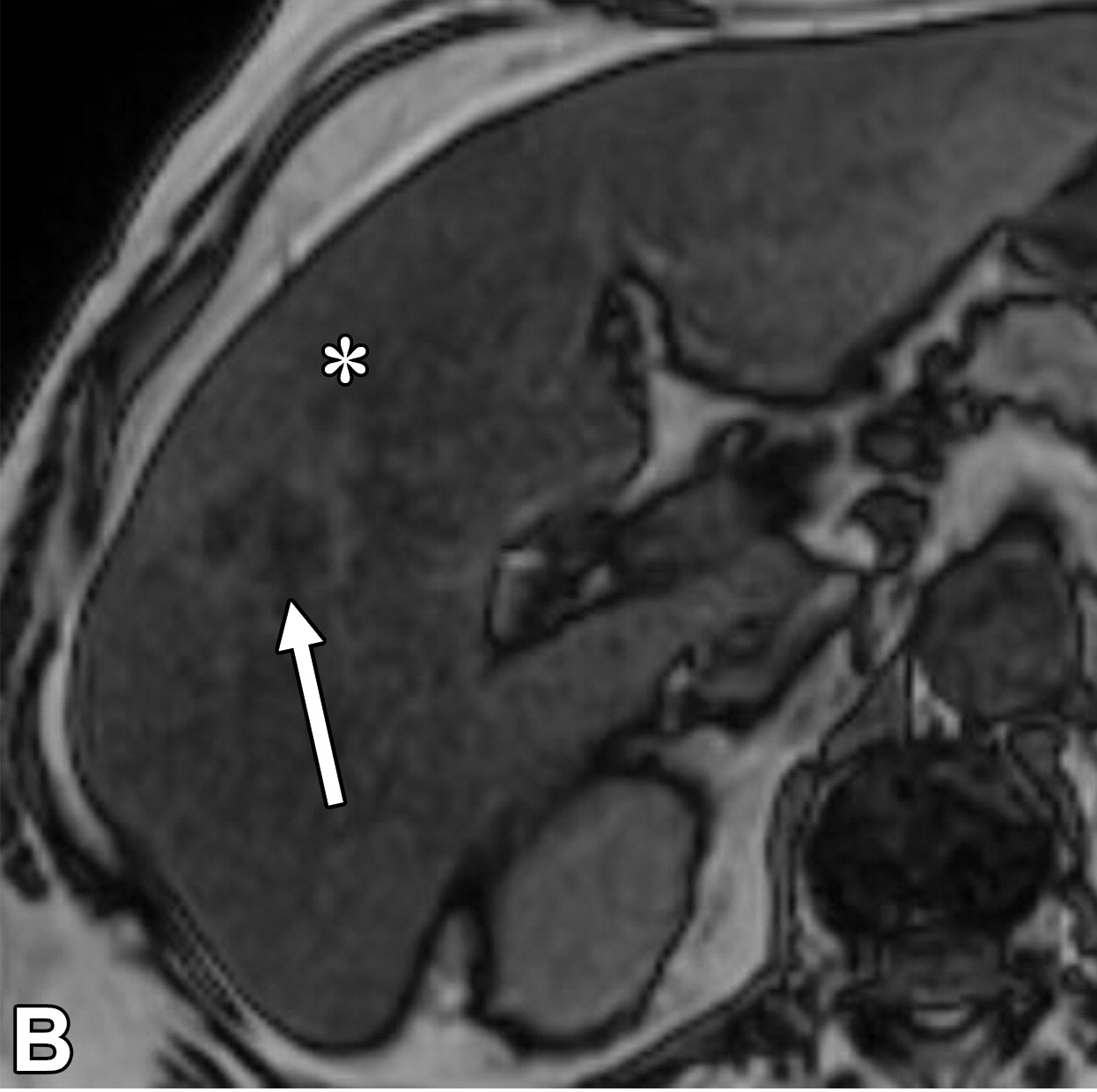
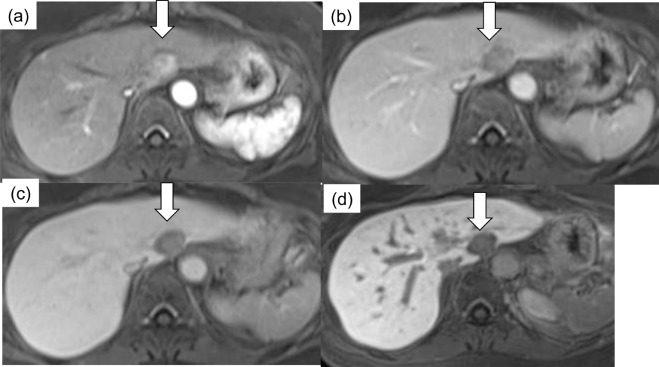
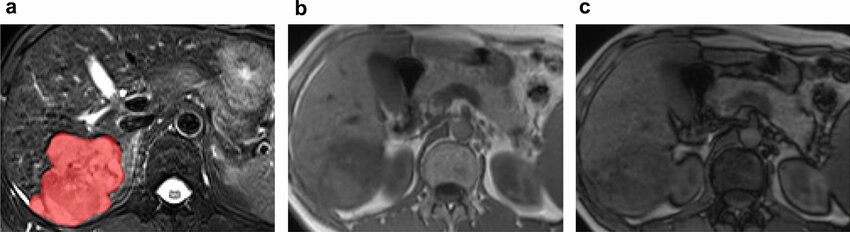
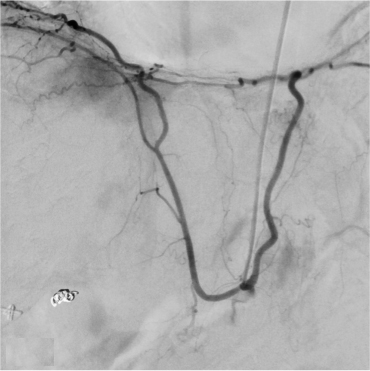
此外,影像学检查能够识别与更具侵袭性的肿瘤生物学相关的特征。这些因素虽然未被纳入BCLC分期系统,但在很大程度上影响了TACE的可行性和成功性。其中一个因素是血供程度。富血供肿瘤对TACE治疗反应性更强,治疗过程中更容易识别,预后较好。另一个重要问题是动脉解剖:较少的肿瘤供血血管和良好的解剖使超选择性栓塞成为可能。相反,不良解剖 (如广泛的寄生动脉肿瘤供血-Parasitic tumor supply) 可能使超选择手术复杂化,最终导致TACE无效。为了最大限度地增加肿瘤坏死,同时最大限度地减少TACE 对健康肝实质的相关副作用,
超选择性栓塞很重要下图,显示了有利和不利的TACE示例。
在过去十年中,已经确定了几个预测因素。肿瘤影像特征可以提供重要的依据。首先,肿瘤大小和病变数量的重要特征与患者的预后相关【Galle2018; Lo CM 2002;Burrel M 2012】。此外,较大的肿瘤与TACE疗效较差和较高的栓塞后综合征风险相关。栓塞后综合征描述了包括发热、恶心、呕吐和右上象限疼痛在内的一系列症状,发生于高达80%的患者。它是TACE后最常见的不良事件,也是导致住院时间延长的急性住院治疗的主要原因【Kogut MJ 2013】。常用的肿瘤大小临界值为5 cm。特别是up- 7标准 (结合了肿瘤大小和病变数量,最初设计用于评估肝移植的适用性)与TACE后的中位OS有良好的相关性【Maxaferro 2009】。
肝癌影像学肿瘤生物学相关特征未被纳入BCLC分期系统
此外,影像学检查能够识别与更具侵袭性的肿瘤生物学相关的特征。这些因素虽然未被纳入BCLC分期系统,但在很大程度上影响了TACE的可行性和成功性。其中一个因素是血供程度。富血供肿瘤对TACE治疗反应性更强,治疗过程中更容易识别,预后较好。另一个重要问题是动脉解剖:较少的肿瘤供血血管和良好的解剖使超选择性栓塞成为可能。相反,不良解剖 (如广泛的寄生动脉肿瘤供血-Parasitic tumor supply) 可能使超选择手术复杂化,最终导致TACE无效。为了最大限度地增加肿瘤坏死,同时最大限度地减少TACE 对健康肝实质的相关副作用,
超选择性栓塞很重要下图,显示了有利和不利的TACE示例。
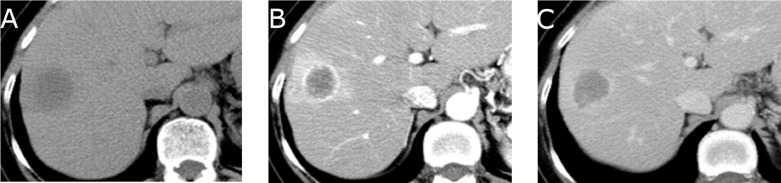
 |
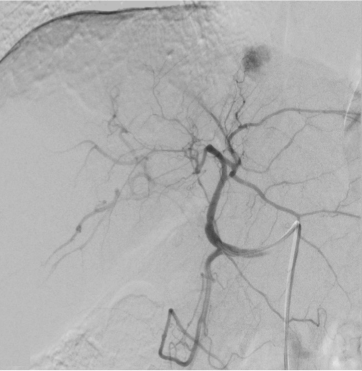 |
| 寄生肿瘤供血动脉导致选择性动脉栓塞复杂化 | 提供TACE良好血管供血,使2段血管栓塞成为可能 |
肿瘤侵袭性的一个重要指标是生长方式。与结节性肿瘤生长且与周围肝实质边界清楚的患者相比,浸润性肿瘤生长与TACE缓解和术后中位OS下降相关【Benvegnu 2001;Kneuertz PJ, 2012;Yang CF】
TACE治疗预后相关因素
 |
总结
- 仅仅2/3有典型HCC特征(Not otherwise-specified NOS-HCC)
- 其余1/3 有8个亚型
- 不同的影像学表现
- 不同的预后
- 我们并不清楚这些对于TACE来说意味着什么
- SMARS评分
- 以个性化的方法开始TACE
- 我们是否需要更多的活检