甲状腺乳头状癌(PTC)的诊断在过去几十年中变化较大,这是由于颈部成像技术的广泛应用,超声(US)引导下的细针穿刺活检(FNA)的常规使用,以及分化甲状腺肿瘤发病率的实际增加【Mcleod 2019】。这些癌症中几乎一半的大小在10mm以下,生长缓慢,通常是偶然发现的,分化性甲状腺癌(differentiated thyroid tumors)预后良好。这些肿瘤大多为低风险乳头状甲状腺癌(PTC),缺乏侵袭性组织学特征,如甲状腺外扩散,淋巴结或远处转移,以及令人担忧的突变。这些极低风险的癌症在文献中通常被称为甲状腺乳头状微癌(PTMC),尽管2022年WHO的分类并未将其视为独特的病理情况【Baloch 2022】。
目前,有强有力的证据支持一种相对简约的方法来管理原发性甲状腺乳头状癌(PTMC)。
1. 传统上单灶性PTMC的推荐手术治疗是甲状腺叶-峡部切除术, 2. 但主动监测(AS)越来越多地被提议作为一种替代治疗选择。在不同国家的甲状腺中心进行的几项长期研究表明,在没有立即干预的情况下进行临床和超声监测是安全的【Jeon MJ 2019 Tuttle RM 2017 Oh HS 2018 Oda J 2016 Molinaro E 2020】。 3. 最近,第三种治疗方案被提出,以防止临床低风险的肿瘤过度治疗的风险,目前正在全球范围内进行试验【Mauri 2021】。在超声的引导下进行的微创治疗(MIT)已被确定为治疗有症状的良性甲状腺结节的有效和安全的治疗工具【Papini E 2020 Orloff LA 2022 Sinclair CF 2023 Kim JH 2018】。由于不需要住院、全身麻醉,也不会导致甲状腺功能丧失或外观损害,目前也被认为是治疗PTMC的一种可能的非手术治疗方法【Papini E 2020 Sinclair CF 2023 Kim JH 2018 Durante C 2023】。在过去的10年里,一些临床研究表明,热消融-无论是激光(LTA),射频(RFA)还是微波(MWA)设备-都可以用于选择性地消融直径达10毫米的PTMC。因此,对于这些典型的惰性肿瘤,选择最合适的治疗方法——监测、热消融或手术——需要对个人需求、临床情况和偏好进行彻底的评估。
本栏目的目的是评估微创手术治疗PTMC效果的证据水平,以评估这些创新技术与手术和AS相比的优势和局限性,并确定其在当前临床实践中的作用。
消融方法
微创治疗相对于手术的优势
|
 |
|
下一步? 1.主动监测(Active surveillance)? 2.外科? 3.消融? |
Minimally Thyroid Treatment (MIT)in thyroid cancer
 |
|
推荐1
考虑在甲状腺癌患者的多模式入路中使用图像引导的MITs。
推荐强度1;
证据 low ØØOO。【Durante 2023】
评委高度一致( 11/11,100%)
|
| 证据分级 high (ØØØØ), moderate (ØØØO), low (ØØOO), or very low (ØOOO)【Durante 2023】 |
|
推荐6
告知偶然发现的PTMC适合AS(active surveillance)的患者,甲状腺消融作为立即手术或AS之间的治疗第三选择。
推荐强度1*,证据。very low (ØOOO)
专家高度一致(11/11,100%)
|
尽管证据低或者非常低,但推荐意见确非常一致
通常有不适合微创治疗甲状腺结节(危险的位置,怀疑包膜受侵,怀疑淋巴结转移)
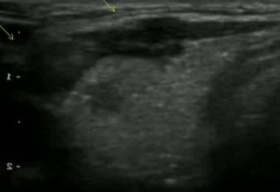
病例,44F 主动监测(wait and see)2年后,要求做甲状腺微创治疗。两次献血穿刺,一次发现包膜侵犯,确定外科治疗
 |
 |
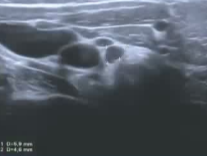 |
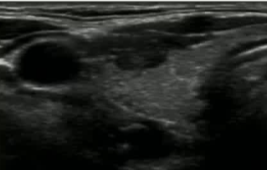
治愈性病例
39F PTMC 拒绝 手术和主动监测
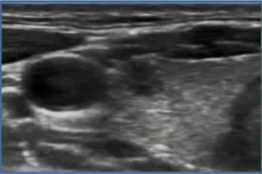 |
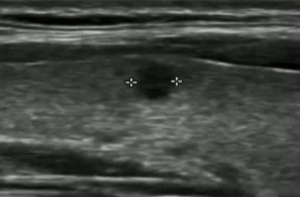 |
| 3 x 3mm |
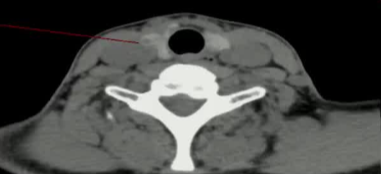 |
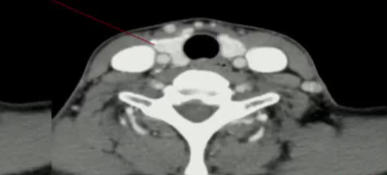 |
 |
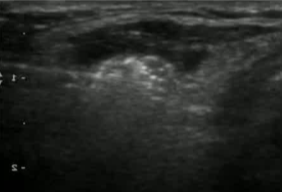 |
| RFA 0.5CM 电极 | 10w 5分45秒 |
 |
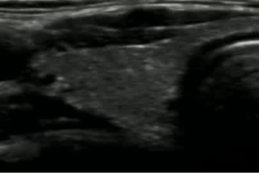 |
| 4月随访 | 18个随访 |
《热消融治疗甲状腺乳头状微癌:进展如何?》 重庆医科大学二附属医院 乳腺甲状腺外科
 |
《热消融技术治疗原发性甲状腺乳头状微癌的有效性和安全性:系统回顾和荟萃分析》【Choi Y 2020】
.
超声引导下的热消融治疗良性甲状腺结节已在世界范围内成功应用,根据文献资料,热消融也可以安全有效地用于治疗低风险的PTMC。
甲状腺消融可以为不能手术或拒绝手术的患者提供另一种选择。
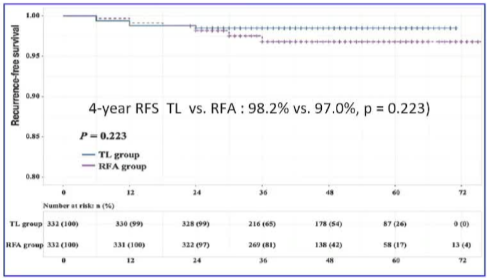 |
|
并发症 射频消融没有发生并发症 甲状腺叶切除 4.5%(15/332)p<0.001 - 1例 0.3% 发热 - 12例 暂时性喉返神经损伤 - 2 暂时性甲状旁腺功能低下 |
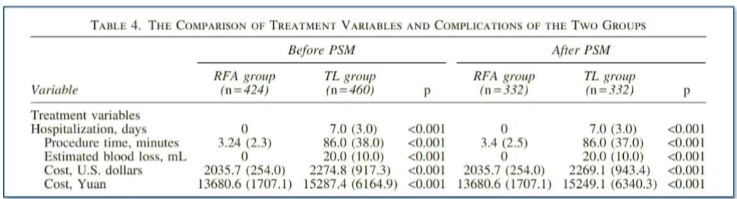 |
|
RFA手术时间短,估计失血量少,住院时间短,费用低。
|
荟萃分析

13项研究
1088例
所有文章偏倚风险低
没有显著性差异
- 复发率(OR=0.8,95% CI:0.37 to 1.77 p=0.59)
- 淋巴结转移 (OR=0.71, 95% CI:0.26 to 1.95;p=0.51)
MWA组手术时间短,术中出血量小,手术切口小,术后住院时间短,住院费用低,并发症少
虽然消融技术在治疗良性结节方面是有效的,需要进行许多研究来确定它们之间的优越性。
灰色区域
关于MITs作为PTMC一线治疗方案的作用的结束性定义仍有局限性,应在未来的试验中具体解决:
肿瘤消融的完整性
组织学上对恶性组织完全消融的确认是基于很少的病例和小样本系列的患者,这些患者在MITs后因不相关的原因接受了甲状腺切除术【Valcavi R 2013 Tong M 2019】。只有少数论文报道了常规使用FNA或粗针穿刺活检(CNB)来排除治疗区域存活的肿瘤细胞【Papini E 2024】。一项回顾性队列研究,通过长期US随访和CNB对消融区域的系统评估提供了令人安心的信息【Li 2023】]。相反,在MIT的大多数研究中,不能肯定地排除不完全消融的风险,这些研究仅使用超声的评估来评估临床结果。这个问题至关重要,因为在PTMC的治疗中,与AS相比,MITs的主要优势是根除任何存活的肿瘤细胞。以下因素进一步加剧了实现肿瘤完全消融的挑战。
- 首先,几乎所有现有的系列研究都包括了相关数量的非常小的(直径≤5 mm) PTMC(表3)。由于需要在PTMC周长【Mauri 2021】周围进行2 mm的环周安全切缘消融,因此肿瘤学上的不完全消融风险随着肿瘤大小的增加而迅速增加,因此对于接近10 mm的肿瘤而言,风险要大得多。
- 其次,PTMC位于难以治疗的区域(靠近气管、大血管或喉神经走行),即使进行了良好的水剥离,也可能妨碍消融的根治性。
= 第三,在不完全消融的情况下,MIT引起的超声改变可能会阻碍治疗后的PTMC的持续或复发【Wu 2024】。
并发症的风险。
目前尚缺乏比较MITs和甲状腺叶切除术的头对头随机前瞻性研究。目前的证据主要是基于对非随机入组后的两个患者队列进行比较的回顾性研究(Papini E 2024)。除了这一方法学上的局限性,现有的大多数研究还比较了采用不同技术和不同方式进行的热消融与甲状腺叶切除术、甲状腺全切除术或甲状腺切除术联合中央区切除术。与最广泛的手术方案相比,MITs在并发症方面的差异最显著,更有利于MITs,但与甲状腺叶切除术相比,差异减小,甲状腺叶切除术是目前治疗单灶癌的推荐选择。
生活质量。
预计手术干预会对生活质量产生负面影响。MIT手术的耐受性可能更好。然而,比较这三种治疗方式对患者围手术期和长期生活质量影响的对照研究,以及经过验证且国际上接受的问卷,仍然很少。
长期的监测。
手术可排除患侧甲状腺叶的肿瘤复发风险,并提供关于肿瘤多灶性、腺外侵犯、侵袭性组织学或有临床意义的淋巴结受累的准确信息。如果缺乏这些确定复发风险的确切数据,则热消融后需要进行类似于AS的长期但不强化的临床和超声随访。
目前只有少数中心提供治疗PTMC的MIT,大多数国家没有特定的培训课程和可认证的培训证书。
热消融治疗低危PTMC是一种有前景的非手术治疗方法。微创治疗为根除这些常见恶性肿瘤提供了一种快速、安全、经济的方法。然而,关于组织学证实的肿瘤消融术的完整性以及与主动监测相比的长期临床优势,目前仍缺乏来自实施良好的前瞻性研究的结统性数据。
目前,在大的的甲状腺中心,对于不适合手术或拒绝手术的PTMC患者,应考虑MIT,但仍在寻求治疗,以降低其恶性肿瘤随时间推移进行性生长或腺外扩散的风险。
甲状腺叶切除术、热消融和主动监测这三种可用的治疗方案应始终以跨学科的方式进行讨论。该讨论不仅应基于初步临床和超声分期,还应基于患者的偏好、可用资源和当地专业知识。
接受MIT治疗的PTMC患者应充分了解该手术的优势和局限性。由于目前证据级别尚不完全,仍需长期的临床及超声随访。