肝癌,更具体地说是肝细胞癌(HCC),是癌症相关死亡的第二大原因,其发病率在全球范围内呈上升趋势,到2025年肝癌的估计发病率>100万。HCC依然是全球健康的挑战。大约50%的HCC患者接受全身治疗,在过去传统的一线治疗是索拉非尼或lenvatinib,但靶免组合的一线治疗逐渐浮出水面,代表药物是T+A的组合,同样一线治疗耐受的情况下,二线治疗是Regorafenib(瑞戈非尼)、Cabozantinib(卡博替尼)或Ramucirumab(雷莫芦单抗)。在过去的5年里,免疫检查点抑制剂已经彻底改变了肝癌的治疗。与索拉非尼相比,atezolizumab(阿替利珠单抗)和贝伐单抗联合治疗(T+A)已被证明可以提高总生存率,因此FDA批准了该方案。
最近,durvalumab(德瓦鲁单抗) + tremelimumab(曲美木单抗) 的总生存期优于sorafenib(索拉非尼)和atezolizumab(阿替丽珠单抗) + cabozantinib(卡博替尼)的无进展生存期。此外,基于早期疗效数据,pembrolizumab(派姆单抗)单药治疗和nivolumab(纳武单抗) + ipilimumab(伊匹单抗)联合治疗已获得FDA加速批准,用于二线治疗。尽管取得了这些重大进展,但控制免疫反应和逃避的分子基础仍不清楚。
免疫微环境在HCC的发生和发展中起着至关重要的作用,并且已经确定了不同的病因依赖性免疫特征。炎症和非炎症类型的HCC和基因组特征与免疫检查点抑制剂的反应有关,但没有有效的生物标志物可用于指导临床决策。本栏目试图描述目前来自III期临床试验的证据,包括疗效、免疫相关不良事件和依赖病因的反应机制(aetiology-dependent mechanisms)。最后,还要讨论了评估HCC所有阶段的免疫疗法的新试验,这些试验可能在不久的将来改变这种疾病的管理。
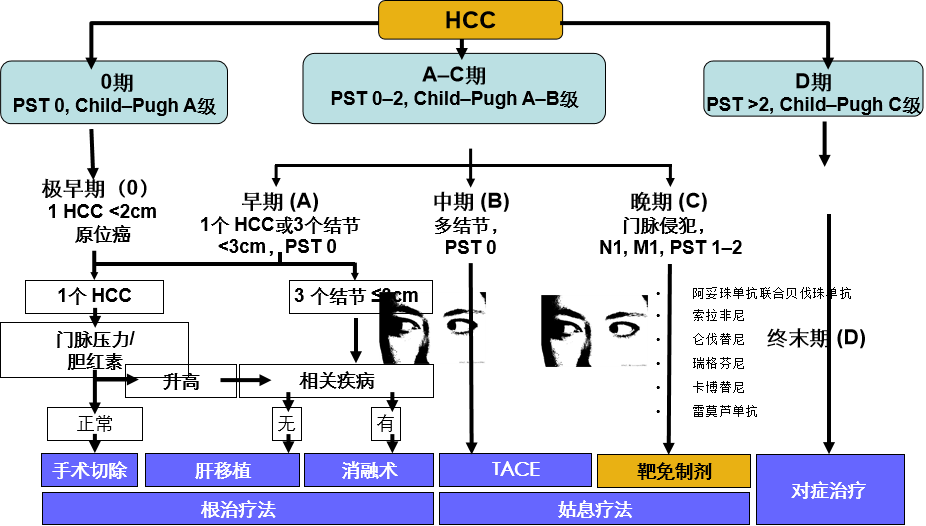
多血管供血是HCC的一个标志,已被应用于栓塞颗粒的输送、局部化疗和放射治疗。随着有效的全身治疗的出现,我们看到了经动脉治疗与全身治疗相结合(下图)或将全身治疗作为对照的试验的演变。 局部治疗联合免疫治疗原理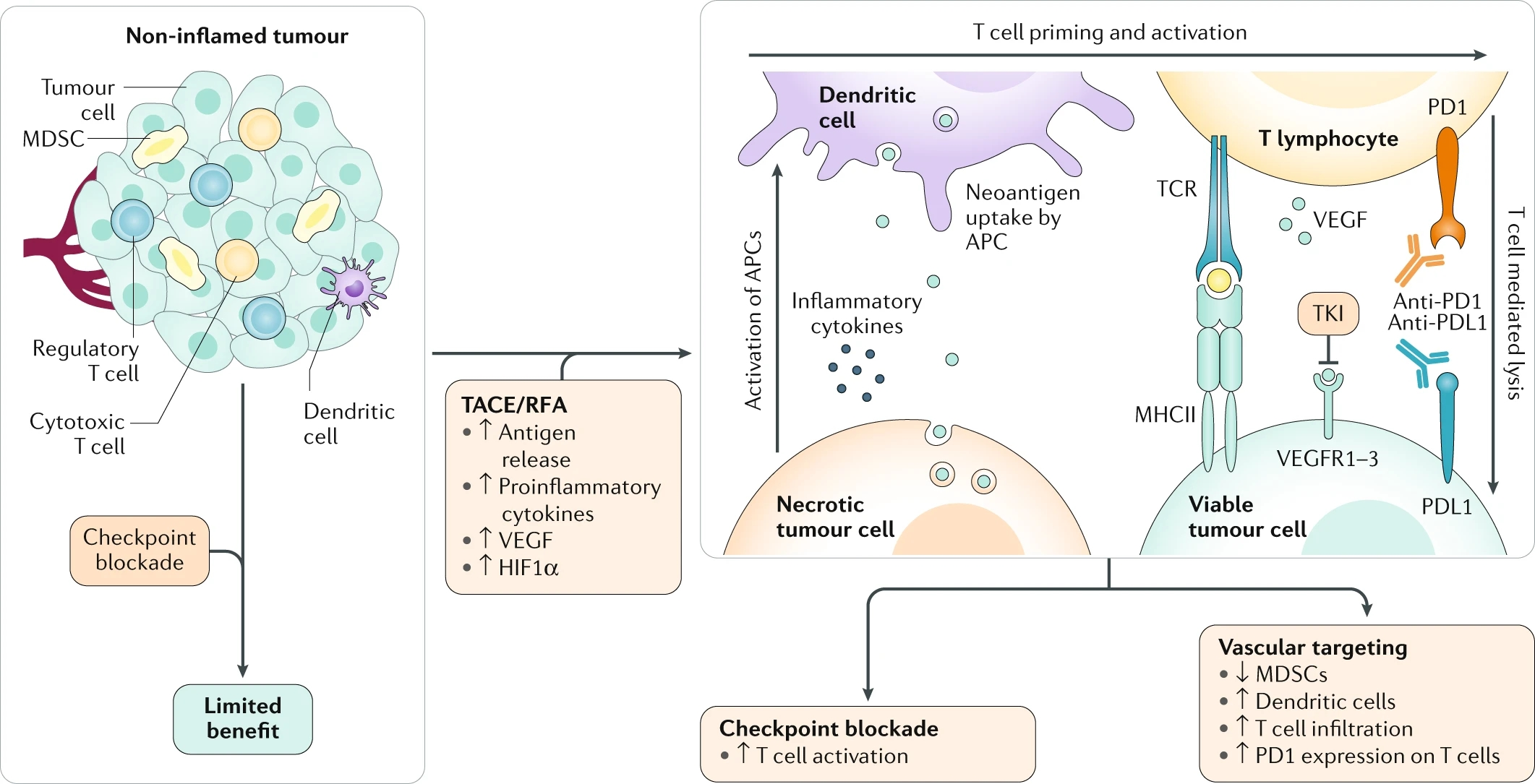 肿瘤新抗原的释放 树突细胞招募和激活 T细胞致敏和激活 TACE 为什么要与免疫治疗联合?对于中期HCC(BCLC-B), TACE作为治疗标准已经有15年了,而d-TACE等技术的发展,尽管提高了安全性,但对临床结果并无显著影响。15年来,各种TACE技术的进步,并没有带来突破性的进展,换句话说TACE处于一个停滞不前的状态。为了改善肝癌治疗的结果,TACE+靶向治疗并没有带来有意义的结果,自然也想到了免疫治疗。 根据BCLC 晚期(C期)HCC患者中应用免疫检查点抑制剂的研究结果的基础上,一些研究小组已经开始在BCLC早期(A期)和中期(B期)疾病患者中单独应用免疫检查点抑制剂或联合局部治疗【Greten 2019】。 肝癌靶免治疗从右到左
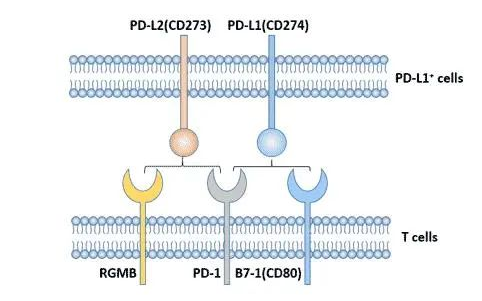
抗PD1 (nivolumab, pembrolizumab, nivolumab + ipilimumab) 和抗 PDL1 (atezolizumab,联合bevacizumab,一种抗VEGF药物)疗法已获得FDA批准用于晚期HCC【Gabriela Hernandez-Meza 2021】。 目前, 抗 PD1 (nivolumab, pembrolizumab, nivolumab plus ipilimumab) 和抗PDL1 (atezolizumab,联合 bevacizumab, 一种抗VEGF药物)治疗已经接受FDA批准治疗晚期癌症【Gabriela Hernandez-Meza 2021】 目前尚不清楚抗PD-1抗体是否比抗PDL-1抗体更有效。理论上,人们会假设抗PD1抗体可以阻断PD1与其配体(PDL1和PDL2) 的结合,而PDL1抗体只会抑制PD1与PDL1的结合,因此效果较差。
一项涉及11379名癌症患者的19项随机对照试验的荟萃分析显示,与抗PDL1治疗的患者相比,抗PD1治疗的患者的总生存期在统计学上有显著提高,虽然这项研究不包括HCC患者【Jianchun Duan 2020】。 One meta-analysis of 19 RCTs involving 11,379 patients with cancer revealed a statistically significantly greater overall survival for patients treated with anti-PD1 when compared with patients treated with anti-PDL1, but this study did not include patients with HCC168.
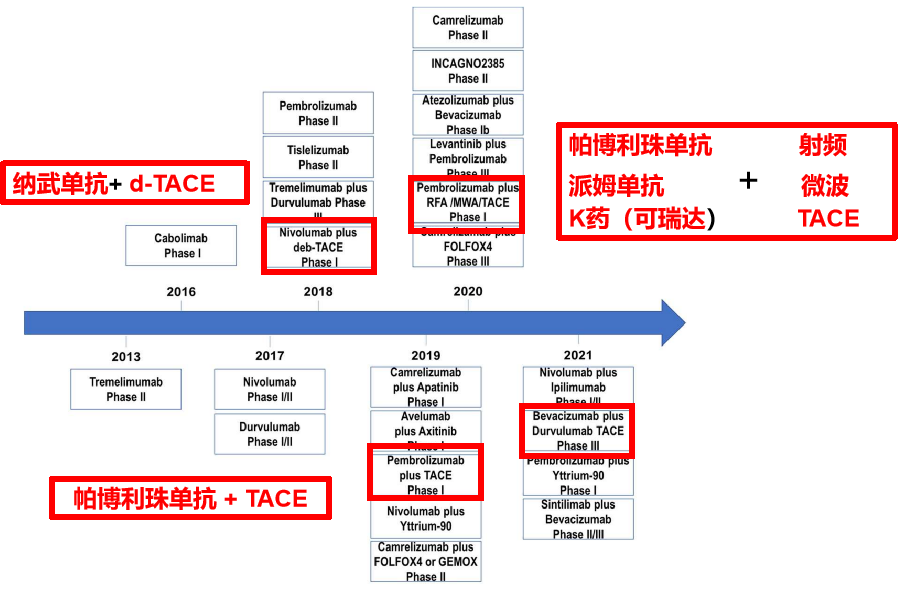 免疫检查点抑制剂在辅助治疗和新辅助治疗中都进行了测试,以解决不同的问题。 Immune checkpoint inhibitors are tested in both the adjuvant and the neoadjuvant setting, addressing different questions. 免疫检查点抑制剂对肿瘤负荷低的患者更有效吗? Are immune checkpoint inhibitors more effective in patients with low tumour burden? 辅助免疫检查点抑制剂能否改善RFA治疗后患者的预后(NCT03847428)? Can adjuvant immune checkpoint inhibitors improve outcome in patients after RFA therapy (NCT03847428)? 使用血管靶向药物的联合治疗是否更好,如贝伐单抗,索拉非尼或 lenvatinib (NCT03847428, NCT04150744)? Is it better to use a combination therapy with a vascular targeting agent, such as bevacizumab, sorafenib or lenvatinib (NCT03847428, NCT04150744)? 消融前新辅助入路的效果如何(NCT03337841, NCT03753659)? What is the effect of a neoadjuvant approach before ablation (NCT03337841, NCT03753659)? 最后,是否有可能使用免疫检查点抑制剂和不太常用的消融技术来治疗直径为3厘米的肿瘤患者(NCT03630640)? Finally, is it possible to use immune checkpoint inhibitors with less commonly used ablative techniques to treat patients with tumours >3 cm diameter in a curative intent (NCT03630640)? 乍一看,这些概念中的大多数可能与目前正在接受手术切除的患者中研究的概念非常相似,但在接受消融的患者中观察到一些在接受手术切除的患者中未见的免疫效应169。 At first look most of these concepts might appear very similar to those currently being investigated in patients undergoing surgical resection, but a number of immunological effects are observed in patients undergoing ablation that are not seen in patients undergoing resection169. 以下为TACE+靶向治疗
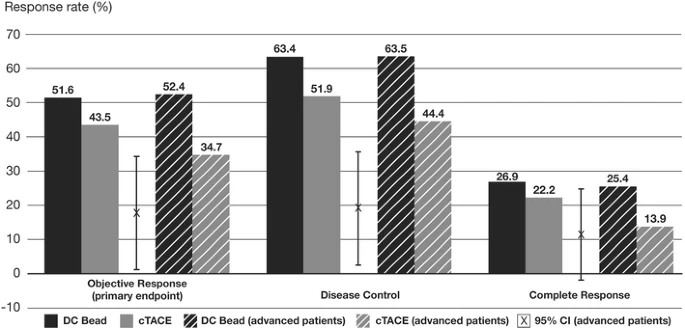
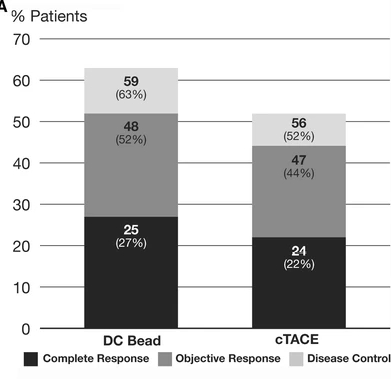
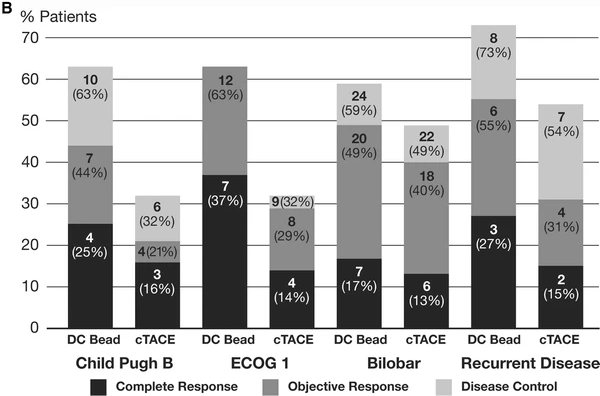
PREVISION V 的研究是第一项国际多中心随机研究,旨在评估药物洗脱微球(DC-bead)与cTACE治疗HCC的安全性和有效性。在本研究中,采用DC Bead的TACE术后6个月的OR率为52%,与之前报道的I/II期研究中采用DC Bead的OR率为44-82%相比较【María Varela 2007;Ronnie T P Poon 2007;Joachim Kettenbach 2008;Sally Hopewell 2009】。虽然在本研究中,与cTACE相比,无法证明在OR率方面的统计学优势,但在所有类别(完全缓解、OR和疾病控制)中,观察到DC Bead比cTACE有更高的缓解率趋势。特别值得注意的是,尽管给予的平均总剂量较高,但DC Bead显著降低了严重的肝毒性和阿霉素副作用,使医生能够安全地提供比cTACE更高剂量的阿霉素。 事实上,报告结果的差异很大程度上是由于患者的人口统计学和选择【L. Kadalayil 2013;Imam Waked 2017】。因此,人们寻求其他策略来改善结果。抗血管生成药物 (包括TKIs或 VEGF抗体) 可能延缓TACE后肿瘤血运重建和复发的假设已经在一些随机对照试验中得到了结果。 设计这样的试验的挑战是很多的【Gabriela Hernandez-Meza 2021】。 首先,TACE不是一种标准化的技术,适应症和结果受包括颗粒类型和大小、化疗、使用碘油、时间表和选择性程度等变量的影响194。TACE2【Tim Meyer 2017】和SPACE【Riccardo Lencioni 2016】试验试图通过使用DEB-TACE来减少技术变异性,但在其余临床试验中,常规TACE与一系列不同的颗粒和细胞毒性药物一起使用。除SPACE外,大多数研究都通过允许按需重复操作来总结临床实践,结果是试验组和控制组之间的治疗次数和间隔都有所不同。 第二,在终点问题上没有达成共识。在几项研究中,常规终点如总生存期、PFS和TTP被用作主要终点【Tim Meyer 2017;Riccardo Lencioni 2016】,但阴性结局引起了人们的担忧,认为它们不能充分定义TACE失败。 因此,具体的终点,如时间到不可控制的进展,有积极和消极的结果【Riccardo Lencioni 2016】。各种新的次要终点也被开发出来,包括PFS的修改,如TACE进展的时间,包括TACE进展和死亡,以及血管侵犯或肝外扩散的时间【Gabriela Hernandez-Meza 2021】。共识声明更新了试验设计和终点,PFS(无进展生存期)可以作为生存率之外疗效判定的结果使用,以捕捉RCT中后续治疗可能掩盖的益处【Gabriela Hernandez-Meza 2021】。然而,在这种情况下,将PFS作为主要终点的限制性规则需要进一步制定,并且不能从系统治疗RCT的分析中直接推断,在该RCT中,风险比阈值为<0.6与生存期17,195的影响相关【Gabriela Hernandez-Meza 2021;Josep M Llovet 2019】。 尽管方法和终点有不同,但这些试验包括分子靶向药物联合TACE都没有提供令人信服的临床有意义的优于单独TACE的证据。
两项试验评估了索拉非尼联合DEB-TACE,但未能达到各自的主要终点PFS和TTP【L Kadalayil 2013;Riccardo Lencioni 2016】 同样,常规TACE联合BRIVANIB (VEGFR抑制剂)【Masatoshi Kudo 2014】或Orantinib(多靶点的受体酪氨酸激酶抑制剂)【Kudo 2017】等TKIs也未能达到总生存期的主要终点。其他TTP阴性试验仅在先前证实TACE疗效的患者中探索了TACE +索拉非尼(在本研究中,一两次手术后肿瘤缩小≥25%)116。TACE也在晚期HCC的治疗中进行了评估,其中联合索拉非尼与单独索拉非尼的总生存期主要终点试验结果为阴性122。 |