细胞学穿刺活检有时会应用到进行快速现场评估,在盐水封针的情况下用细针经引导针获取细胞学样本。等待FNA样本的评估,然后再进行组织核心。如果细胞病理学评估为“非诊断性”,将同轴引导针重新定位到更可能产生活细胞的区域。如果FNA样本仍然无法诊断,继续进行组织岩心检查,但也会将抽吸物送到微生物室,即使最初没有怀疑感染。 CT引导下经皮肺活检是肺结节诊断策略的重要组成部分。此外,由于靶向治疗的可用性,对标本的基因突变研究已经变得和癌症诊断一样重要。究竟21G细针抽吸细胞学活检(FNAB)在:
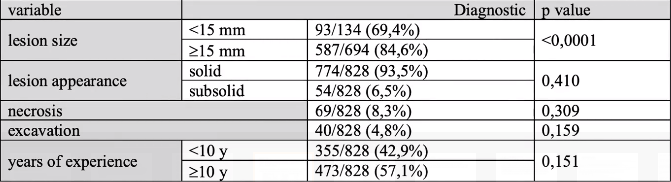
- 诊断结果在统计学上对≥15mm病变更为经常(p<0,0001), - 在134个<15mm 病变中有93个 (69.4%)和587/694个(84.6%)的病变2≥5mm 被诊断出来。 实性/亚实性方面(p=0,410),不存在空腔(p=0,159)或坏死(p=0,309) 影响活检的诊断结果。
FNFB并发症
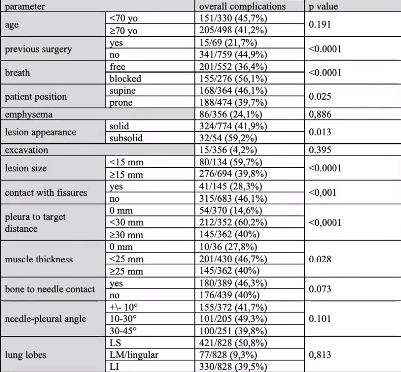
并发症和严重的并发症低发生率使该技术成为经常受到合并症的影响肺部肿瘤患者的理想选择。43%的患者发生并发症 ( 严重患者住院:5.7% ),其结果与:既往手术/放疗、体位、呼吸、病灶大小/外观/深度、叶间裂/骨接触、肌肉厚度和放射科医生的经验有关。
引用已故沃尔特·克朗凯特(Walter Cronkite)的话:“在寻求真理时,你必须了解一个故事的两面。”
当细针穿刺(FNA)与核心活检作为经皮肺活检的采样方式选择的问题时,这种观点当然是正确的。如果一定要有一个论点的话,那么双方的观点都有道理。作为一名细胞病理学家和肺外科病理学家,Paul A 希望为放射学界提供关于FNA在诊断和肺部病变下游辅助检测方面的特殊优势 (超出了FNA在出血和气胸方面的潜在有益风险配置)的观点【Paul A 2022】。
在这样的争论中,人们倾向于笼统地陈述一种情态相对于另一种情态的优劣,尽管实际情况要复杂得多。这种复杂性始于目标肺部病变的特征。一方面,可能由感染或炎症引起的模糊实质实变或磨玻璃样影可能不是进行经胸FNA的最佳理由,因为核心活检提供了更多的结构线索,可能有助于确诊,如组织性肺炎或分化良好的鳞状样腺癌。相反,当目标病变是一个实性或部分实性肿块,具有很高的恶性肿瘤预测概率时,FNA优先方法确实很有效。
从肺癌的纯粹诊断角度来看,研究表明两种方法的诊断准确性相当,特别是当细胞学标本由训练有素和经验丰富的细胞病理学家【VanderLaa 2016】进行评估时。也许更重要的是,在当代实践中,建立诊断只是病理学家的第一个目标,FNA提供了独特的优势,值得讨论。
首先,经胸FNA为促进细胞学快速现场评估(ROSE)提供了理想的采样方式。类似于外科病理中的术中冷冻切片诊断,ROSE有助于提供病变的初步印象,这对于根据细胞学结果立即对材料进行分类非常有用。这种分类包括
1. 当怀疑感染过程时分配微生物培养材料 2. 当确定淋巴细胞增殖过程时分配新鲜材料用于流式细胞术,或者 3. 当发现恶性肿瘤时分配专门用于辅助分子检测的额外通道。 诚然,核心活检的印片准备(touch preparation)也可以用于类似的目的,如美国病理学家学院(CAP)最近的指南建议,用于辅助研究的胸椎小活检和细胞学标本的收集和处理【Roy-Chowdhuri S 2020】; Touch preparation:取干净的载玻片在断面处轻轻接触,制成印片(touch preparation)。室温晾干后,入甲醇:乙酸液(3∶1)室温固定20min(引自 Bing) 然而,核心活检有局限性。尽管核心活检的印片制备和FNA涂片之间可能存在细微的细胞形态学差异,但这对大多数肺癌来说并不构成挑战。尽管如此,为了与热力学第一定律 (即在封闭系统中,能量可以从一种形式转换为另一种形式,但既不会产生也不会破坏) 进行类比,在核心活检和相应的准备之间分布的细胞物质的数量是零和游戏。换句话说,随着更多的材料从核心活检组织转移到用于ROSE的印片准备载玻片上,用于诊断或辅助测试目的的核心材料就更少了。事实上,核心活检组织在切片上拖拽的程度和活力与相应肺核心活检组织【 Rekhtman N 2014】中损失的细胞和DNA物质的数量成正比。此外,与其他组织类型【Tong 2014】相比,肺核心活检更容易通过印片制备诊断细胞丢失。因此,如果在ROSE期间使用核心活检进行印片准备,应至少获得额外的后续核心,以确保手术病理活检标本中有足够的肿瘤细胞。
经胸FNA的第二个亮点是肺结节的下游辅助和分子检测。除了在ROSE过程中制备的直接涂片外,还可以收集来自细针通道的其他标本,并在细胞学实验室中作为福尔马林固定石蜡包埋(FFPE)细胞块进行处理。这些细胞块可以与传统的FFPE核心活检材料一样用于诊断测试(例如,免疫组织化学染色来表征肿瘤或评估程序性细胞死亡配体1状态)和分子测试。后者已成为肺癌管理的首要因素,因为肿瘤治疗决策在很大程度上依赖于识别可靶向的基因组改变。事实上,CAP指南对胸部小活检和细胞学标本的收集和处理建议执行
|