| 使用直径校准微粒技术的经导管动脉栓塞(TAE)代表了影像引导下治疗的发展中的一个非常成功的阶段。自21世纪初首次引入以来,具有均匀和可预测形状的栓塞颗粒的出现使颗粒能够穿透更远端和完整。 这些不同大小的新颗粒可以有系统地选择并用于治疗从前列腺增生到肝细胞癌(HCC)的各种情况。粒径校准校准的栓塞微粒机械地超选择性地阻断目标血管系统内的血流。 目前正在努力利用这种精确度来更准确地提供新的治疗药物,并开发可生物降解的栓塞颗粒。这种多功能性使使栓塞微粒功能强大,因为它们灵活的设计适用于非常多的临床场景,如启动实体肿瘤以提高对免疫治疗的临床反应。 栓塞微粒(bead)性能和局限性
微粒栓塞技术的发展是基于经动脉导管介入手术的应用不断扩大。早期的栓塞材料,包括自体血凝块和明胶海绵,被证明有助于治疗急性出血【Eckstein 1984】。然而,早期的栓塞材料直径较大缺乏到末梢血管必要的大小,而较小直径的栓塞微粒是肿瘤选择性消融栓塞必要条件。此外,由于其大小和形状不可预测,它们具有很高的非靶标栓塞风险,栓塞水平不宜控制。
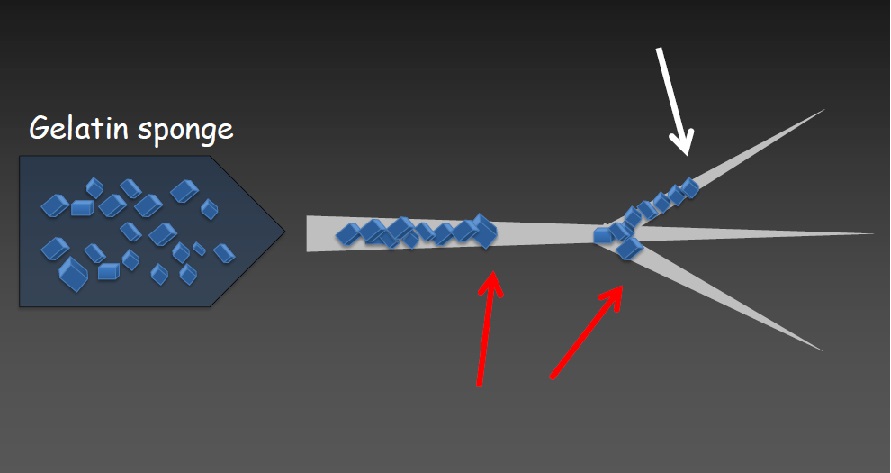
动脉血有氧气体交换发生在远端微血管系统,其中小动脉和毛细血管范围为10-30µm。即使是最佳的栓塞技术也经常导致更近端血管闭塞(直径40µm)。
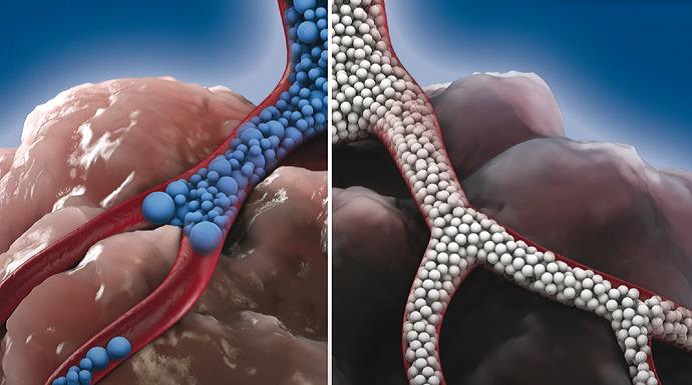
近端栓塞的结果导致组织灌注通过侧支循环形成新的持续性动脉灌注。Johnson 等人在兔肿瘤模型中定量了残留灌注。用100-300µm的微粒栓塞肿瘤,研究表明这也只能阻止56%的肿瘤微血管系统的血流【Johnson 2016】。 栓塞微粒到组织末梢血管与接近组织末梢血管的主要区别在于后者会形成新微血管灌注的发展。通过评估不同大小的珠子(40-60µm vs 70-150µm) 栓塞后肿瘤微血管的缺氧程度,证实了这些发现。较小的微粒深入肿瘤微血管网,减少通过侧支动脉进行残余灌注的可能性,从而导致更明显的坏死【Cirtes 2022】。当使用直径较大微粒进行靶血管栓塞时,残余的灌注可以使缺氧的肿瘤细胞持续存活。因此,直径校准微粒(即颗粒)的改进是必要的,并允许为血管和内脏肿瘤介入量身定制栓塞,包括载药微球和放射性微粒的栓塞。 栓塞微粒治疗方法的研究进展
聚乙烯醇(PVA)颗粒自20世纪70年代以来一直被用于栓塞,并作为一种可靠和经济有效的栓塞剂迅速流行起来。PVA是可压缩的,但在导管输送后可以扩张【Laurent 2007】。PVA的早期迭代缺乏均匀的大小分布,直径在100到1100µm之间。
使用小的PVA颗粒需注意导致正常组织缺血。干粉PVA应该与造影剂和盐水制成悬浊液。利用三通开关的抽吸保持悬浊液的均匀状态。稀释可以减少凝聚现象
这些栓塞剂被提炼成小的、校准的PVA(Contour embolization PVA particles, Boston Scientific Corporation)。
栓塞颗粒的另一个突破来自三丙烯酸明胶微球(TAGM)(Embosphere microspheres, Merit Medical Systems)。Embosphere是带有明胶涂层的丙烯酰胺单体的聚合物。这些精确校准的粒子携带阳离子电荷,这使它们具有亲水性并抵抗聚集。
通常,这些注射前颗粒悬浮在碘造影剂和生理盐水中,校准尺寸为40到1200µm。5与TAGM相比,临床前子宫动脉栓塞(UAE)的非均匀PVA颗粒具有更高的近端和远端聚集率。使用尺寸匹配的球形PVA颗粒导致了相似的即时技术成功率,但在术后3个月成像中显示出明显更高的不完全反应率。与TAGM相比,PVA的可压缩性较高,导致了次优响应,这可能导致变形变化和非目标再分配。7 | |||||||||||||||||||||