除了肿瘤患者的宿主因素和肝切除的选择相关。肿瘤因素也深深地影响结直肠癌肝转移肝切除的手术的选择。这里包括肿瘤的解剖位置,肿瘤的病理和肿瘤的生物学特征。
肿瘤生物学是预测患者复发和生存情况的最重要因素之一。现已研发出基于临床病理特征的预后预测工具,用于确定患者行切除术后的复发风险、是否适合手术和是否能从新辅助化疗中获益。在现代,患者通常在切除术之前和/或之后接受化疗,因而这种评估非常必要。
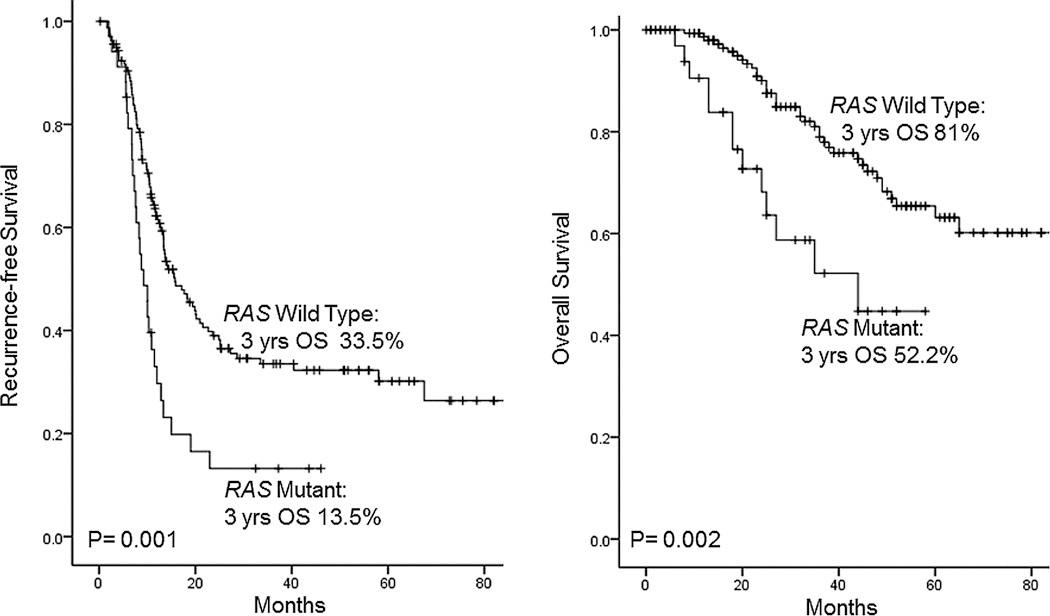
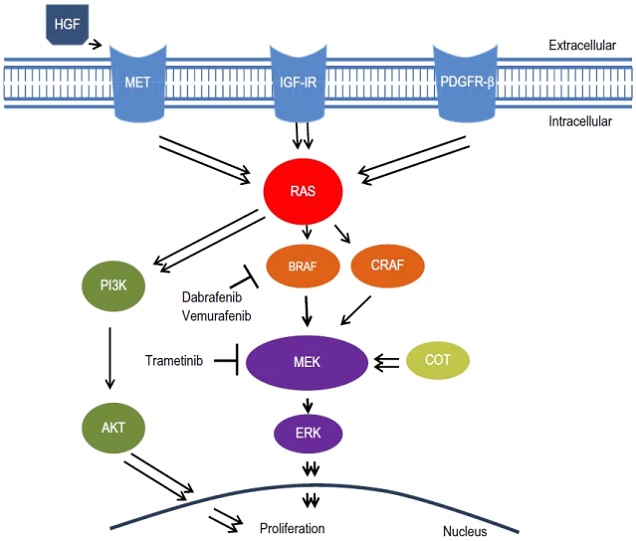
RAS癌基因信号通路是调控细胞信号转导的重要通路,RAS基因突变是结直肠肿瘤发生的早期步骤。因此,RAS突变与预后不良相关,RAS突变型肿瘤患者在CRLM切除术后的复发率更高,OS更低,切缘阳性率更高。RAS突变对转移灶切除术患者手术切缘宽度的影响如上文所述。
例如,一项回顾性研究纳入了421例因CRLM接受肝切除术的患者,其中44%的患者有RAS突变【Amikura K et al 2018】。有RAS突变是OS(HR 1.67,P=0.0031)和DFS(HR 1.70,P=0.0024)较低的危险因素。(大约一半的CLM患者可能患有RAS突变。无论是否使用抗EGFR抗体治疗,RAS突变的CLM患者的生存率明显低于RAS野生型患者)
虽然RAS突变通常与肿瘤的生物学侵袭性更高相关,患者的生存率也因此更低【Vauthey JN 2013】,但其预后意义似乎因转移灶的具体位置不同而存在差异。一项研究纳入了193例化疗后行CRLM切除的患者,发现RAS突变与早期肺部复发有关,但与肝脏复发无关【Vauthey JN 2013】。另一项研究中,720例CRC患者接受了肝、肺或腹膜转移灶切除术。RAS突变型肿瘤患者肝切除术后的OS显著较低,但在肺或腹膜转移灶切除术后未见此现象【Passot G 2018】。
Long-term Survival and Predictors of Outcomes
最后,RAS突变的影响可能也因RAS基因的具体突变而异。一项研究评估了165例CRLM切除术患者的KRAS和NRAS突变,发现外显子4突变患者往往在较长无病期后出现大的单发转移灶,而外显子3突变患者的病变往往更小、数量更多[【Frankel TL 2017】外,与野生型RAS或其他RAS突变(如外显子2突变)相比,外显子4突变患者的复发率更低,OS更长。
目前采用的4种临床风险评分(clinical risk score, CRS)系统是基于复发风险对患者进行分层。可考虑对高风险患者行初始化疗,以便在切除术前评估肿瘤生物学,即化疗期间发生快速进展的肝外转移患者可以避免不必要的手术。一项研究表明,对于切除术前未接受初始化疗的患者,除Konopke评分外,其余评分均与无病生存率(disease-free survival, DFS)相关,但只有Nagashima评分可以预测OS。对于切除术前接受了化疗的患者,除Konopke评分外,其余评分均可预测DFS和OS【Wimmer K 2017】。不幸的是,这些评分系统均不能预测疾病特异性生存率,尤其是5年后。在临床实践中,这些工具最常用于与患者讨论结局及做出治疗决策【Roberts KJ 2014】。
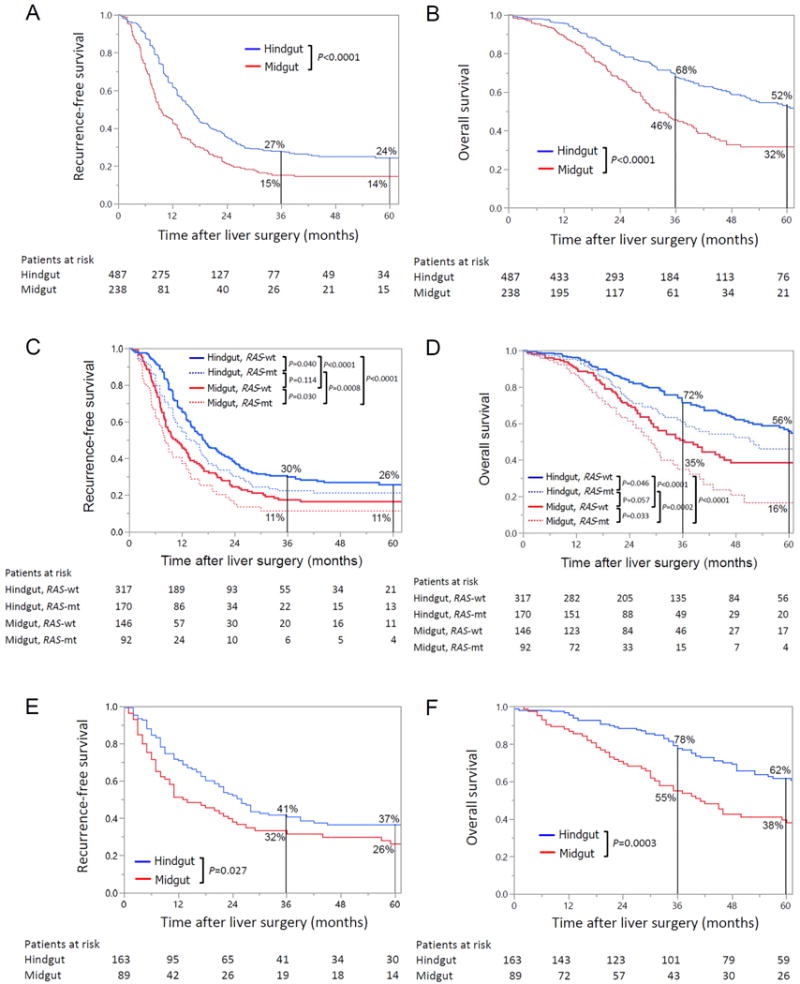
原发性结肠癌的胚胎起源似乎也会影响肝转移患者的预后。一项研究纳入了727例化疗后行切除术的患者,发现相比来源于后肠的CRLM(即左半结肠/乙状结肠肿瘤),来源于中肠的CRLM(即右半结肠肿瘤)对化疗的病理学反应更差,切除术后的生存率更低。这种影响与RAS突变状态无关【Yamashita S 2018】。与原发肿瘤位于左半结肠相比,原发肿瘤位于右半结肠的不良影响也可见于其他CRC人群,包括不可切除转移性CRC患者和局部非转移性CRC患者。
|