肝细胞肝癌流行病学
原发性肝癌是世界上第五大最常见的癌症,也是癌症相关死亡率的第三大原因【Thuluvath PJ, 2021】。是一个重大的全球公共卫生问题。即使在高收入国家也是如此【Sung 2021】。给劳动年龄人口带来了沉重的负担,并带来了相当大的经济后果。在这些原发性肝癌病例中,肝细胞癌(HCC)是最常见的原发性肝癌类型,85-90%可归因于肝细胞癌(HCC)【Xie DY, 2020】。不幸的是,35-40%在诊断HCC时存在多个结节【Risaliti M,2022 Viganò L,2019】。
关于巴塞罗那分期
为确保HCC的有效管理和治疗,国际上制定了各种指南,包括亚太肝脏研究协会(APASL)、欧洲肝脏研究协会(EASL)和美国肝脏疾病研究协会(AASLD)【EASL 2018, Bruix 2005,Burix 2011,Masao Omata 2010,,Burix 2001】。AASLD和EASL指南基于巴塞罗那临床肝癌 (Barcelona Clinic Liver Cancer, BCLC) 分期系统,该系统考虑了肿瘤特征 (数目、大小、血管侵犯和肝外定位)、肝功能 [Child-Pugh评分(CPS)]和美国东部肿瘤协作组(Eastern Cooperative Oncology Group, Eastern Cooperative Oncology Group)量表定义的功能状态(PS)等因素,以确定合适的治疗方案并预测患者预后。
多灶性HCC可分为几个阶段
每个阶段都有其推荐的治疗方案。
早期 A期 早期 [巴塞罗那临床肝癌(Barcelona Clinic Liver Cancer, BCLC) A期] 多灶性HCC表现为最多3个结节(非>3 cm),无大血管侵犯、肝外扩散或癌症相关症状 [体能状态(performance status, PS) 0]【Reig M, 2022】。巴塞罗那临床A期多灶性HCC的典型治疗包括肝移植或消融。 中期 B期 超过BCLC A期标准、保留肝功能且无癌症相关症状、肝外疾病或血管侵犯的多灶性HCC患者被归类为中期或BCLC B期。在这一多样化的人群中,我们描述了三个亚组: (I) 有明确定义的HCC结节,如果符合“扩大肝移植”标准,则可能是肝移植(LT)的候选者; (II) 保留门静脉血流和明确肿瘤负荷的患者,如果不能行肝移植,可接受局部治疗; (III) 肝细胞癌肝脏弥漫性、浸润性、广泛受累,但仍在BCLC B级范围内的患者。 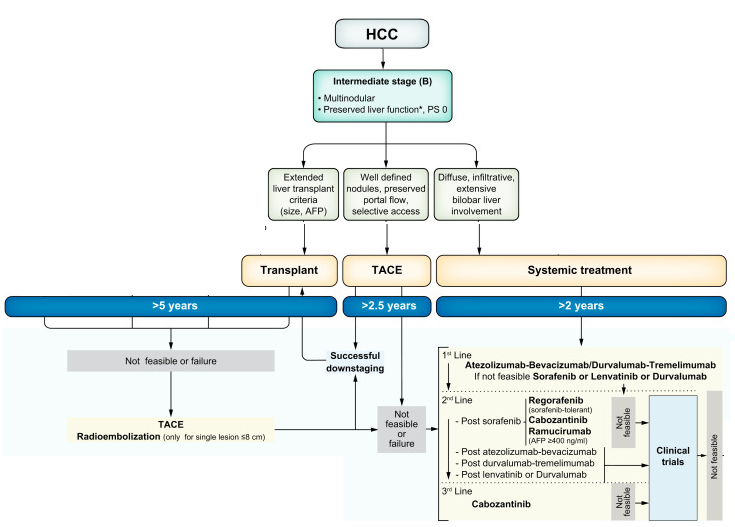 晚期 C期 众所周知,浸润性肝细胞癌的预后比结节性肝细胞癌更差,肝外转移、血管侵犯、甲胎蛋白(AFP)水平更高,临床症状更明显【Yopp AC, 2015】。这最后一个亚组的大多数患者不能从经动脉化疗栓塞(TACE)中获益,建议进行全身治疗【Reig M, 2022】。其他选择,如肝切除术(LR)和其他局部区域治疗已经成功应用【Forner A,2014】。这些治疗方案都有其自身的优点和局限性,需要仔细评估。 本栏目主要介绍中期肝癌的介入治疗  2022以前,中期肝癌被认为是肝动脉化疗性栓塞,或TACE(transarterial chemoembolization)主要适应症。但2022年之前的BCLC分组方案过于宽泛,给很多治疗方法提供了探讨的机会,特别是肝移植技术的成熟,分子靶向和免疫药物的应用使过去TACE在B期肝癌的地位收到明显的挑战,超越TACE(BCLC 不依从)也取得B期患者的良好获益 
|
 |
|
A: 根据2000年欧洲肝脏研究协会(EASL)指南,2008年至2012年间肝细胞癌(HCC)相关死亡的Kaplan-Meier曲线; B:根据2012年EASL指南,2013 - 2016年HCC相关死亡的 Kaplan-Meier曲线。 |
HCC相关死亡的危险因素包括
大于4个肿瘤和最大肿瘤直径大于10 cm。
与HCC相关生存率显著提高相关
向上治疗组,(HR 0.448, 95%CI: 0.310 ~ 0.647, P < 0.001)
血小板计数增高 (> 105/μL;HR 0.672, 95%CI: 0.507-0.890, P = 0.006)。
根据2012年EASL指南,上行治疗显示所有治疗组的最佳生存结果(5年生存率:57.3% vs 35.2%, log-rank P < 0.001,上图B)。
HCC相关死亡的危险因素包括
- :> 70岁
- 男性
- 总胆红素水平> 1.2 mg/dL
- AFP > 200 ng/mL、
- > 4个肿瘤、
- 最大肿瘤直径> 5 cm
- 下行治疗(downward treatment)-
Downward treatment referred to moving from left to right in the BCLC staging system or treatments under clinical trials with no proven efficacy. All guidelines recommended TACE as standard therapy for unresectable, large, or multifocal stage B HCC.
然而,向上治疗(肝切除,肝移植和肝消融)(HR 0.720, 95%CI: 0.478-1.086, P = 0.117)并没有显著改善HCC相关生存率(表5)。
相对于2005年AASLD指南,接受向上治疗(upward treatment)的患者的5年生存率明显优于接受指南依从性治疗的患者(63% vs 30%, log-rank P < 0.001,下图A)。
 |
HCC 相关死亡的危险因素包括大于4个肿瘤和最大肿瘤直径大于5 cm。2008 - 2010年间,向上治疗(HR 0.465, 95%CI: 0.322-0.670, P < 0.001)和血小板计数> 105/μL (HR 0.684, 95%CI: 0.518-0.904, P = 0.008)显著改善HCC患者的HCC相关生存结局。
对于根据2010 AASLD指南评估的患者,接受向上治疗的患者比接受指南依从性治疗的患者表现出更好的5年生存率(50% vs 29.3%, log-rank P < 0.001,上图B)。HCC相关死亡的相关因素包括
- :> 70岁
- CPS > 7
- > 4个肿瘤
- 最大肿瘤直径> 5cm
- 上行治疗 ( HR 0.478, 95%CI: 0.333-0.685, P < 0.001)
- 血清白蛋白水平> 3.5 g/dL ( HR 0.596, 95%CI: 0.416-0.855, P = 0.005)
HCC相关生存率改善相关。相对于2010年APASL指南,接受指南依从治疗的患者在所有组中生存率最高(1年生存率:在遵循指南、向上和向下治疗组中,分别为84.1%、77.3%和36.4%,log-rank P < 0.001,补充图1)。
HCC相关死亡的危险因素包括
> 70岁、
INR > 1.2
总胆红素水平> 1.2 mg/dL
> 4个肿瘤
最大肿瘤直径> 5 cm
向下治疗。
上行治疗(HR 0.704, 95%CI: 0.372-1.333, P =0.281)与更好的生存结果无关(补充表3),这可能是由于上行治疗组患者数量相对于指导依从组较少。
这项大规模纵向研究分析了韩国8年期间B期HCC患者的真实世界数据。
BCLC 分组方案与真实世界之间有距离
由于这是一项使用KCCR数据的全国多中心研究,因此随机选取了具有代表性的HCC患者。对B期HCC治疗指南的依从率并没有随着时间的推移而增加,这凸显了官方建议和临床实践之间的差距。
本研究探讨了B期HCC患者治疗决策的意义。
值得注意的是,本研究揭示了肝切除术是韩国B期HCC的常见治疗方案,偏离了欧洲肝病学会和美国肝病学会指南。
此外,在某些(BCLC B期)患者中,包括肝切除术在内的根治性治疗可获得优于TACE的生存结局。
B期HCC患者根治性治疗后的预后因素包括年龄、肿瘤数目、最大肿瘤直径和基础肝功能,这与之前的大规模研究一致【Tsilimigras DI 2020,Li ZL 2018,Kim H 2017】。
总体而言,这些研究结果提示,即使考虑到潜在的选择偏倚,根治性治疗仍可能显著改善B期HCC患者的预后。在东亚国家,随着时间的推移,EASL和AASLD指南依从率仍难以显著提高。
对此的一个合理解释是HCC的复杂性和多面性,这通常需要量身定制的治疗策略,而这些治疗策略可能并不总是与标准指南一致。
此外,与西方国家相比,东亚国家HCC的发病率较高,这可能是由于慢性乙型肝炎的患病率较高。这使得开发专门的治疗方法成为必要。
肝脏专科中心和多学科团队的建立培养了各种治疗模式的专业知识。
随着时间的推移,基于持续的研究和临床试验,包括肝切除和移植在内的积极治疗HCC的传统已根深蒂固,并导致了创新策略。
此外,医疗基础设施、临床实践、人口统计学和治疗偏好的差异都可能从根本上造成不同国家和地区之间指南不依从的差异。
2022年,BCLC组更新了HCC治疗建议,根据肿瘤特征和潜在治疗反应将B期HCC患者分为3组。
尽管存在多个HCC,但仍符合扩大肝移植标准;由于HCC结节边界清楚且门静脉血流保留,适合行TACE;【Reig M 2022】
然而,由于缺乏前瞻性研究,最新的BCLC分期系统仍不推荐肝切除术作为B期HCC的可行治疗方法。
值得注意的是,中国的一项随机对照试验和韩国的一项回顾性队列研究表明,在经过选择的多发[26]HCC患者中,肝切除术比TACE具有潜在的生存获益【Yin L 2014】。
在韩国的一项回顾性队列研究中,研究者比较了两个时期(2003 ~ 2005年和2008 ~ 2010年),以评估治疗趋势的变化。
结果表明,接受根治性治疗的0-C期HCC患者的5年生存率优于接受非根治性治疗的患者【Reig M 2022】。
在经过选择的B期HCC患者中,肝切除术相对于TACE的潜在生存获益已通过系统综述和荟萃分析得到验证【Glanfzounis GK 2017,Tada T 2017,Luo J 2011,Han HM 2018,Qi X 2015】。
考虑到真实世界的情况【Ymarmoto M 2021,Tsilimlgras DI 2020,Li ZL 2018,Kim H 2017,Ciria R 2015】,肝切除术可以获得更好的结局,这为更晚期HCC患者采用根治性治疗提供了强有力的证据。
然而,需要仔细选择患者,考虑患者个体特征和机构的专业知识,以实现生存获益的最大化。
慢性肝病患者肝切除术后肝功能衰竭的风险增加;
然而,术前评估,如门静脉高压的评估、未来剩余肝脏体积或功能的预测、门静脉栓塞、外科技术和术后管理的进展,扩大了甚至在更晚期HCC中肝切除的可能性。
因此,门静脉高压、多灶性肝癌和门静脉血栓现在被认为是肝癌治疗中可控的挑战。
总体而言,多学科评估和精心规划在B期HCC治疗策略选择中的重要性不容夸大;
HIMALAYA STRIDE
FDA批准替西木单抗(tremelimumab)与度伐利尤单抗(durvalumab)联合用于不可切除的肝细胞癌
对于中期肝癌,指南多推荐介入治疗,ASCO2019年会议上以壁报形式报道了一项介入联合消融对比单独介入治疗的随机对照研究(摘要号: 4077)。该研究结果表明,介入联合消融治疗较单独介入治疗可显著延长中期肝癌的生存期。
2022年10月21日,美国食品和药物管理局批准替西木单抗(tremelimumab)与度伐利尤单抗(durvalumab)联合用于无法切除的肝细胞癌(uHCC)成人患者。
HIMALAYA(NCT03298451)研究评估了这种药物组合的疗效和安全性,研究随机(1:1:1)分成3各组,开放标签,多中心研究,入组初治的、确诊的uHCC患者(未接受过抗肿瘤全身治疗)。
患者被随机分配到三个臂中的一个:
组1接受tremelimumab300mg作为一次单次静脉(IV)输注联合durvalumab1500mg IV,在同一天给药,随后durvalumab1500mg IV每4周给药一次;
组2接受durvalumab1500mg IV每4周给药依次;
组3接受索拉菲尼 sorafenib 400mg口服每日两次。
主要疗效结果是总体生存期(OS)。
与索拉非尼相比,Tremelimumab加durvalumab 在OS中显示出统计学上显着和临床上有意义的改善(分层危险比[HR]为0.78[95%CI:0.66,0.92],双面p值=0.0035);中位OS为16.4个月(95%CI:14.2, 19.6) versus 13.8 months (95% CI: 12.3, 16.1).
其他疗效结果包括研究者根据RECIST v1.1评估的无进展生存期(PFS)和总体反应率(ORR)。 Tremelimumab加durvalumab和sorafenib arms的中位PFS分别为3.8个月(95%CI:3.7,5.3)和4.1个月(95%CI:3.7,5.5)(分层HR0.90;95%CI:0.77,1.05)。
ORR在tremelimumab加durvalumab臂中为20.1%(95%CI:16.3,24.4),而用sorafenib治疗的患者为5.1%(95%CI:3.2,7.8)。
患者发生的最常见(≥20%)不良反应是皮疹,腹泻,疲劳,瘙痒,肌肉骨骼疼痛和腹痛。
对于体重30kg或更多的患者,推荐的tremelimumab剂量为300mg IV作为单剂量,在周期1/第1天与durvalumab1500mg组合,随后每4周durvalumab1500mg IV。
对于体重小于30kg的人,推荐的tremelimumab剂量为4mg/kg IV作为单剂量与durvalumab20mg/kg IV联合使用,随后每4周使用durvalumab 20mg/kg IV


