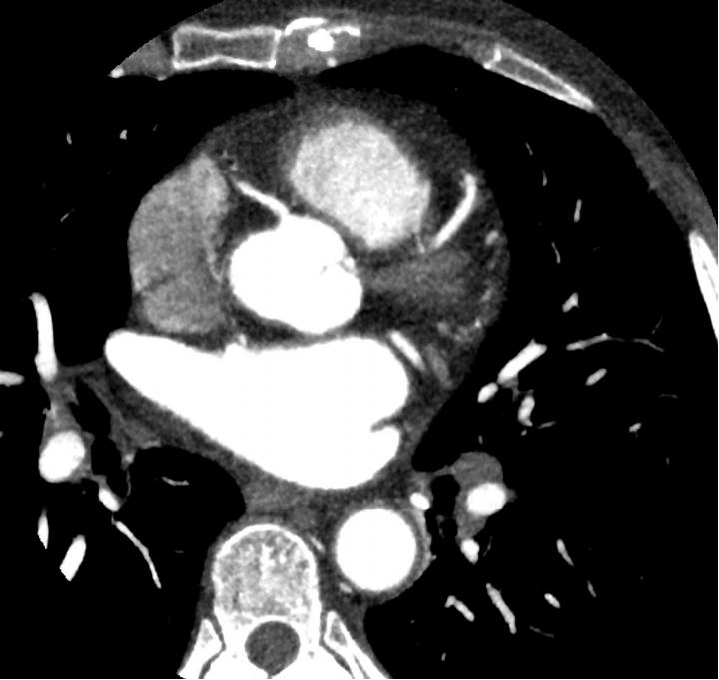
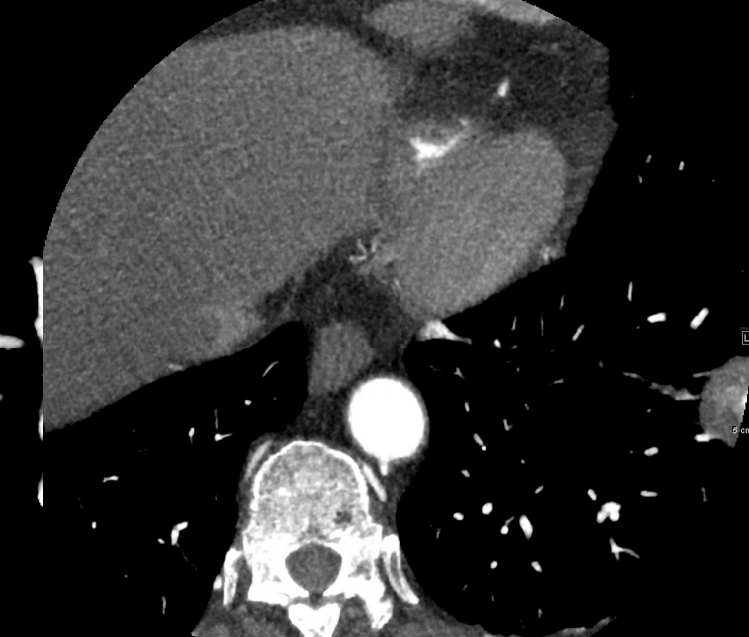
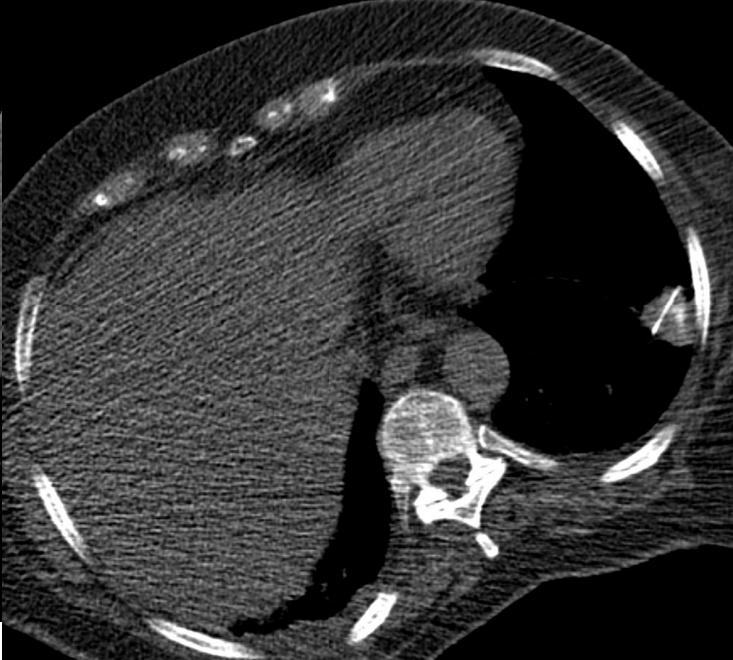
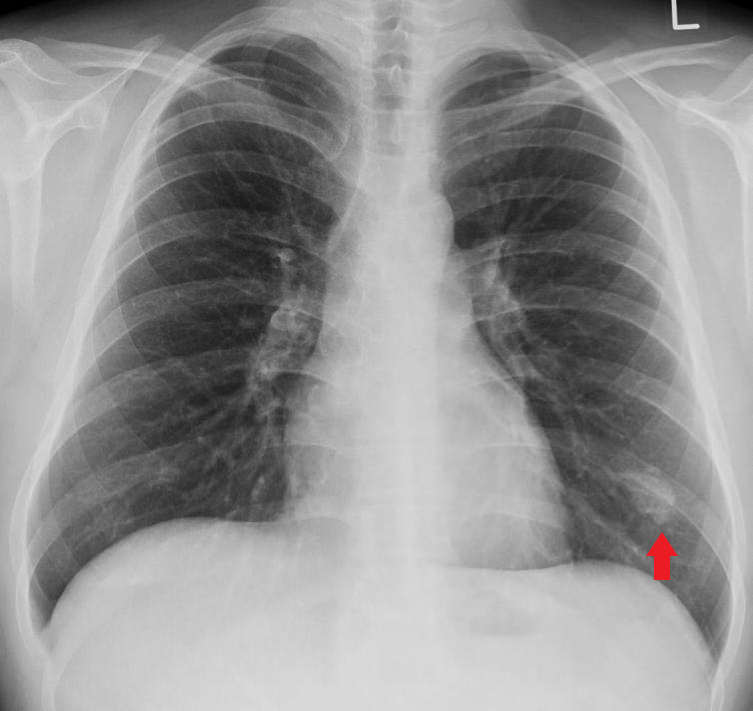
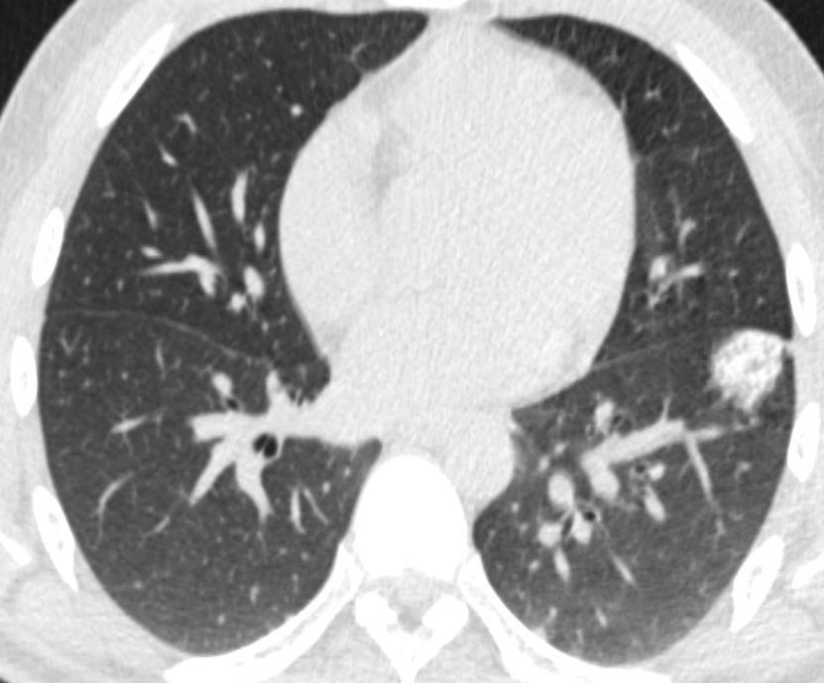
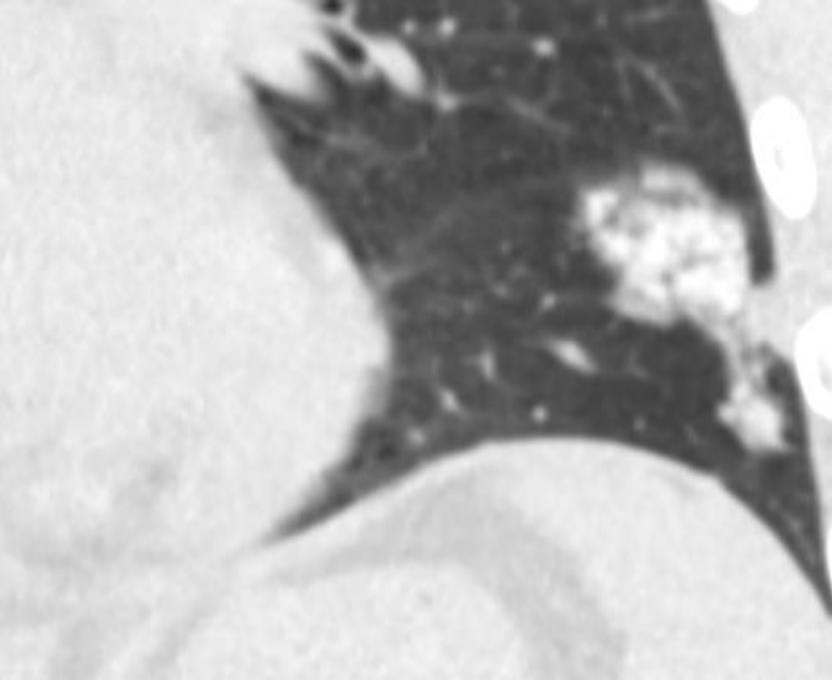
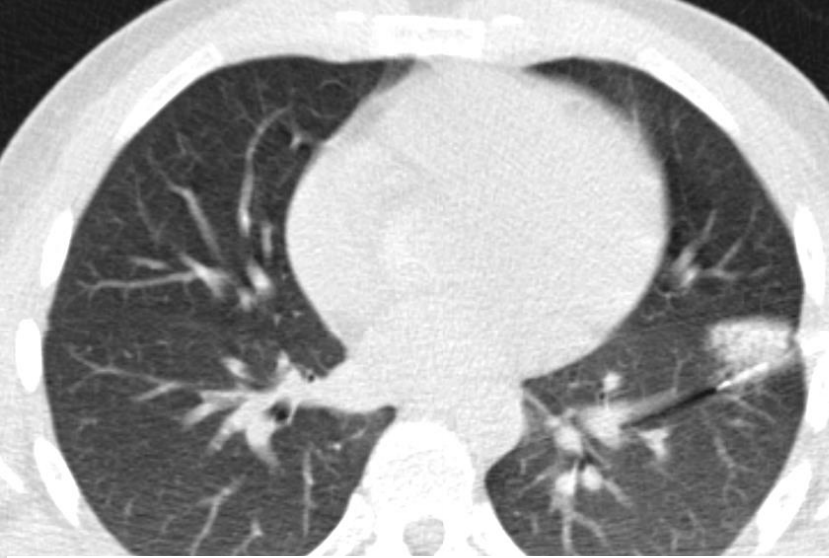
▪ 肺癌仍然是全世界癌症相关死亡的最常见原因之一
▪ CT广泛应用→ 肺/纵隔病变数量增加
▪ 靶向治疗和个性化用药:获取组织来分析癌症分子指纹变得越来越重要
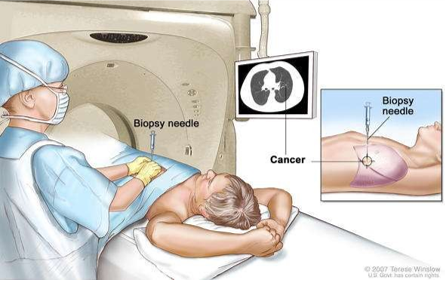
经皮肺活检是一种成熟的方法,在影像的引导下经皮穿刺肺内病变获取适当的组织,多数情况下是对肺肿瘤进行最后的诊断,并分析恶性肿瘤类型,指导肿瘤的方法 随着CT成像的进步和人们对肺癌筛查的兴趣日益浓厚,肺结节的管理变得越来越具有挑战性,
美国预防筛查工作组(USPSTF)更新的肺癌筛查指南(2013年12月):
CT的广泛使用导致偶然发现的肺结节增加
Most common indication for image- guided lung biopsy
胸部病变可以通过多种手段进行处理,包括支气管镜、胸腔镜、纵隔镜或胸廓切开术。 支气管镜是一种精确和安全的手段,对于具有支气管内成分的中心性病变的诊断,但对肺部周围性病变或纵隔疾病诊断的精确性较差。超声引导下支气管镜活检出现后,对器官支气管周围性病变带来了新选择。临床实践中特别需要对支气管镜活检建立一个规范的适应症和质量控制,避免患者支气管镜活检失败后再去做CT引导下的活检,特别是肺周围性病变。
胸腔镜检查更具侵入性,但对于弥漫性肺间质疾病、良性肺部结节和周围性结节,尤其是直径过小不能进行经皮细针活检的结节的诊断,具有较高的精确性。 纵隔镜和纵隔切开术具有较高的诊断精确性,但仅适用于特异的限制性结节链。 开放手术活检与经皮活检或内镜技术相比,手术方式都具有较高的诊断精确性,但也带来了显著增高的致残率和死亡率。 总之,经皮活检是最通用的手段,同时具有较高的诊断精确性和安全性。对于每个单独病例均,应考虑所有的诊断方法。介入放射科医师、呼吸内科医师和胸外科医师之间的密切合作关系,将保证任何病人都能选择适当的诊断手段。
由于纵隔内非癌肿块占相对优势,当切割针同时获取常规细胞学标本以及组织学标本时,针吸活检的精确性显著提高。最好的例子是对淋巴瘤的诊断。据报道,仅用细胞学对非何杰金淋巴瘤诊断,其敏感性范围为54-83%。加用组织学之后,超过90%的病例可获得诊断和分型。细胞学和组织活检都不能可靠的鉴别非何杰金淋巴瘤中的滤泡型和弥漫型,但这并无太大的临床意义。
对非何杰金淋巴瘤诊断的总体结果较何杰金氏病更优,由于后者的诊断试验是相对较少的Reed-Sternberg 细胞的形态。组织学标本对胸腺瘤的诊断也具有优越性,虽然鉴别良性和恶性可能比较困难。对于纵隔癌性肿块的诊断,细胞学检查较为成功,但加用组织学检查有益于精确的分型,尤其在之前的组织标本不能用于比较时。如果细胞学都需要加用组织学标本的话,细针活检是否还必要。 经皮肺病变活检(percutaneous lung lesion biopsy,PLLB)是胸部深层组织病变检查的最为常用的手段。其他类型的经胸活检(如纵隔结构、胸膜或骨)将在其它栏目中讨论。
经皮肺病变活检也是是放射科医生进行的各种手术中,并发症发生率最高的手术操作之一,公认的并发症发生率约为50%。只不过大多数并发症无需处理,甚至无需住院。病变或患者无特殊情况下,手术时间少于30分钟。即使手术时间延长到90分钟以上和/或多次尝试,仍存在标本取材不满意或不能做出病例诊断。关于经皮肺病变活检的患者的决定最好由MDT决定(来自多个专业的医生)来完成。但实际上做不到,临床上是否肺活检大多数都是由介入放射学医生自己决定的。困难的病例才考虑邀请MDT讨论。潜在病变可能进入支气管腔内或在主气管/支气管周围可考虑内窥镜方法组织活检,或支气管镜内镜引导下气管/支气管周围病变的透壁穿刺活检(EBUS)。
获得更多的影像学以便评估是否有更好的首选,可以替代经皮活检。更有时观察等待病变的变化也是一种选择。影像学的评估不仅可以提高获得有效标本的几率,而且还可能提供关于病变及其侵袭性的其他无法获得的信息。 不认真进行术前准备往往导致无症状门诊操作转变为充满疼痛的多日或更长时间的住院经验。由于经皮肺病变活检通常在局麻下进行,患者通常需要临床医生、活检医生以及护士指导,进行心理和镇痛支持。团队方法是,护士协助术前患者教育和麻醉,有时由麻醉师直接支持,为患者的安全服务。本栏目的目的是提供关于完成这些任务的具体信息。
对于肺部恶性肿瘤,如果是诊断目的仅用细胞学检查就较为成功,据报道其恶性敏感性为80-93%。当获得适当的组织学标本,联合检查的恶性敏感性增加至85-97%。虽然细胞学足以鉴别小细胞肺癌和非小细胞肺癌,但加用组织学有利于精确的分子水平类型的确定。特别是当今医学发展肺部肿瘤已经进入到分子靶向药物的时代。
非肿瘤性肺部病变 组织学检查最为显著的优点在于,对于良性结节能够获得特异性的诊断。如果获得特异性的良性诊断,则阴性预测值可达到100%。对于良性疾病,仅用细胞学检查只能提供非特异性的非癌的结果,在这种情况下,阴性预测值会低很多。因此,通过重复活检或者手术进一步诊断往往是必需的。
针吸活检也可用于对弥漫性肺间质病变的诊断。在大约75%的弥漫性感染中,仅用细针穿刺细胞学检查能够提示病因学因素,但在非感染性间质疾病中则不理想。对于非感染性疾病,使用大切割针能够提高精确性,但同时可出现较高的并发症发生率。不仅气胸更加多见,而且在高达21%的病例中可出现明显的咯血,据报道死亡率可达1%。在某些病例中,对于感染性疾病的诊断,同时患者并没有机械正压通气的情况下,细针穿刺活检似乎是一种可接受的选择。在大部分病例中,支气管镜和胸腔镜都更为精确和安全,应作为诊断手段的首选。
并发症
经皮胸腔穿刺的并发症,除气胸外,还包括咯血和空气栓塞。
据报道, 2-12%的病例可发生咯血。虽然通常是轻微和自限性的,但在极少数病例中,咯血也可以极为严重甚至致死。当横贯大气道或血管时,咯血则更为常见和严重,因此在肺门活检时其发生率大为提高。出血性疾病和肺动脉高压被认为是活检的相对禁忌症,由于其存在更严重出血的潜在危险。
可能发生空气栓塞的情况包括:在支气管与血管交通,同时胸内压力增高,包括咳嗽或正压通气时,或者在针与空气相通,而针尖在肺静脉中,同时胸内压力降低,如吸气时。这是一种极为少见的并发症,但却是致死性的。为了减少发生空气栓塞的危险,保证针头在病灶中是极为重要的,尤其在使用同轴引导针时。针进入胸腔的时间应尽可能缩短,并且不可与空气相通。对于活检过程中不能暂停呼吸的患者,这些预防措施更为重要。进行正压机械通气的患者不应进行经皮胸腔活检,除非在极为需要的情况下。
虽然早期透视也可以在大部分活检中用于引导,但CT仍是目前最常用的手段。透视相对快速和简单,但仅限于可在二维平面中清晰观察的病灶,因此在显示纵隔内或接近纵隔的小结节或病变活检时效果较不满意。在透视引导下对胸膜基底的肺病变活检时,因为胸膜接触部位很小时,避免穿过正常通气肺则较为困难。阻塞后小叶塌陷可能会使中央型病变不明显,引起取样误差。
CT在确定最佳针刺路径方面更加精确,可以避免穿过过度通气的肺、支气管和血管结构。在纵隔内,往往可以通过横穿胸膜外路径(不经过肺)到达病变。甚至当胸膜外的进入路径并不明显时,人工胸膜外开窗可以通过向壁层胸膜外注射生理盐水,来使相邻的通气肺从预期的针刺路径移位。对于胸膜肿物和周围型胸膜基底的肺部肿块,往往可以横穿胸膜接触部位,虽然偶尔需要通过更为复杂的方法。阻塞后塌陷也可用作为非通气途径进入中心型肿物。在CT引导下针尖可以更加准确放置在大小肿物中,因此能够避开肿瘤的坏死部分。手术者经验和高速CT扫描速度的提高,可以使CT引导胸腔活检的进行与透视引导同样快速,而具有更高的精确性和安全性。在快速CT扫描广泛普及的情况下,透视引导下的活检逐渐消逝,每一轮新的技术革命,都会淘汰旧的技术。正所谓:千门万户曈曈日,总把新桃换旧符
The latest references report 0% mortality for CT-guided biopsy of the thorax.
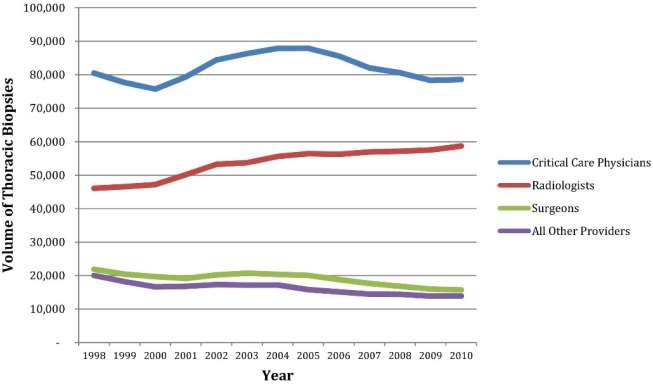
其中外科下降20.9%,放射科增加3.6%,重症监护内科下降19.6%
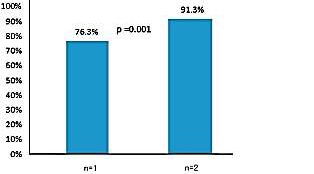
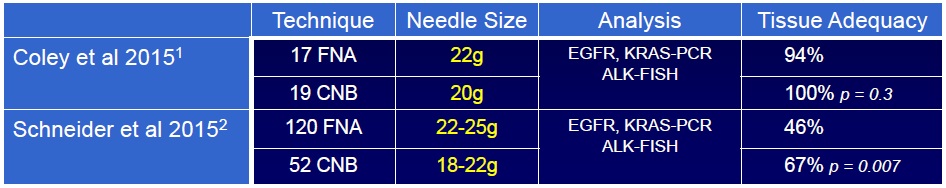
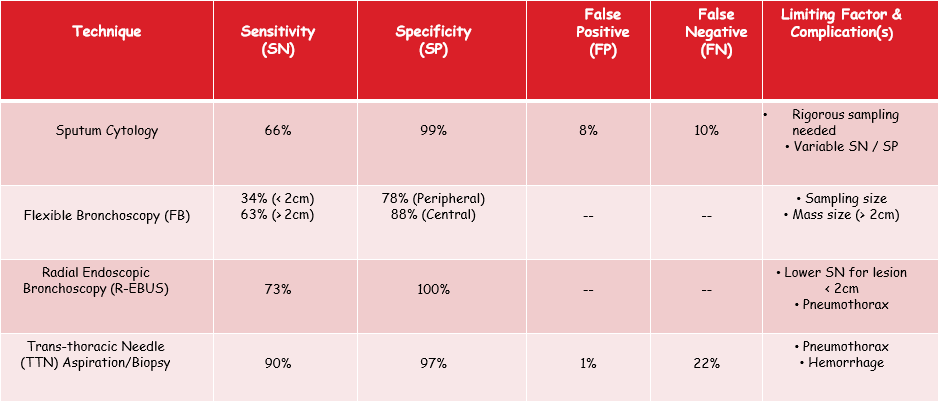
CNB(cutting needle biopsy)的优点 (活检剥壳细针抽吸(FNAC)、空芯针穿刺(CNB)、真空辅助(VAB) 1. 在所有实践环境中都非常准确,包括现场细胞学无法评估FNA标本【2】 Highly accurate in all practice settings, including those in which on-site cytology is not available to assess FNA specimens【3】 2. 低假阴性率【3】· Lower false negative rate【3】 3. 在非癌性恶性肿瘤(即淋巴瘤、肉瘤、间皮瘤)诊断中的优势 Favored in the diagnosis of non-carcinomatous malignancies (i.e. lymphoma, sarcoma, mesothelioma) 4. 优于FNA诊断良性病变【4】。 Superior to FNA in diagnosing benign lesions FNAC vs CNB FNA versus cutting core needle biopsy: systematic review (11 studies)【5】
了解获益(Understanding Yield ): FNA v. CNB (FNA versus cutting core needle biopsy)
了解获益:诊断性标本(diagnosis sampling)【10】
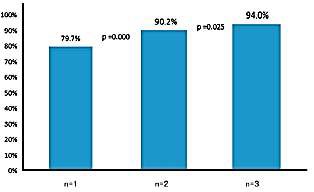
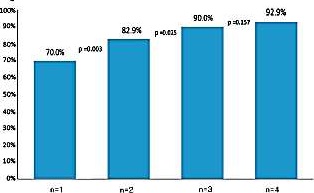
确定CT引导下CNB穿刺次数对于诊断肺恶性病变的获益
Three coaxial needle passes might be optimal in the diagnosis of lung malignancy.(穿三次) Understanding Yield: Diagnostic Sampling
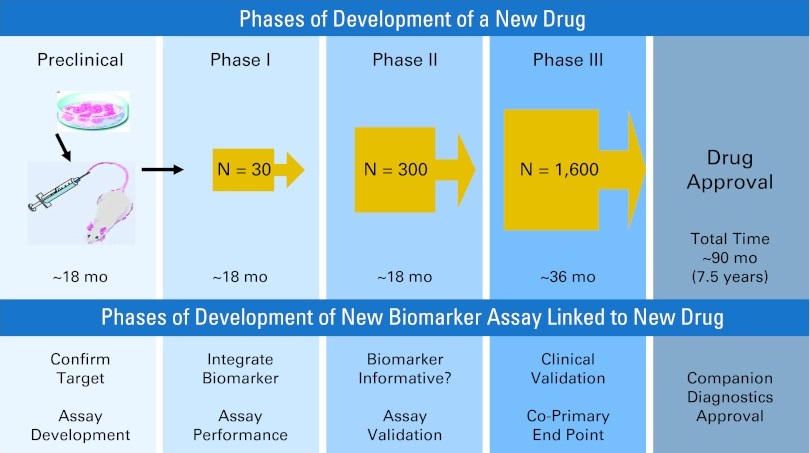
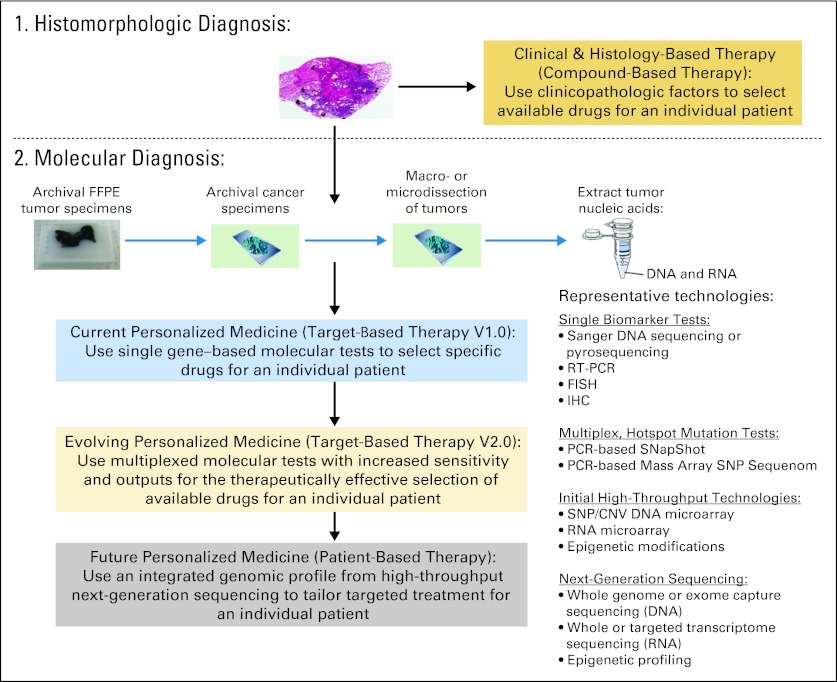
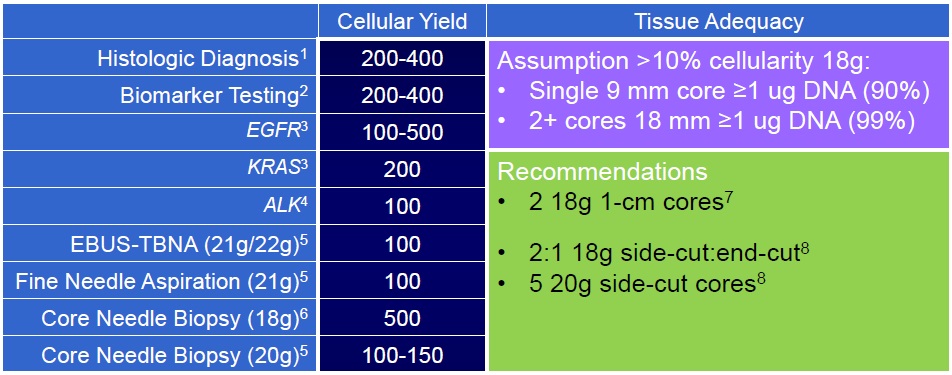
Understanding Yield: Biomarkers in NSCLC 分子分析和靶向治疗的进展需要大量的肿瘤组织来识别各种体细胞突变【11】。分子表型(Molecular phenotyping)可以用来指导靶向治疗(可药性突变)【12】
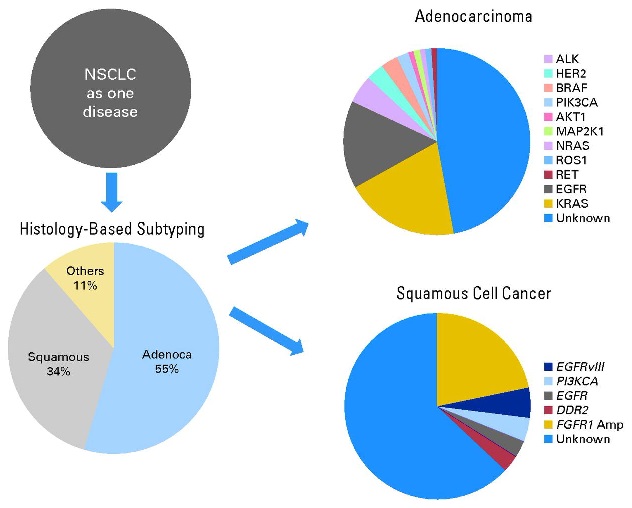
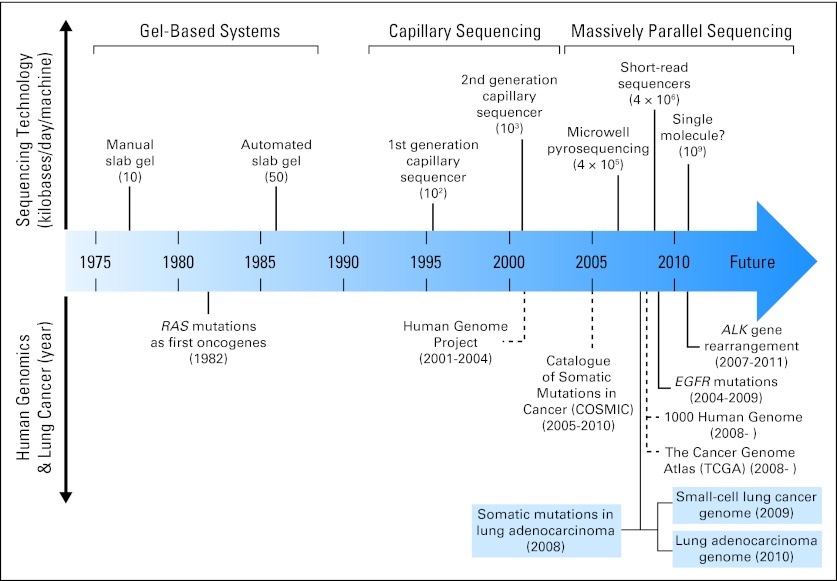
数十年以来对肺癌的诊治均是从组织学分类的角度着手。近年来随着分子医学的深入开展,对肺癌的认识已经从组织学水平向分子水平深入。在这个过程中,转化医学手段得到更多切实的应用,使得临床在肺癌的诊治方法上已经包括对表皮生 长因子受体(EGFR)、KRAS等分子突变状态的检查和应用。在2007年又一个与肺腺癌相关的分子变异被发现,即EML4-ALK融合基因。
ROS1是一种人体内由ROS1原癌基因编码的酪胺酸蛋白激酶。 Understanding Yield: Biomarker Sampling
FFPE = formalin fixed paraffin embedded Asp = aspiration specimens FNA = Fine Needle Aspiration PE = paraffin embedded Understanding Yield: Biomarker Sampling
Understanding Yield: Biomarker Sampling
Understanding Yield: Biomarker Sampling
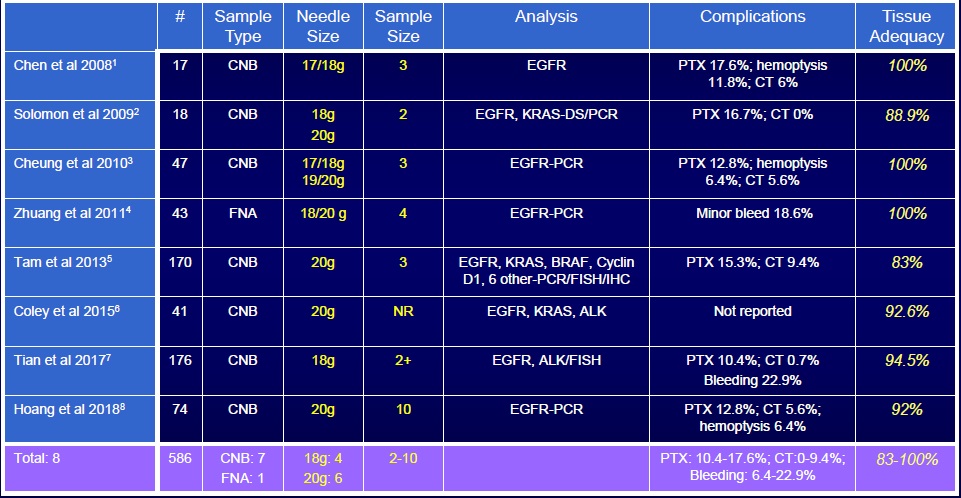
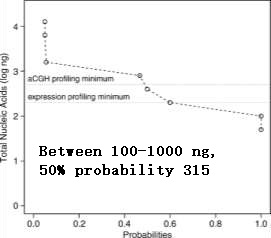
Understanding Yield: Genomic Analysis 来自74例患者的232次活检(177次离体穿刺,55次活体穿刺)【17】 - DNA+RNA获得 (98/184 RNA完整性7/10) - 针规,#PASS(穿刺次数),%CNB •18g > 20g 4.8-5.7x greater yield
• Double pass > single pass 2.4-2.8x greater yield
 1. Sharpe et al. J Am Coll Radiol 2013; 10:770-773. 2. Charig MJ, Phillips AJ. CT-guided cutting needle biopsy of lung lesions--safety and efficacy of an out-patient service. Clin Radiol. 2000 Dec;55(12):964-9. 3. Laurent F, Latrabe V, Vergier B, Michel P. Percutaneous CT-guided biopsy of the lung: comparison between aspiration and automated cutting needles using a coaxial technique. Cardiovasc Intervent Radiol. 2000 Jul-Aug;23(4):266-72. 4. Greif et al. Acta Cytol1999; 43:756-760. 5. Yao X, Gomes MM, Tsao MS, Allen CJ, Geddie W, Sekhon H.Fine-needle aspiration biopsy versus core-needle biopsy in diagnosing lung cancer: a systematic review.Curr Oncol. 2012 Feb;19(1):e16-27. doi: 10.3747/co.19.871.(免费文献)
6. Beslic S, Zukic F, Milisic S. Percutaneous transthoracic CT guided biopsies of lung lesions; fine needle aspiration biopsy versus core biopsy. Radiol Oncol. 2012 Mar;46(1):19-22.
7. Poulou LS, Tsagouli P, Ziakas PD, Politi D, Trigidou R, Thanos L.Computed tomography-guided needle aspiration and biopsy of pulmonary lesions: a single-center experience in 1000 patients. Acta Radiol. 2013 Jul;54(6):640-5.
8. Sangha BS, Hague CJ, Jessup J, O'Connor R, Mayo JR Transthoracic Computed Tomography-Guided Lung Nodule Biopsy: Comparison of Core Needle and Fine Needle Aspiration Techniques. Can Assoc Radiol J. 2016 Aug;67(3):284-9.
9. Santambrogio L, Nosotti M, Bellaviti N, Pavoni G, Radice F, Caputo V. CT-guided fine-needle aspiration cytology of solitary pulmonary nodules: a prospective, randomized study of immediate cytologic evaluation. Chest. 1997 Aug;112(2):423-5. 10.Lim et al.CT-guided core biopsy of malignant lung lesions: how many needle passes are needed? J Med Imaging Radiat Oncol 2013; 57:652-656. 11. Li et al. Genotyping and genomic profiling of non-small-cell lung cancer: implications for current and future therapies. J Clin Oncol 2013; 31:1039–1049(免费全文) 12. Paezet al. EGFR mutations in lung cancer: correlation with clinical response to gefitinib therapy Science 2004; 304:1497–1500 13. Shih et al.Epidermal growth factor receptor mutations in needle biopsy/aspiration samples predict response to gefitinib therapy and survival of patients with advanced nonsmall cell lung cancer Int J Cancer 2006; 118:963-969.
14. Otani et al. Detection of EGFR gene mutations using the wash fluid of CT-guided biopsy needle in NSCLC patients. J Thorac Oncol 2008; 3:472-476.(免费全文)
15.Zudaire et al. Histol Histopathol 2008; 23:33-40.
16. Savic et al. Br J Cancer 2008; 98:154-160.
17.Jamshidiet al. Genomic Adequacy from Solid Tumor Core Needle Biopsies of ex Vivo Tissue and in Vivo Lung Masses: Prospective Study. Radiology 2017; 282(3):903-912. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||