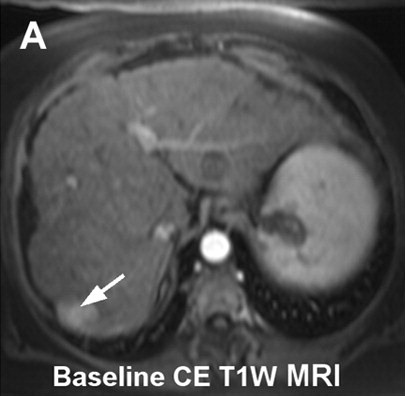
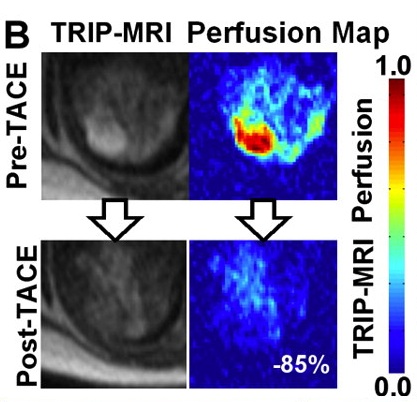
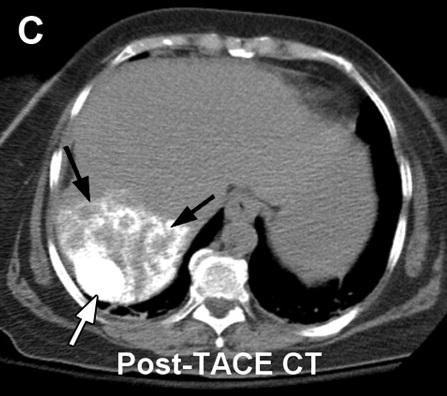
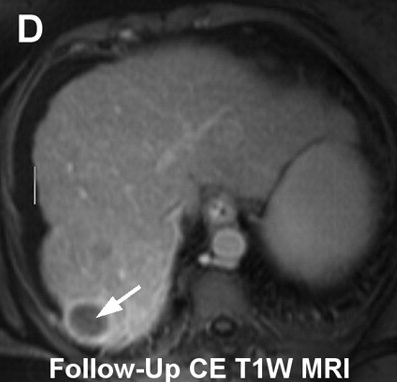
| 大多数肿瘤介入治疗的一个重要挑战是意识到,在某种特定的操作过程中治疗已经足够。在理想的情况下,将设定治疗完成的明确终点。影像学是一种潜在的无创解决方案。 所谓监视(monitoring)是观察到的操作中影像结果的可视性变化。监视的目标不仅要确定治疗是否完成,也让施术者知道肿瘤是否得到合适的治疗,肿瘤周围的重要结构是否受到影响。对于安全和有效的治疗完成,以上都是必须的。 很多影像技术用于评估肿瘤治疗的完整性。这主要是围绕血流的测量。栓塞后的血管造影能够证实血流的停滞和肿瘤血管床的完全栓塞。栓塞期间碘油或栓塞材料荷载的栓塞材料吸收可以观察到这一变化。
在三维旋转血管造影成像显示更好。结合磁共振成像和X射线系统已经在研发中,其可以在肝动脉栓塞期间显示MR灌注成像以更好进行操作期间的监视【3】
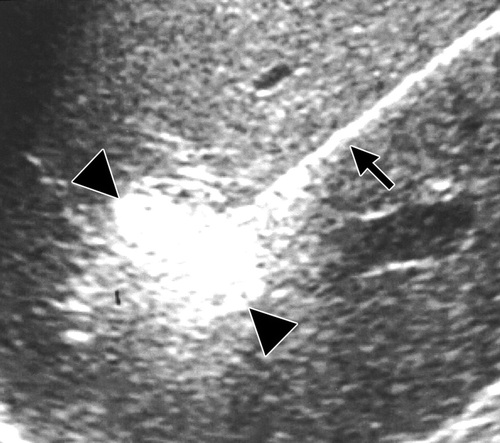
超声造影也已经用于评估血流和消融过后确定肿瘤不再有残余血液供应【4,5】。超声也可以直接监视消融的影响。射频时,回声的增加可能在消融的区域看到【6】。
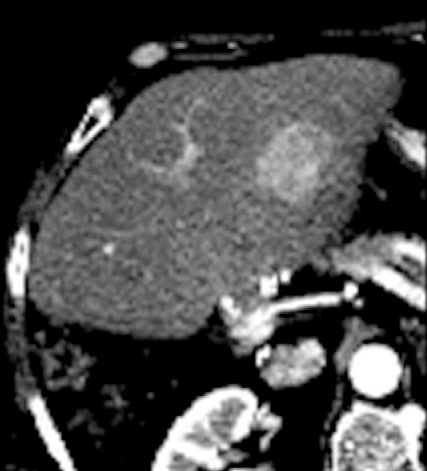
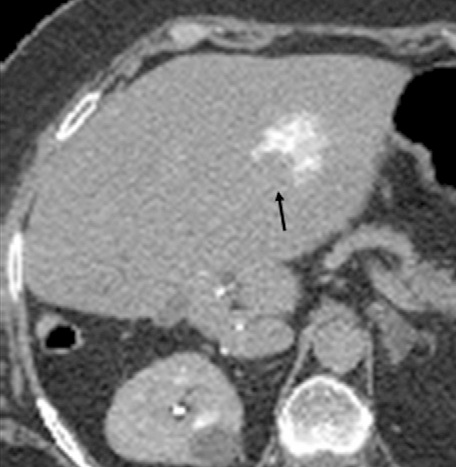
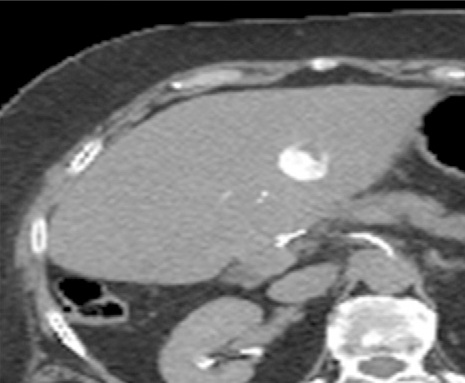
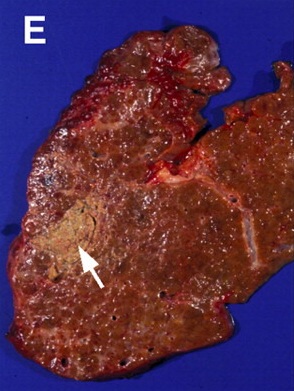
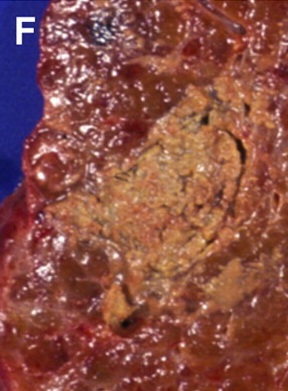
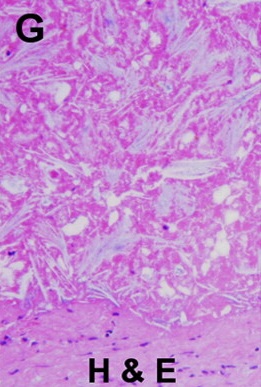
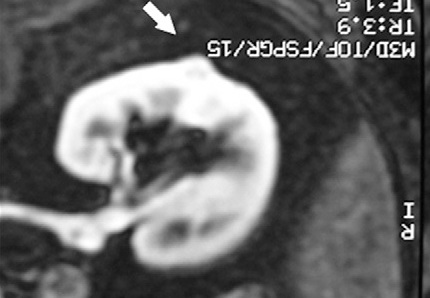
但是,这种回升增加可以遮盖操作时期的影像并与肿瘤坏死之间的相关性不好。 冷冻时团块状强回声,后方声影代表冰球已经形成【107】 和超声一样,CT和MRI影像也可以提供操作时反馈的图像。造影剂也可以用于CT或MRI成像以评估治疗区域的血管灌注情况。不像超声,用MRI或CT成像可以观察到冷冻时冰球形成的完整图像【39,108】。 Intraprocedural monitoring of ice ball formation during CT- and MR imaging-guided cryoablation of renal carcinoma
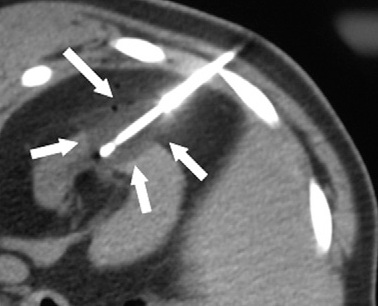
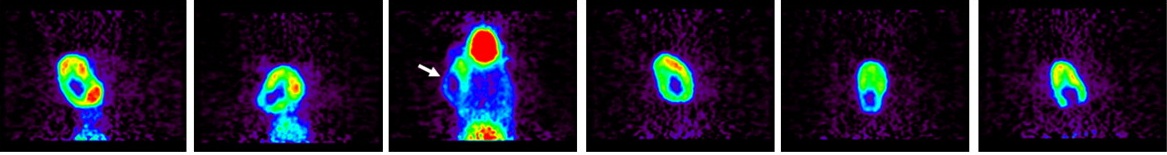
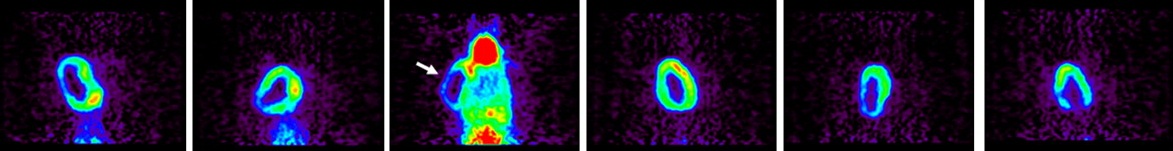
经皮酒精注射消融时可以导致CT相关性低密度,可以指导操作的终结。 可以想象在未来,核医学药物可以测量操作期间肿瘤活性以及治疗治疗的完成【109】。 Image slices are mainly focused on tumors located in center of neck for rats 1, 2, 4, and 5 or slightly on side of neck for rats 3 and 6
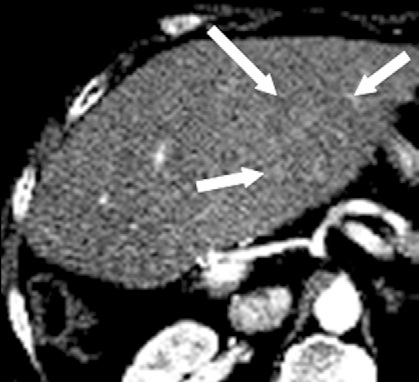
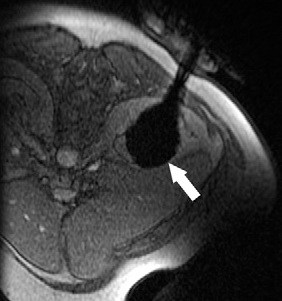
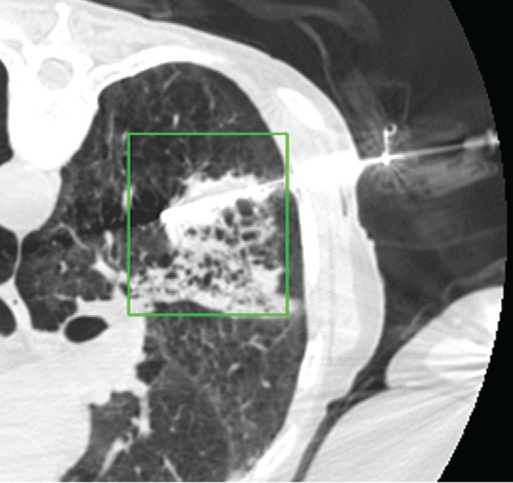
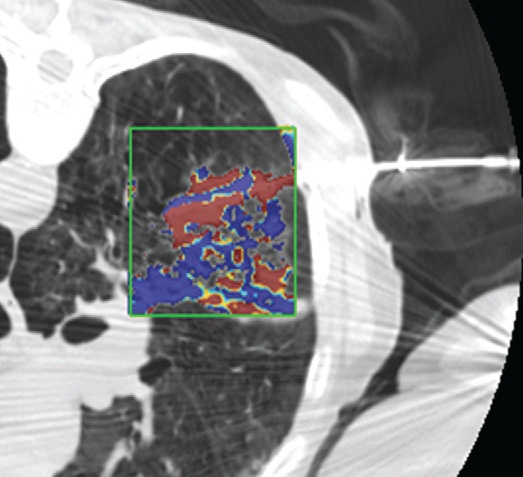
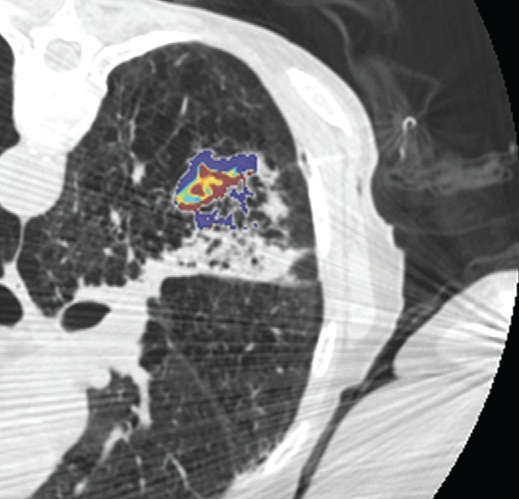
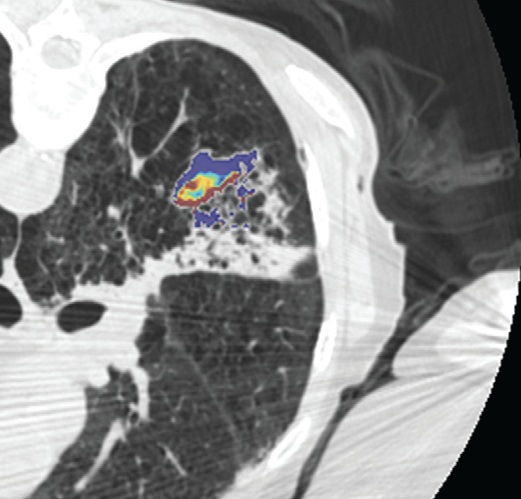
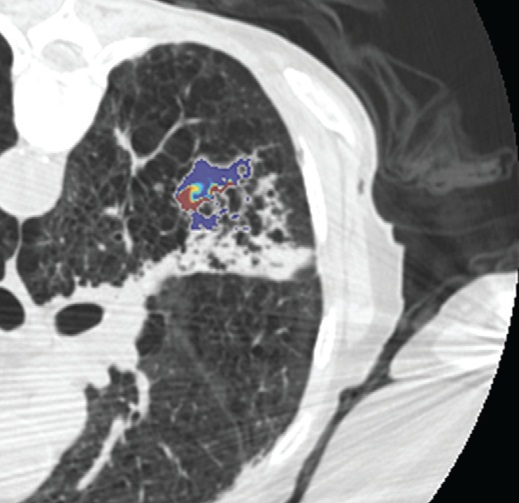
影像也可以测量组织温度;这些技术可以帮助热消融和确保肿瘤可以完全治疗而不损伤邻近重要脏器【110】。因为不同的组织有不同的死亡阈值,了解被释放的热计量甚至可能会促进某些选择性组织破坏【111】。MR测温已经被开发用于高能聚焦超声的应用【112,113】,但也可以应用于其它消融模式,如射频、激光、微波和热盐水【114,120】。通过检测磁共振质子成像与温度相关的频率变化,可以测量组织温度在1°C以内的变化【121】,因为维持将近54°C或更高温度超过1秒,被认为可以导致细胞死亡【122】,MRI的温度测量能够提供可量化的、评价热消融完整性的无创方法。而其它一些温度敏感MRI技术,如质子密度、T1和T2弛豫时间,磁化传递( magnetization transfer)和扩散也被应用,质子共振频率变化更常应用于临床。MRI温度测量的局限性依然存在,包括运动伪影,消融工具或脂肪环境导致的磁场不均匀性以及有限的瞬时清晰度(temporal resolution)。 虽然到目前为止,很多技术在临床实践中尚未发展成熟,CT和超声已经被建议未来作为测量组织温度无创方法。CT值和声速(sound velocity)都与温度变化相关【123,124】。 Intraprocedural monitoring. CT thermometry during percutaneous radiofrequency ablation of lung cancer. Changes in CT attenuation may be used to approximate the temperature.
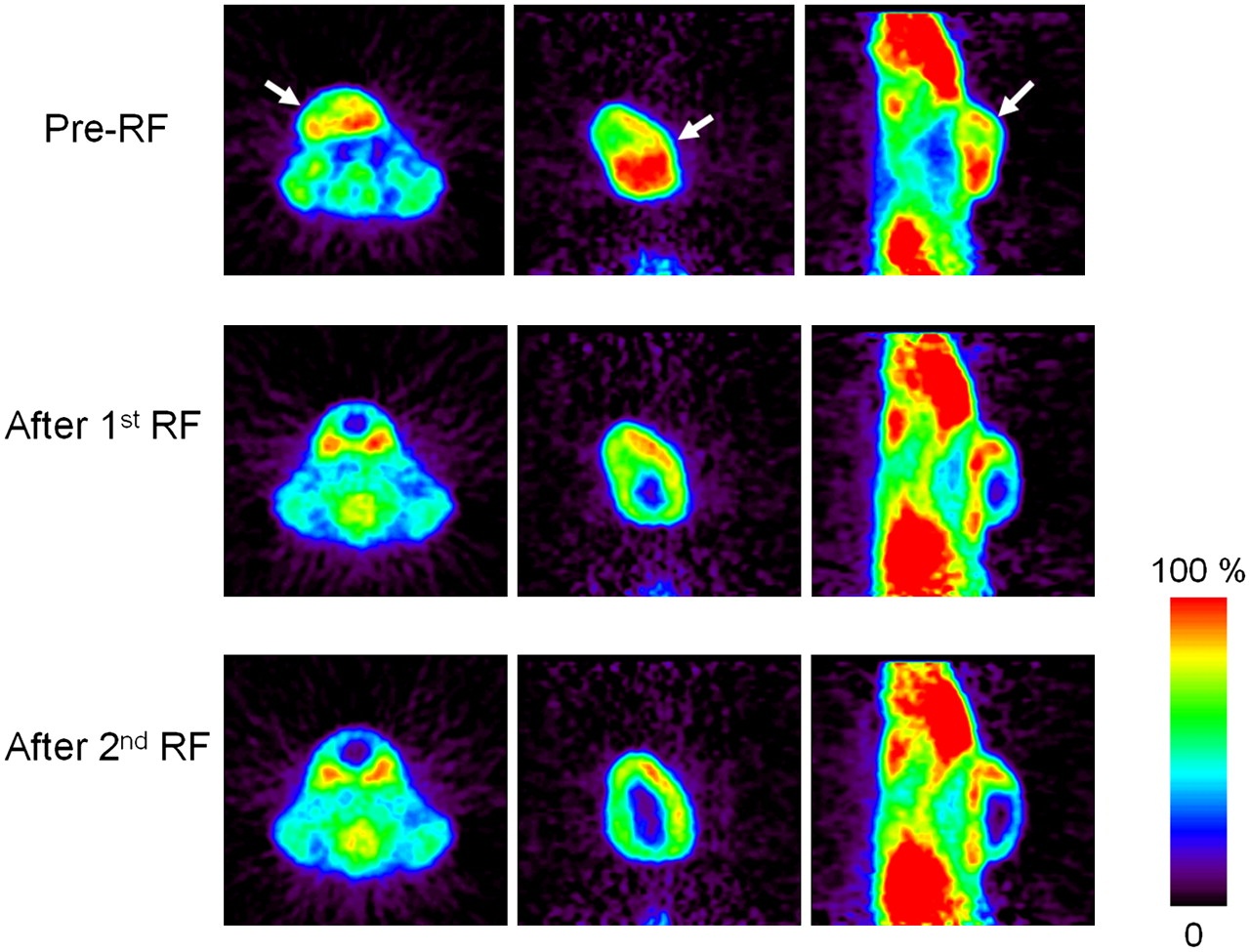
3. Larson AC , Wang D , Atassi B , et al . Transcatheter intraarterial perfusion: MR monitoring of chemoembolization for hepatocellular
carcinoma—feasibility of initial clinical translation . Radiology 2008 ; 246 ( 3 ): 964 – 971 .
4. Solbiati L , Ierace T , Tonolini M , Cova L . Guidance and monitoring of radiofrequency liver tumor ablation with contrast-enhanced
ultrasound . Eur J Radiol 2004 ; 51 ( suppl ): S19 – S23 .
5. Kim CK , Choi D , Lim HK , et al . Therapeutic response assessment of percutaneous radiofrequency ablation for hepatocellular
carcinoma: utility of contrast-enhanced agent detection imaging . Eur J Radiol 2005 ; 56 ( 1 ): 66 – 73 .
6. Leyendecker JR , Dodd GD 3rd Halff GA , et al . Sonographically observed echogenic response during intraoperative radiofrequency
ablation of cirrhotic livers: pathologic correlation . AJR Am J Roentgenol 2002 ; 178 ( 5 ): 1147 – 1151 .
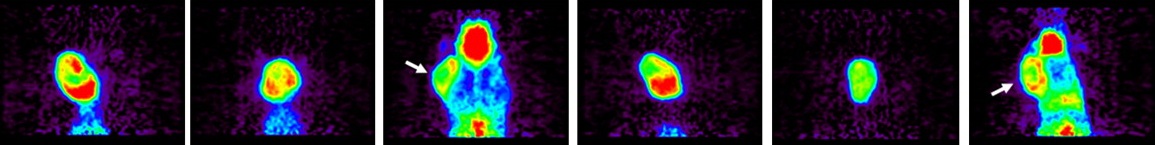
107. Mala T , Aurdal L , Frich L , et al . Liver tumor cryoablation: a commentary on the need of improved procedural monitoring . Technol Cancer Res Treat 2004 ; 3 ( 1 ): 85 – 91 . 39. Silverman SG , Tuncali K , Morrison PR . MR imaging-guided percutaneous tumor ablation . Acad Radiol 2005 ; 12 ( 9 ): 1100 – 1109 . 108. Permpongkosol S , Nielsen ME , Solomon SB . Percutaneous renal cryoablation . Urology 2006 ; 68 ( 1 suppl ): 19 – 25 . 109. Bao A , Goins B , Dodd GD 3rd, et al . Realtime iterative monitoring of radiofrequency ablation tumor therapy with 15O-water PET
imaging . J Nucl Med 2008 ; 49 ( 10 ): 1723 – 1729 .
110. de Senneville BD , Mougenot C , Quesson B , Dragonu I , Grenier N , Moonen CT . MR thermometry for monitoring tumor ablation
. Eur Radiol 2007 ; 17 ( 9 ): 2401 – 2410 .
| ||||||||||||||||||||||||||||||||||||||||||||||||