肝癌不断更新,更细其BCLC分期方案,在2022年更新了最新肝癌系统优化治疗方案。
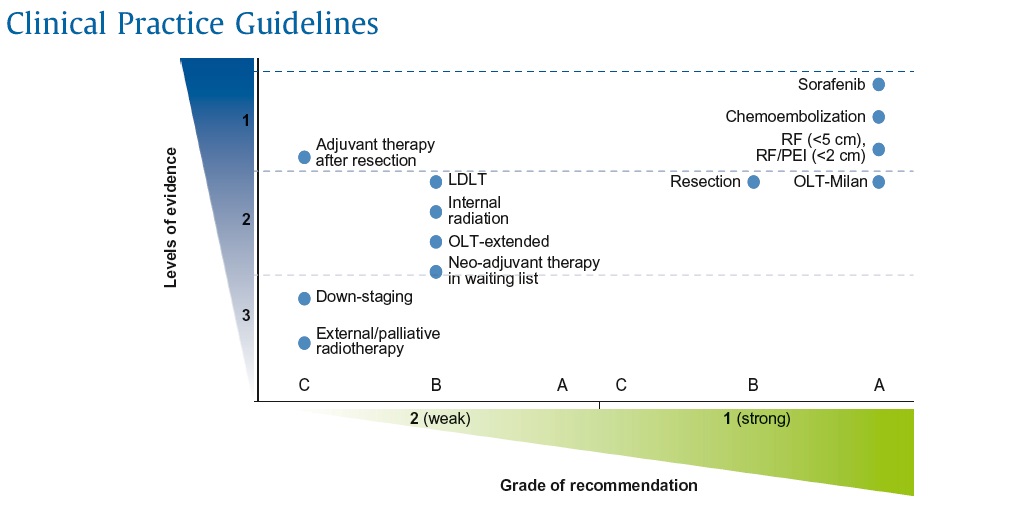
according to levels of evidence (NCI classification) and strength of recommendation (GRADE system).
在发达国家,由AASLD和EASL所建议的HCC监测、诊断和治疗指南应该是得到应用的【15,48】。然而不幸的是多数HCCs发生在只有医疗资源不充分的发展中国家。最有效的疗法通常在这些地区不是可利用的, HCC在一些地方成为沉重和潜在经济负担。例如,在亚洲和撒哈拉以南非洲,这些地区HCC是常见病和死亡的主要原因之一。因此,为了改善HCC的发现和治疗,要求特定资源环境下的特定策略(下表)。
在医疗资源处于中等环境的地区(包括中国农村,甚至美国的阿拉斯加)或低医疗资源环境的撒哈拉以南非洲,为了降低HCC疾病的经济负担,肝癌的治疗策略焦点应集中在乙肝疫苗的普遍接种,为人们提供如何预防医源性乙肝病毒感染,改善食物储存防止黄曲霉毒素污染和有效的抗病毒治疗等方面的卫生保健教育。HCC家族史或/和HBV和HCV测试应用于识别高危人群。在此类人群中,在有条件的地区以超声为主要手段的定期筛查对于发现早期肝癌十分重要,肝癌的早期发现有潜在的治愈可能。除了超声以外,提高监视、诊断水平和构建PEI、RFA和肝切除的基础设施和能力是在医疗和经济水平欠发达地区的关键和重要的步骤。最后,因为在这一地区多数肝癌被发现时已经是晚期,医保部门应与相关厂家合作,努力提供相对便宜的靶向治疗药物(例如sorafenib),在庞大的疾病人群和医保资源中寻找各方利益的平衡点应成为一种可能。 肝切除术
由于肝细胞癌非常差的预后,一直以来许多研究的努力希望提出一个有效的治疗策略去治愈这一疾病。像多数实体瘤一样,外科手术切除是HCC的主要治疗手段,目前受到局部消融治疗的挑战,但仍然扮演者肝癌治疗潜在治愈方法的主要角色。特别是无肝硬化的局限性HCC患者的首选治疗。这取决于肿瘤的大小和数目,也取决于肝功能的储备状况。【Reig M 2022;Citterio D 2016;Tsilimigras DI 2019】
甚至对“外科肝癌”的定义很大程度上是经验性的或很江湖的。 门静脉高压的影响:
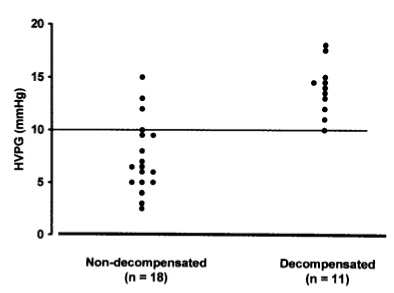
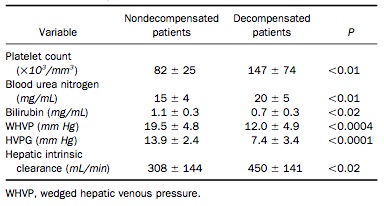
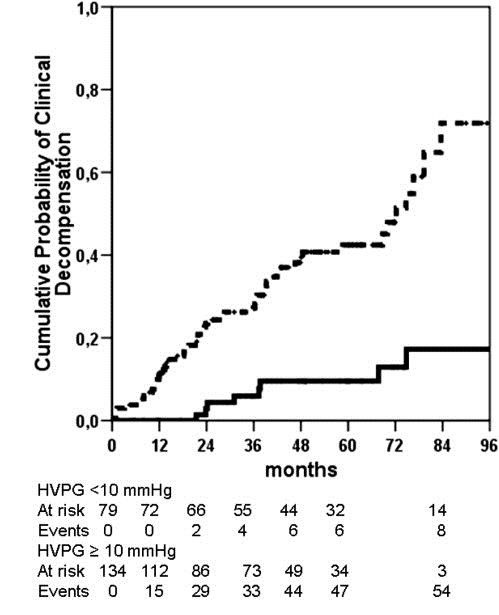
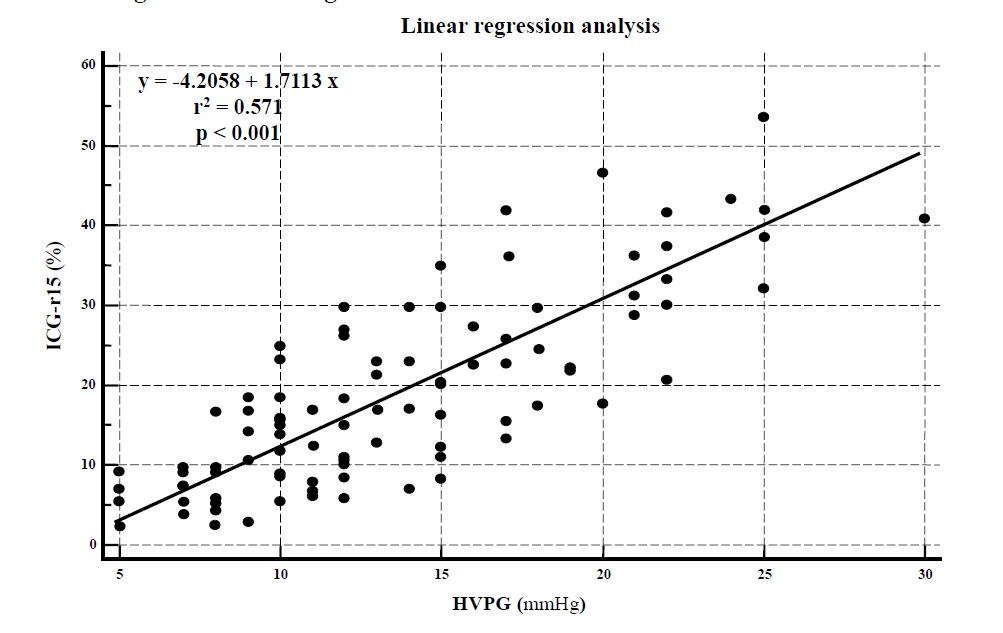
一旦HVPG≥10mmHg,被定义为有有临床意义的门静脉高压(Clinically Significant Portal Hypertension ,CSPH) )与肝衰竭的风险相关,最好通过肝静脉压力梯度测定【Berzigotti 2015】
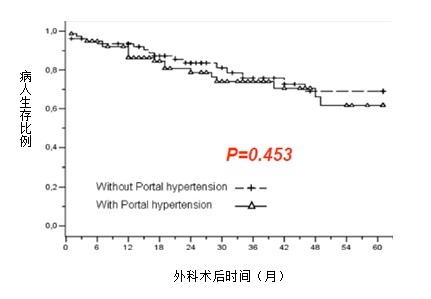
在一项对213例代偿性肝硬化和门脉高压的研究中,有门静脉高压,但无静脉曲张的患者随访时间中位数为51.1个月,基线HVPG ≤10 mmHg。在治疗过程中有90%的可能性不会进展到失代偿状态。在随访期间,≥10mmHg的肝硬化患者,治疗后失代偿的风险几乎是对照组的6倍(p<;0.001)【Ripoll C 2007】。研究表明 HVPG每升高1 mmHg,死亡率增加~3%,如果HVPG为15mmHg 患者的死亡风险比HVPG为5 mmHg的患者高30%(上图)【Ripoll C 2005】。
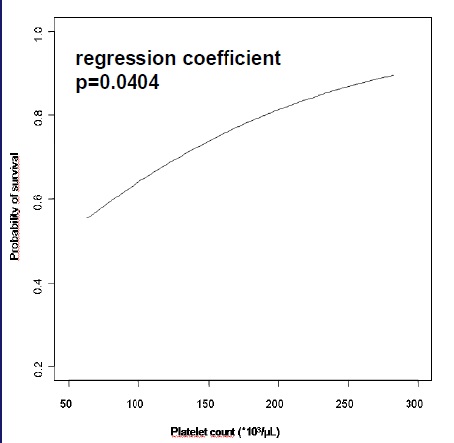
血小板的影响血小板作为持续变异因素
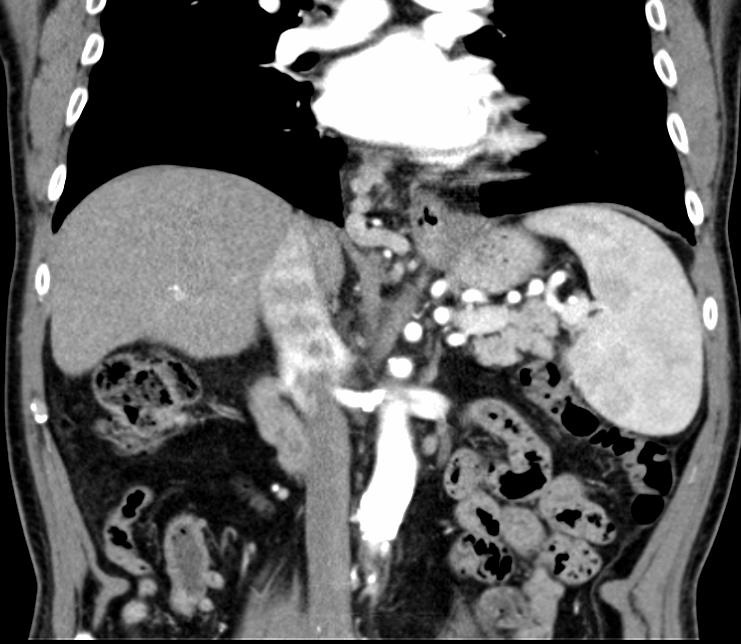
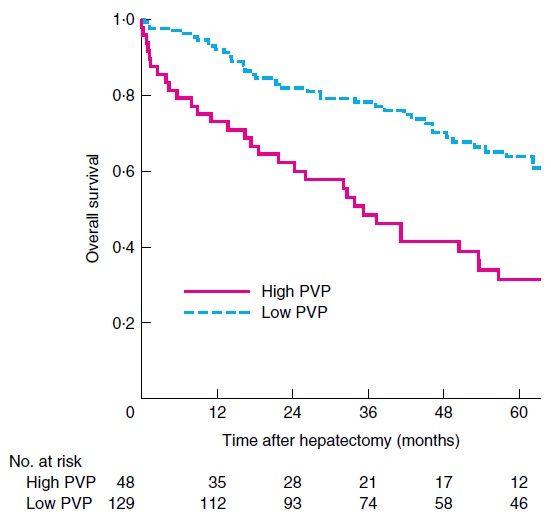
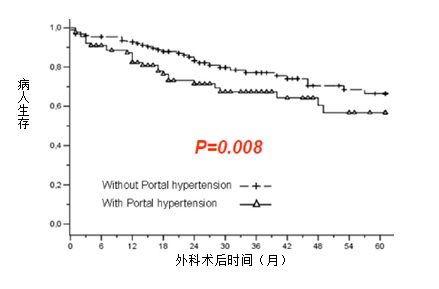
门静脉高压影响241例进行肝癌肝切除病人:倾向评分分析(propensity score analysis)The influence of portal hypertension
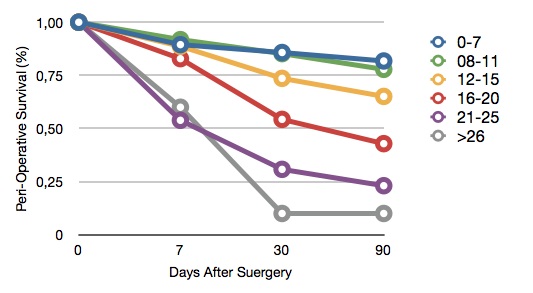
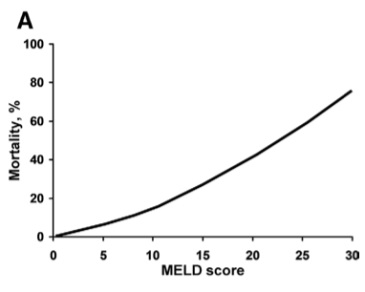
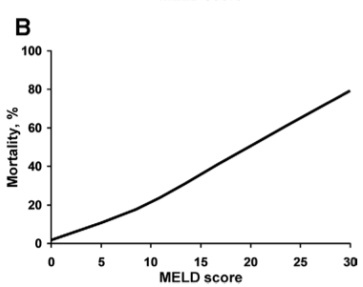
Liver Surgery in patients with Cirrhosis (MELD)
MELD 评分,年龄和ASA分级可以独立于操作的实施,定量肝硬化病人术后死亡率的危险。进行大外科手术的肝硬化病人,手术7日内死亡风险取决于ASA 分级的评估,而7天后最好由MELD评分决定。 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
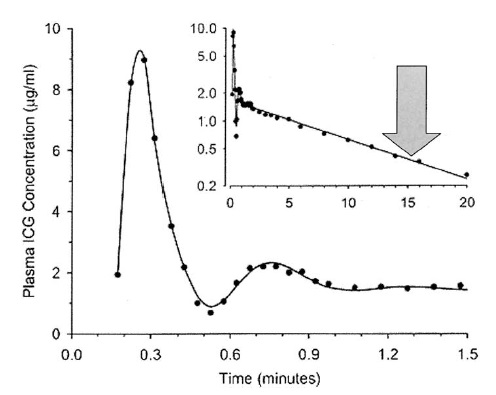 |
ICG test - Japanese Guidelines【64】
 |
 |
| ICG 15'试验是评估代偿肝硬化病人门静脉高压评估的有效工具 |
残余肝
多少残余是足够的?
 |
 |
| 20~30% | ?~40% |
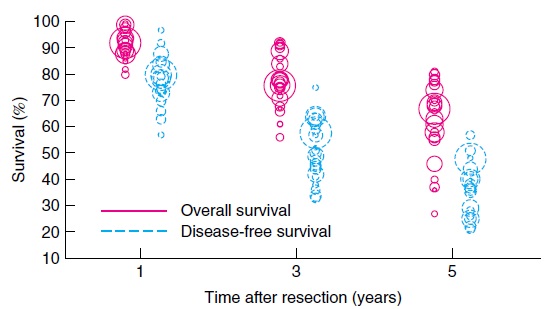
系统回顾(systematic review)米兰(MC)标准内肝功能Child-Pugh A-B患者肝切除情况,收集2000-2010年间,29片文章,中位手术死亡率0.7%(0-5%),中位5年总生存期(Median 5-yr OS)67%(27-81%),中位5年无病生存期37%(21-57%)。
 |
 |
| 生存率向好的方面改进 |
若术前严格挑选适宜患者,那么切除术和肝移植可以获得最佳治疗效果(5年生存率为60%-70%),成为早期肿瘤患者的首选治疗措施。
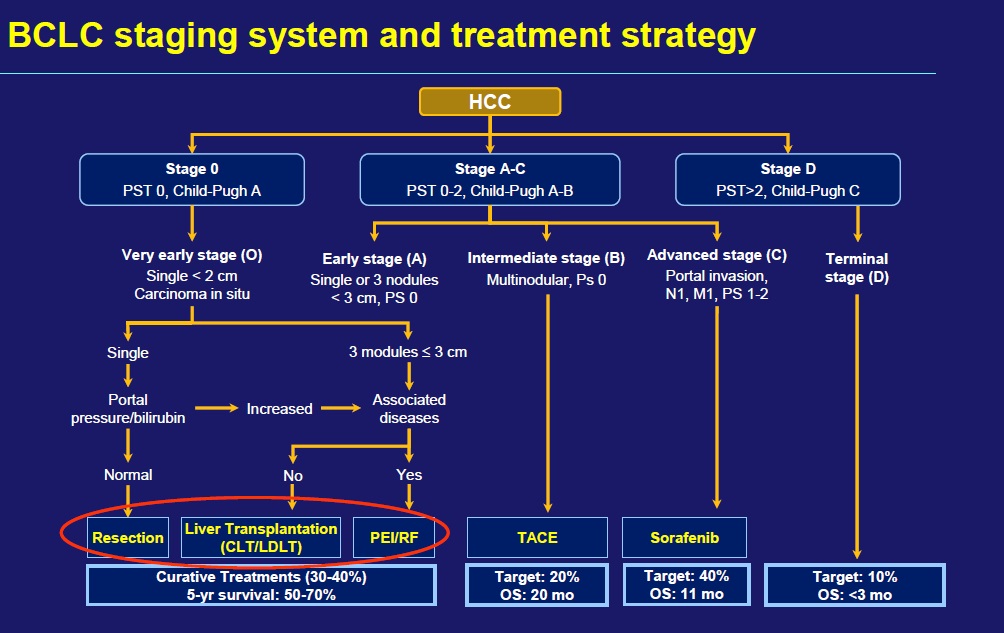 |
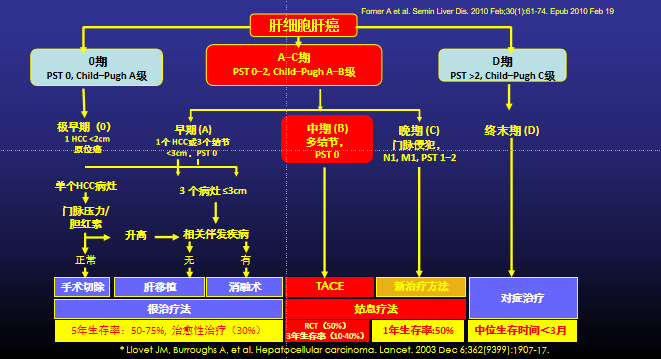
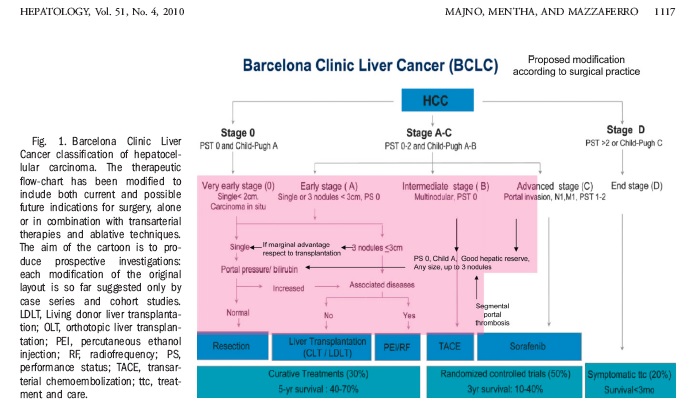
| 巴塞罗那分期对早期肝癌的定义和治疗选择和它的效果 |
肝脏局部切除术是非肝硬化HCC患者的首选治疗,目前在西方国家,这部分患者占所有患者的5%,而亚州则为40%。大部分的肝脏切除术发生致命性并发症的概率并不高。事实上,只要有足够肝功能储备,局限于肝脏内的肿瘤均可通过手术完全切除。一些大型病例系列报告术后患者5年生存率为30-50%,相关综述见其他文章。
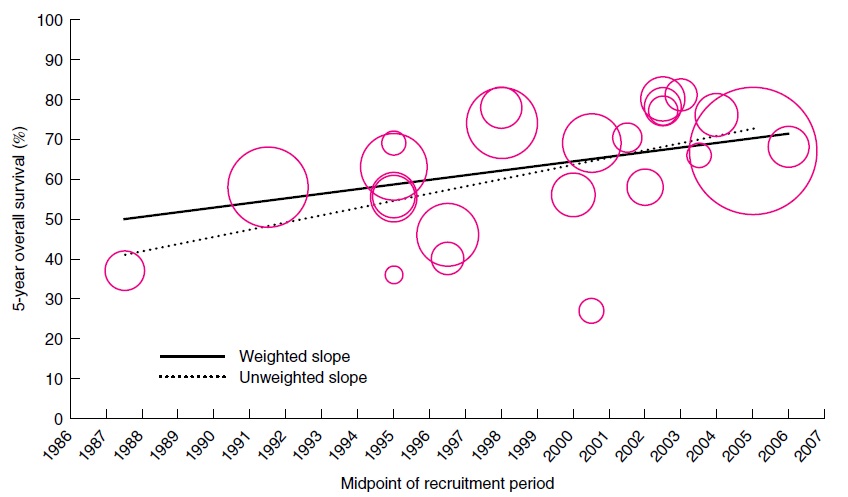
全美肝癌外科切除的趋势(1988-2008)
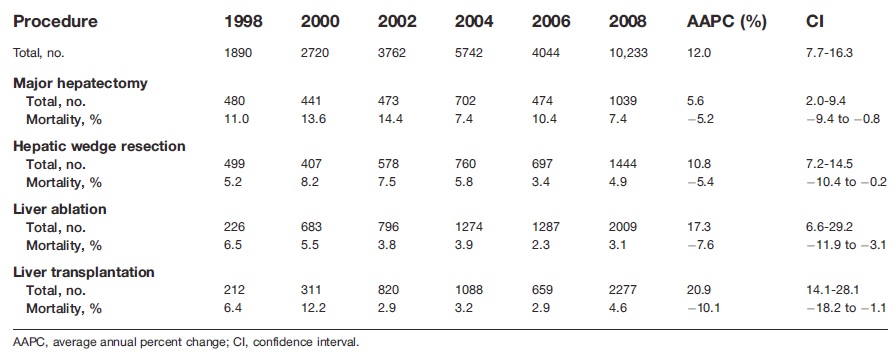 |
| 在表内所示的时间段内,肝切除逐渐向肝移植方向移位,尽管患者的年龄和伴发病增加,而病人的死亡率已经从7.3%下降到4.6% |
肝硬化患者的HCC切除术则需要仔细选择患者,即详细了解患者的疾病分期,术后患病率和死亡率的相关危险因素,肿瘤复发和生存时间,以及确保熟练的手术操作技巧。上述两项因素的不断进展改善了治疗效果。现在,手术患者的选择已经有了非常明确的定义,而超声刀、Pringle法等手术技术的开发以及术后即时管理等方面也已经得到优化。另外, Couinaud等人提出的解剖性切除术的应用使外科医生能根据合理的肿瘤学原理而实施手术治疗。
非解剖接触可以保存肝功能,但缩小外科切缘与较高的局部复发率相关。现代文献支持解剖切除超过非解剖切除。
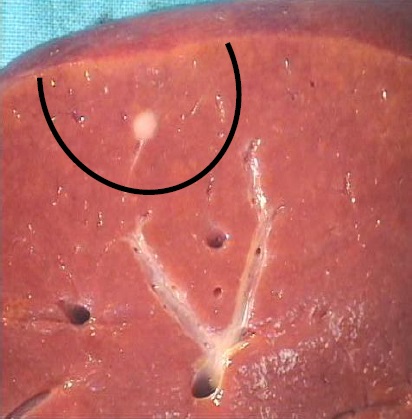 |
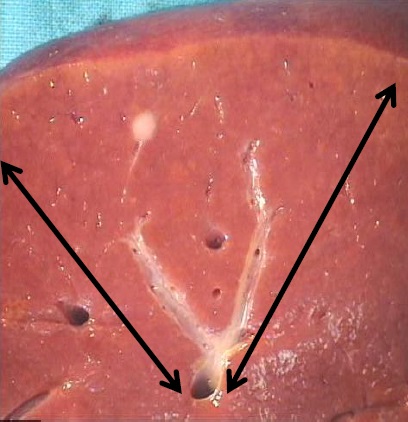 |
| 非解剖切除 | 解剖切除 |
由于上述进展,肝硬化HCC患者手术成功的现有标准包括:围于术期死亡率小于3%,需输血治疗的比例小于10%, 5年生存率至少达到50%[30]。实际上,在大多数转诊医院,围手术期死亡率已经从80年代的15%下降到现在3-5%。一些研究中心报告的围手术期死亡率已经降至零,一项在巴塞罗那研究称对100名肝静脉压力梯度≤10mmHg的单发结节肿瘤患者进行手术治疗的结果一致。失血量可从以下两方面进行控制:仔细选择肝功能储备良好的患者;肝实质切除过程中间断阻断入肝血流。通过上述措施,20年间输血率己从80%-90%降至不到10%。
选择理想的手术患者涉及到对肝功能储备和肿瘤范围的准确评估。术后生存和复发情况的主要预测因素见表2。术后生存时间和复发率的主要预测指标已经从以前根据Child-Pugh3J级粗略估计发展至更为精确的评价方法,如日本采用的15分钟时吲跺绿储留率(ICG15)[59]或西方国家采用的肝静脉压力梯度(Hepatic venou pressure gradient, HVPG)≥10mmHg作为门静脉高压相关的直接衡量值)[60]。如果以HVPG<10mmHg, ICG15≤20%,或者无门静脉高压体征(食管静脉曲张,或者脾大伴血小板计数< 100,000/mm3)为指征,患者的可切除率不到10%。一些研究组在肝大部切除术前采用门静脉栓塞(PVE)术阻断供应待切部分肝脏的血管分支,以增加残留肝脏的血供。这一方法的有效性尚未经大型对照研究证实。
|
表2 HCC的肿瘤切除术
|
||
|
作者
|
患者数
|
变量
|
|
生存时间
|
||
|
L lovet[31]
|
77
|
门静脉高压(是/否)
|
|
|
|
胆红素( <1/>1mg/dU
|
|
Zhao[52]
|
1000
|
肝硬化(是/否)
|
|
|
|
γ-GT
|
|
|
|
肿瘤数目(孤立vs多发)
|
|
|
|
门脉血管浸润(是/否〉
|
|
Vauthey[53]
|
557
|
肉眼和显微镜下血管浸润(是/否)
|
|
|
|
肿瘤数目(孤立vs多发)
|
|
|
|
肿瘤大小<5cm,>5cm)
|
|
|
|
肝硬化( Ishak评分) 0-4 VS. 5-6
|
|
Poon[54]
|
518
|
大血管浸润
|
|
|
|
微血管浸润
|
|
|
|
肿瘤大小>5cm
|
|
|
|
多发/多叶肿瘤
|
|
|
|
肝硬化
|
|
|
|
AST>50U/L
|
|
|
|
临近脏器浸润
|
|
IkaI[11]
|
12118
|
肿瘤大小(≤2cm,2~5cm,5~10cm,>10cm
|
|
|
|
肿瘤数目(孤立VS多发)
|
|
|
|
AFP水平(<20,20-200,200-1000,>1000ng/mL)
|
|
|
|
肝损害的程度(A,B,C)
|
|
|
|
血管浸润(是/否)
|
|
|
|
手术治愈情况(是/否)
|
|
复发
|
||
|
Belghiti[55]
|
47
|
肿瘤发小
|
|
|
|
AFP水平
|
|
Kumada[56]
|
57
|
AFP水平
|
|
|
|
多结节HCC
|
|
|
|
肿瘤大小
|
|
L lovet[31]
|
77
|
分化程度
|
|
|
|
多结节
|
|
|
|
卫星病灶
|
|
Imamura[57]
|
|
|
|
早期复发(<2年)
|
123
|
血管浸润
|
|
|
|
AFP水平
|
|
|
|
非解剖性切除术
|
|
晚期复发(>2年)
|
61
|
多结节
|
|
|
|
肝炎活动度
|
|
|
|
HCC大体分期
|
|
Ereolani[58]
|
224
|
结节数目
|
|
|
|
AST水平
|
生存时间和复发的独立预测指标的病例系列分析(使用多元变量分析法)
血管侵润
血管浸润是目前已知的肿瘤复发和生存时间预测指标,与组织学分化程度,主要结节的大小程度等直接相关。特别是,直径2cm的肿瘤结节约20%病例有镜下血管浸润,而直径2~5cm和直径超过5cm的肿瘤结节则分别约有30%-60%病例和60%-90%病例出现镜下血管浸润。
值得注意的是,在直径2cm这一截点之前就可出现肿瘤侵润。Kojiro 分析了106例直≤2cm的手术切除的HCC,并将其分为不伴局部浸润的不清晰型(indistinct type)(平均大小: 12mm)和具有局部浸润的清晰结节型(distinct type)(平均大小: 16mm)。后一类型中约10%可在肿瘤结节周围找到卫星病灶,并且25%患者可发现显微镜下门静脉浸润。超声检查可以同时发现这两种类型肿瘤,但是C丁扫描时只有后者显示高血供表现,这证实了以下发现:早期肿瘤只有门静脉供血故血管造影无法显示肿瘤血管染色,而晚期HCC则可看到肿瘤血管染色。极早期HCC相当于BCLC分期的0期 和日本分期的H0。
有研究者提出最早期的肝癌临床表现(极早期HCC)应该包括Child-Pugh A级的原位癌患者。这些患者在肝癌切除术后的5年生存率可达90%,其肿瘤复发率极低 (3年肿瘤复发率为8%) 。在切除术前需要用最先进的CT扫描或者MRI对肿瘤范围进行评价。然而,即使采用最先进的成像技术进行评价,也有30%的病例会出现低估肿瘤病理分期的现象。术中超声检查(IOUS)可以发现直径在0.5至1cm范围的肿瘤 结节,被认为是切除额外结节和指导解剖性切除的标准方法。以下3项指标逐渐发展为预后因素:肿瘤大小,肿瘤数目和血管浸润的出现。日本全国性调查(一个涉及数千名患者的病例系列研究)发现,直径小于2cm是患者生存时间的独立预测指标。
直径≤2cm的HCC患者的5年生存率为66%,而直径2~5cm患者为52%,肿瘤直径>5cm患者的5年生存率则为37%。在同一项研究中,单结节肿瘤切除术后的5年生存率为57%,而3个或更多结节切除术后的5年生存率为26%。
外科切除术是HCC的一种潜在治愈性治疗。但据估计不管是肝切除术还是局部消融,肝癌患者(≤3cm)能够得到这种治愈性治疗的机会仅为10%。随着对高危病人的常规普查的普及,更多的小肝癌将会被发现并得到根治性的治疗。然而,病人切除术后的残余肝脏组织仍然是肝癌生长的危险土壤,并且五年残肝再复发率的风险超出70%[18]。抗复发治疗的研究对未来肝癌研究是另一项严峻的挑战。
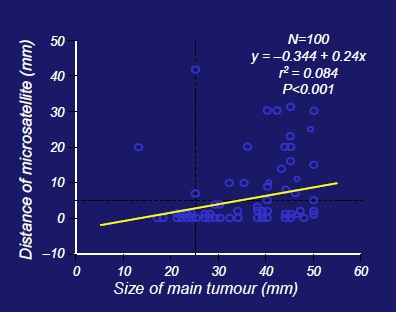
Presence of microsatellites even in early HCC
 |
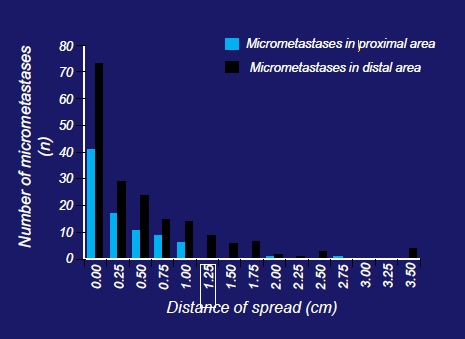 |
甚至在肝癌的早期都可以有微卫星灶存在。微转移/微卫星病变可以通过肝癌早期门静脉分支的侵犯得到传播,甚至主肿瘤是孤立和小病灶的时候。
外科切除术的病人的肝功能储备和肿瘤的范围应该得到详尽的评估,小心地谨慎地选择治疗的适应症。估计肝储备,在中国台湾地区和日本多选用靛氰绿滞留实验(indocyanin green retention test,ICG test)和门高血压的临床表现(即血小板减少症、脾大和食道静脉曲张),而在西方国家高的胆红素为标准[19]。终末期肝病模型评分(Model for End Stage Liver Disease score)<8时也反映肝功能储备功能良好,也是低围手术期死亡率和长期生存的很强的预后警示因素[20]。动态增强CT或MRI常应用于肿瘤范围的解剖学划界。当肿瘤有血管侵犯和转移时不推荐外科切除手术。虽然增大的肿瘤体积和肿瘤数目的增加与外科术后复发率增加相关,但并不排除病人肿瘤可切除并且肝功能储备良好时进行外科手术。
肝移植术
肝移植一直以来被用来治疗有选择的肝癌病人。但是直到90年代中期,治疗的结果令人失望。报告中的5年生存率在30%~40%之间。1996年,Mazzaferro和他的同事发表了重要文献,证实肝癌早期病人,不可切除性肝癌病人4年最佳存活和低复发率。这就是后来形成的著名的肝癌肝移植米兰标准(孤立性肿瘤<5厘米或3个病灶,每个病灶小于3cm)。
原位肝移植是多发性小结节肿瘤患者(3结节<3cm)或者严重肝功能异常患者的首选治疗[4,31],是治疗肝癌的最确定性治疗。这种治疗需要有高度密集优质医疗资源。肝移植理论上可同时治愈肿瘤和原有肝硬化,不仅因为它切除了恶性病变,而且也切除了整个患有肝硬化的肝脏,否则就会有癌症复发的高风险。20年前,较为宽松的肝移植备选标准导致其治疗效果欠佳,复发率高达32%-54%,而5年生存率<40%,这些经验帮助研究者们最终确定了目前肝移植的最适宜候选者:单一HCC≤5cm或结节数目≤3且直径均<3cm。这部分患者在大型医疗机构接受肝移植后的5年生存率可达70%,复发率低于15%【30,31,33】。这一治疗的主要局限在于缺乏肝源。 等待肝源时间的延长导致候选患者在移植术前的退出率达20%。根据意向性治疗分析原则将对治疗结果造成不利影响。大多数研究中心都会在等待肝源期间给予辅助治疗以延缓肿瘤进展。由于仍缺乏足够的随机对照研究证据,目前关于经皮消融、化学栓塞或者化疗等潜在获益信息均来源于观察性研究和成本效益分析的结果(3iiDiii)。
肝癌患者被认为必须符合米兰标准(单个肿瘤直径<5厘米或3个病变最大直径不超过3公分)才有肝癌肝移植的资格。使用这些标准的肝癌病人接受移植,结果类似长期存活非肝癌肝移植的适应症的病人[21]。肝癌肝移植加州旧金山大学标准(单结节不大于6.5厘米,或最多三个病灶,其中最大的是4.5厘米或与直径总和小于8.0厘米),以及最近的“up to seven”标准(肿瘤的大小和数量的总和为7)也已被提名为扩大肝移植的选择标准[22,23]。比较米兰标准,这些都是为肝癌患者设置的更具包容性的肝移植标准,而又不损害其远期疗效。这些建议尚未得到器官共享联合网络(United Network for Organ Sharing ,UNOS)的普遍实施。对于不符合米兰标准的肝癌,可进行局部治疗,以减少肿瘤的大小和数量,这种“向下分期(down-staging)”也可能使肝移植获得成功【24,25】。
活体肝移植率先在亚洲国家开展,主要是由于肝癌患者较多而来自尸肝捐助者的肝脏短缺。这一策略已在世界各地成功得到复制,尽管捐赠者并发症风险(5-20%)和死亡率(0.28%)较高,而且接受肝移植患者肝癌复发的危险增加(尸肝移植为5-15%;活体肝移植为20-30%)[26,27]。目前,尚不清楚为什么活体移植肝癌复发率高,似乎是因为等待接受移植期间患者肝脏肿瘤侵润生长,而在这种情况下的患者是不会有资格接受尸肝移植。接受活体移植患者也往往比接受尸肝移植的患者的肿瘤侵润更广泛。此外,部分肝脏移植体的肝再生的液环境似乎增加活体移植复发的危险。尽管复发的风险较高,由于尸肝捐赠者有限,特别是在亚洲国家活体移植仍广泛进行。
等待移植轩源的患者
表4总结了对于等待肝移植患者进行新辅助治疗评价的主要研究。所有数据均来源于病例系列研究、病例对照研究和队列研究,结果表明射频消融(RFA)可获得最高的完全坏死率(12%-55%[81~83],而肝动脉栓塞化疗(TACE) 仅为22%-29%[ 84-88]。经皮消融术对直径小于3cm的肿瘤可获得最佳完全坏死效应。不过,这些治疗对于等待移植过程中的退出率、复发率、及生存时间的影响目前仅通过一些非对照研究得到评估。
根据一些初步研究报道,预计等待1年时的退出概率为15%_30%[31,89]。在所有的病例系列研究和队列研究中,有报道提出新辅助可有效减低退出率。如Mazzaferro的研究显示,50例符合Milan标准(平均直径: 27.5mm; 41例为单一病灶)的患者在接受了单次RFA治疗后无一例退出移植名单[50]。有研究报道符合Milan标准的患者在接受TACE治疗并等待较短时间时(178天)无人退出等待名单;而其他一些研究则显示患者在接受相同治疗但等待较长时间后(211天)有不同结果: 6月时的累计退出率为15%,12月时的累计退出率为25%[86] ;上述事实反映了这些研究数据的异质性[85]。仅少数非对照研究表明符合Milan标准的患者接受RFA治疗后的退出率略有降低。这些新辅助治疗对于较大肿瘤的效果甚至更不确定。由于这些针对等待移植患者的新辅助治疗的研究都是非对照方式,这些治疗对于肝脏移植(LT)后生存率的影响很难准确评价。从Majno等人[84]的首个研究报道之后,有两项相关病例对照研究(法国,n =200;美国,n = 60)发现治疗组与对照组间的生存率大致相同[87,88]。与是否接受新辅助治疗相比,复发率与肿瘤分期的相关性更大。众所周知的是,符合Milan标准患者的复发率相对较低【30,31,33】,而一旦超出Milan标准复发率则相对较高,与几个研究者所报道的结果一致(复发率> 30%-50%) 【30】。
对于超Milan标准以及针对Milan标准的降期处理(downstaging)已经进行了大量的综述分析。总体的概念为:任何新的扩展标准的建立必须通过大量临床实践的验证支持。由于新的标准可能对所有移植部门产生重要影响,所有要求支持任何改变的数据都应该是完美无缺的。根据我们所知,扩展后的UCSF标准一大概涉及等待名单5%的患者[89]。目前仍然只是基于小部分患者的资料(n=24) [90],而且已经受到来自影像学[91]和病理学观点的挑战( Mazzaferro等人的Metroticket项目,共纳入901例超出Milan标准接受肝移植术的HCC患者,数据未发表)。这一标准的主要问题是,对于等待名单中界于现有标准和扩展标准的之间的HCC患者,尚缺乏总体生存率和退出率的相关数据。在降期处理方面,目前尚没有RCT或者大型病例对照研究的数据。同样也缺乏来源于设计良好的队列研究(患者接受持续治疗和适宜随访)的恰当资料。迄今为止,已报告的前瞻性病例系列研究所纳入的患者人数不足50例,仅此一项就使我们无法将此作为临床实践的标准治疗。因此,目前尚需通过临床研究对降期处理进行评价。
表4 针对肝移植等待名单上患者的各种治疗效果的相关研究
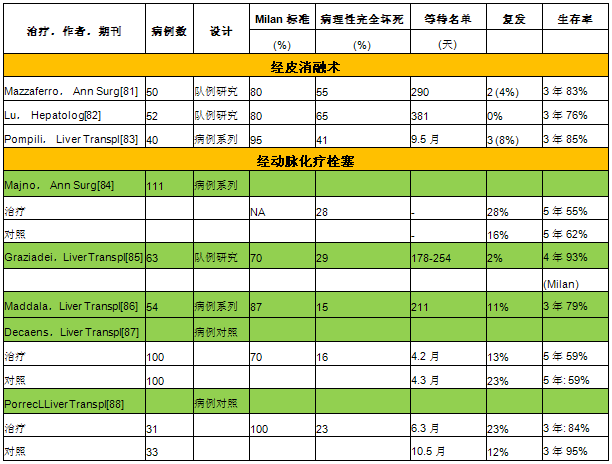
微创外科
在常规临床实践中,无腹水、无胃门体静脉曲张(portosystemic varices)和血小板计数> 100,000常被用作无门静脉高压的无创替代指标【Franchis 2022】。随着术中和围手术期管理的进步,微创外科(MIS) 方法的引入扩大了患者接受手术切除的条件。MIS方法 (包括腹腔镜和机器人辅助肝切除术) 被广泛用于解剖位置有利的小范围肝切除术,但这些技术用于大范围肝切除术通常仅限于较大的医疗中心。
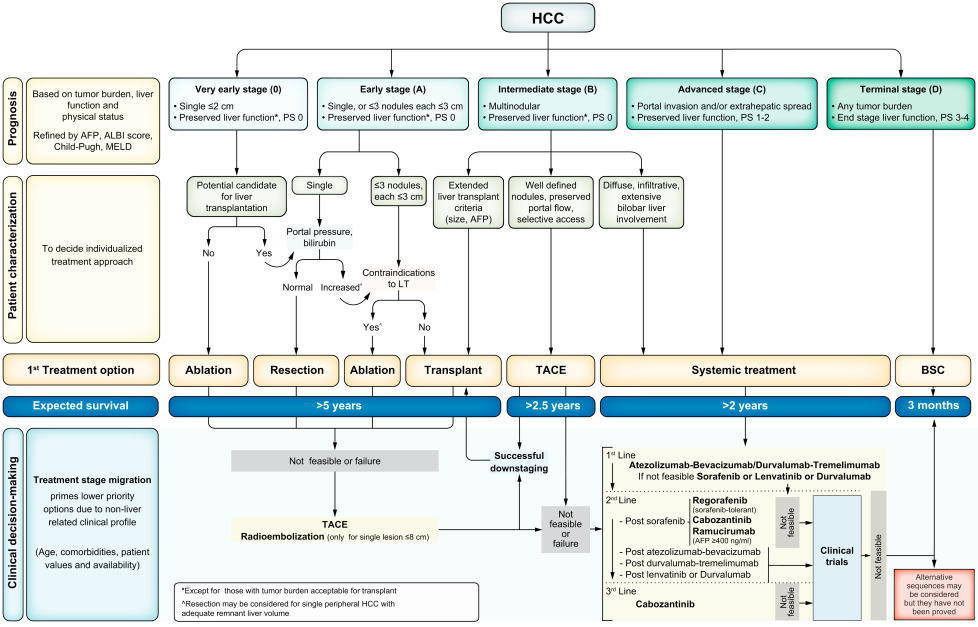
评估(新)辅助酪氨酸激酶抑制剂(TKI)的研究未能显示RFS和OS改善【Bruix J 2015】。IMBrave 050试验是第一项证明辅助治疗有益的试验。在这项开放标签的随机临床试验中,12个月的阿替利珠单抗和贝伐珠单抗辅助治疗显著改善了高危患者的无复发生存期。最近的1 ~ 2期研究也提示,新辅助免疫检查点抑制剂 (如卡博替尼+纳武利尤单抗和纳武利尤单抗±伊匹单抗) 可使30% ~ 40%的患者产生明显的病理缓解,但我们需要3期数据来确定这些疗法可否改善RFS和OS【Kaseb AO 2022;Ho WJ 2021】
肝移植
在1996年发表的一篇开创性文章中,Mazzaferro等【Mazzaferro V 1996】将米兰标准定义为提供最佳的移植后结局,5年生存率超过70%,5年复发率约为10%。从那时起,肿瘤负荷较大的几项标准(包括加州大学旧金山分校标准、UP to 7项标准、扩展的多伦多标准和京都标准)也被证明可获得可接受的移植后结局。在就诊时肿瘤负荷以外,对局部区域治疗(LRT)的应答和肿瘤负荷的变化越来越多地用于确定肿瘤生物学良好的患者。在超出米兰标准,但在HCC肿瘤大小和数量限定范围内的患者中,成功降期至米兰标准的患者的移植后结局与符合米兰标准的患者无显著差异。一项随机对照试验(RCT)纳入了74例超出米兰标准的患者,试验降低了分期,随后随机分配接受LT和非移植治疗,据报道,LT组的5年生存率为77%,其他组为31%(风险比,0.32;95% ci, 0.11 ~ 0.92) 根据这些数据,对于初始肿瘤负荷超过米兰标准的患者,可考虑降期至符合米兰标准后进行肝移植。然而,降期策略必须注意实用性,包括在随访评估期间对初始肿瘤分期和治疗应答的准确评估,包括要求持续缓解≥6个月以确保最佳结局【Tran NH 2022】。在美国,器官共享降期联合网络(United Network for Organ Sharing Down Staging) 标准定义了为优先接受死亡供体肝移植而降期的上限。虽然超出这些标准的患者仍可接受活体肝移植,但放宽标准导致了较高的等待名单退出风险、较高的移植后复发率和较低的移植后生存率【Mazzaferro 2017】。除肿瘤负荷外,包括AFP在内的血清生物标志物也具有预后价值,即使AFP水平低水平升高也与肝移植后复发增加相关【Duvoux 2012】。AFP水平显著升高 (例如大于1,000 ng/mL)的患者必须达到较低的治疗后水平才能获得可接受的移植后结局,但所需降低的幅度需要验证。确定最佳肝移植标准的研究正在进行中,这些标准可使最大数量的HCC患者获得可接受的肝移植后结局,并使移植获益最大化。
Examples of Expanded Criteria for Liver Transplantation
| Expanded criteria | |
| UCSF criteria | One tumor ≤6.5 cm or 2–3 tumors, each ≤4.5 cm, with a total tumor volume of ≤8 cm |
| Up-to-Seven criteria | Diameter or largest tumor (cm) + number of tumors ≤7 |
| Extended Toronto criteria | Biopsy specimen showing well to moderate differentiation for patients beyond Milan criteria and ECOG performance status 0–1 |
| Total tumor volume <115 cm | Sum of volume for each tumor, ≤115 cm |
| Kyoto criteria | Number or tumors, ≤10; maximum diameter of each tumor, ≤5 cm; and serum DCP level, ≤400 mAU/mL |
| 5-5-500 rule | Number of nodules, ≤5; nodule size, ≤5 cm; and AFP level, ≤500 ng/mL |