Phase III Clinical Trial
Evaluating TheraSphere® in
Patients with Metastatic Colorectal Carcinoma
of the Liver who have Failed First Line
Chemotherapy (
EPOCH)

TARE in 2nd-line?肝脏是结直肠癌最常见的转移灶,约8%的结直肠癌肝转移不可切除。对于这类肝转移患者,局部治疗联合系统治疗较单独系统治疗临床获益更为显著。本研究探索了经动脉钇-90 放射栓塞(TARE)联合全身化疗用于结直肠癌肝转移二线治疗的安全性和有效性。
到目前为止结直肠癌转移性病变 TACE vs TARE结果非常相似
EPOCH随机分组方案:这项Ⅲ期临床研究入组一线治疗进展的结直肠癌肝转移患者,按1∶1 的比例随机分组,给予二线化疗加或不加玻璃微球TARE。主要入组标准包括:≥18岁;单叶或双叶不可切除病灶;可耐受伊立替康或含铂化疗的二线治疗;RECIST 1.1评估的可测量病灶;ECOG PS 0/1;胆红素<1.2且不高于正常值;白蛋白≥3.0gm/dL。
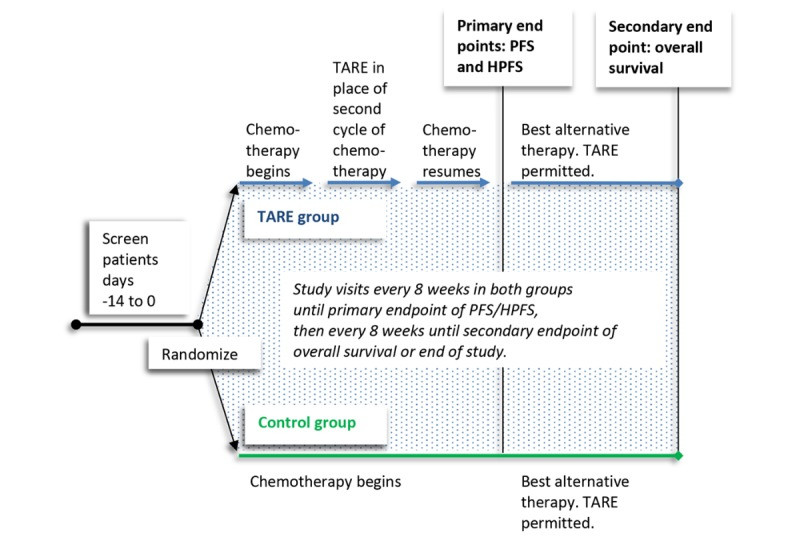 |
|
TheraSphere 微球研究的临床试验随机分组方案。符合条件的患者对既往化疗和生物制剂有至少14天的洗脱期。在随机分组后21天内开始二线化疗。对照组:允许在二线化疗周期开始使用生物制剂。TARE组:在TARE前至少28天停用生物制剂,直到TARE后发生的第一个二线化疗周期才允许使用。HPFS:肝无进展生存期PFS:无进展生存期TARE:TheraSphere™微球经动脉放射栓塞。 |
主要研究终点为盲态独立中心审评(BICR)无进展生存(PFS)和肝脏PFS(hPFS);次要研究终点为总生存(OS)、症状进展时间(TTSP)、BICR评估的客观缓解率(ORR)和疾病控制率(DCR)等。 抗癌管家-康爱管家,我们一起抗癌,治愈癌症不是梦。分层因素包括单叶/双叶病变、奥沙利铂/伊立替康为基础的一线化疗和KRAS突变状态。
研究共纳入94个中心的428例患者,按1:1随机分配至TARE+化疗±靶向治疗组(n=215)或化疗±靶向治疗组(n=213),化疗方案为伊立替康或含铂化疗。
|
|
中位PFS(月) |
PFS% |
中位hPFS |
|
6个月 |
12个月 |
18个月 |
|
TARE 组 |
8.0(95% CI,7.2~9.2) |
65.2% |
25.8% |
16.7% |
9.1(95% CI, 7.8~9.7) |
|
化疗组 |
7.2(95% CI,5.7~7.6) |
55.4% |
13.2% |
1.8% |
7.2(95% CI,5.7~7.6) |
PFS的风险比(HR) 为0.69(95% CI,0.54~0.88;单侧P=0.0013)
分别为和个月,hPFS的HR为0.59(95% CI,0.46~0.77;单侧P<0.0001)。
亚组分析显示,与 TARE联合化疗PFS获益相关的关键性特征包括:伴有KRAS突变、肝脏肿瘤负荷≥10%且≤25%、<3处病灶、原发灶为左侧(FOXFIRE是右侧原发结肠癌获益)、另外再联合生物治疗。
美国西北大学的Mulcahy教授在9月16~21日线上ESMO'2021口头汇报国际多中心EPOCH研究的结果,该研究发现,在结直肠癌肝转移二线全身治疗中加入放射栓塞治疗可显著延长患者无进展生存(PFS)和肝脏无进展生存(hPFS),
