经颈静脉肝内门体分流术(TIPS)
经颈内静脉门体分流术(TIPS)是指经颈静脉插管至肝静脉后,穿刺肝实质至肝内门静脉分支,将可扩张的金属支架植入后建立肝内门静脉与下腔静脉之间的分流道,以使整个肝外门静脉系区域的压力显著降低,从而达到治疗胃食管静脉曲张破裂出血和腹水等门脉高压并发症;其还可应用于Budd-Chiari综合征、肝性胸腔积液、肝肺综合征和门静脉血栓形成等。早在1969年,R?sch和他的同事尝试经颈静脉胆道造影术时无意地穿刺入门静脉,认识到血管内建立门体分流道进而降低门静脉压力的可能性[1]。之后,他们在动物实验中采用Teflon扩张器在肝静脉与门静脉之间构建肝内通道,并使用塑料管维持开通,证实了经颈静脉肝内门体分流术的可行性。1983年,Colapinto等应用球囊扩张插管在患者的门静脉与肝静脉之间建立分流道,并不放置任何装置维持肝内分流道,但疗效欠佳[2]。1985年,Palmaz将其设计的人工支架植入动物门静脉与肝静脉之间以维持分流道通畅,获得了良好的效果[3]。TIPS首次于1988年成功地应用在一例伴有胃静脉曲张反复出血的门静脉高压症患者,尽管手术有效地控制了再出血,但由于术前较差的肝功该患者于术后11天死于肝衰竭及呼吸衰竭[4]。上世纪90年代后期,聚四氟乙烯覆膜支架的出现大大地推广了TIPS的应用,其主要是将分流道血流与肝组织隔离,通过阻止胆汁向分流道漏出或肝组织向分流道内部生长,提高了分流道的远期通畅率[5,6]。目前,大量随机对照试验已证实TIPS在预防再出血及治疗顽固性腹水方面上明显优于内镜治疗及穿刺放腹水[7,8]。鉴于其低侵袭性、无需全麻及操作难度低等优点,TIPS在欧美国家已逐渐取代外科分流在治疗门脉高压症的地位[9-11]。
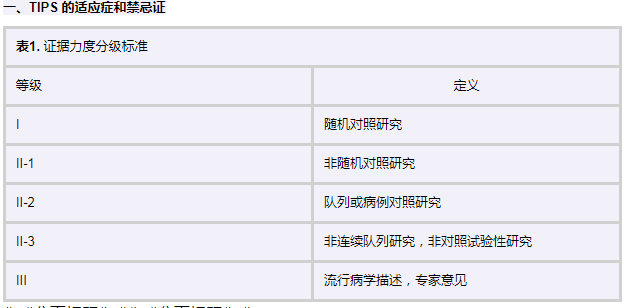
TIPS的适应证
适应证包括1)药物或内镜治疗无法控制的急性食管静脉曲张破裂出血(证据:I级);2)2周内接受二次内镜治疗,仍然反复发生的胃食管静脉曲张破裂出血(二级预防,证据:II-3级);3)胃静脉曲张破裂出血(证据:III级);4)顽固性腹水(4周内药物治疗、穿刺抽液无效或出现药物治疗的不良反应无法继续治疗) (证据:I级);5)Budd-Chiari综合征(证据:II-3级);6)顽固性肝性胸腔积液(4周内药物治疗、穿刺抽液无效或出现药物治疗的不良反应无法继续治疗,证据:II-3级);7)肝肾综合征(证据:II-3级);8)肝肺综合征(证据:II-3级);9)门静脉血栓形成(证据:II-3级);10)出血性门脉高压性胃病(证据:II-3级);11)肝移植术后(证据:II-3级)。
1. 急性静脉曲张出血
基于治疗方法和护理技术的进步,过去20年中,急性静脉曲张出血的死亡率从40%降低到了20%。急性静脉曲张出血的标准治疗方案包括血管活性药物、内镜套扎和抗生素等。急性静脉曲张出血患者就诊时,首先需要进行常规急救治疗。标准治疗失败后,则应该选择TIPS做救命治疗。外科分流手术和TIPS的作用原理相同。但是,由于急性静脉曲张出血的患者多处于病情危急、基础情况较差、凝血功能低平衡的状态,往往不能耐受外科手术带来的创伤和出血,因此外科分流手术只能应用于全身状态较好的患者。García-Pagán等人给急性静脉曲张出血高危患者做了一个实用的定义:Child B级有活动性出血或Child C级的患者[12]。他们发现:一组高危患者给予72小时内TIPS治疗,另一组高危患者给予标准治疗(NSBB+硝酸酯类+内镜套扎),接受TIPS治疗的患者再出血风险低(3%比 42%)、生存好(1年生存:87.5% 比67.3%),结果有显著性差异。而且,TIPS组肝性脑病的发生率也低于标准治疗组。之后,他们又进行了回顾性研究对此结果进行了验证[13]。当然,在推荐早期TIPS作为急性静脉曲张出血的一线治疗之前,还需在其他中心开展临床研究进行验证。
2. 预防再出血
第一次静脉曲张出血后,1-2年内再出血的发生率达60%,死亡率达33%。一荟萃分析总结了裸支架TIPS和内镜联合药物治疗在预防再出血方面的疗效。此研究中TIPS组再出血的发生率为9%-40.6%,内镜联合药物治疗组再出血发生率为20.5–60.6% [7]。TIPS降低了再出血的风险,但却使肝性脑病的发生率增加了2倍多。接受这两种治疗策略的患者在生存上无显著性差异。鉴于肝性脑病比再出血对患者生活质量的影响更大,美国肝病研究学会指南推荐药物联合内镜治疗为预防静脉曲张再出血的一线治疗,TIPS作为预防静脉曲张再出血的二线治疗[9]。因为在之前的研究中,TIPS手术使用的皆为裸支架,而覆膜支架大大的提高了支架通畅率甚至提高了患者的生存,所以需要新的研究来评价覆膜支架TIPS术和内镜治疗联合药物治疗之间的差异。
一项随机对照研究对比了裸支架TIPS和H型外科分流手术预防静脉曲张再出血的疗效[14]。TIPS组再出血率和死亡率分别为16%和20%,而外科手术组只有3%和30%。另一项随机对照实验比较了裸支架TIPS和远端脾肾分流手术的疗效[15]。远端脾肾分流组和TIPS组分别有5.5%和10.5%的患者出现再出血。TIPS手术在五年随访期间的成本效益比脾肾分流手术稍高。基于以上随机对照研究及成本效益分析,美国肝病研究学会推荐对于肝功能较好的患者,TIPS或外科手术都可以作为内镜联合药物失败后的二线治疗,而对于肝功能较差的患者,则倾向于选择TIPS作为二线治疗[9]。
3. 胃静脉曲张出血
胃静脉曲张出血的患者常常有较低的门静脉压力梯度。对于这些患者,分流降压治疗一般不能达到最佳的治疗效果。一项研究证明,TIPS只对术前门静脉压力梯度大于12mmHg的患者带来生存获益[16]。然而也有研究证实,TIPS在预防胃底静脉曲张出血方面优于内镜栓塞治疗[16-18]。因此,在缺乏组织粘合剂或者不具备内镜下注射组织粘合剂条件的情况下,TIPS也可被考虑作为一线治疗。
4. 顽固性腹水
顽固性腹水,又称难治性腹水,是指经限钠饮食、大剂量利尿剂(400mg/d螺内酯和160mg/d呋塞米)治疗无法消除的腹水,或者因出现利尿剂相关的并发症而不能耐受利尿剂治疗的腹水。一旦发生顽固性腹水,患者一年生存率仅为50% [19]。大量抽放腹水(large-volume paracentesis,LVP)能够很快缓解临床症状,住院时间较短。但是LVP对全身血流动力学的影响使其不适合作为长期治疗方法。TIPS手术不加重全身血流动力学负担,甚至能改善体循环状态。研究证明,TIPS术后4周尿钠排出和血肌酐浓度都有所改善,在6-12个月内可达到正常水平[20]。另外,肾脏的血流动力学在TIPS术后一年内也可恢复正常。荟萃分析表明,TIPS比LVP更有效,具有更高的免于肝移植生存率(TIPS 组一年生存率为63.1%;两年生存率为49.0%;相比之下LVP组1年生存率为52.5%,两年生存率为35.2%)。但是,TIPS组有较高的肝性脑病发生率(39.4 ± 20.9%比 22.6± 13.9%)[21]。因此,为患者选择治疗方案时应权衡利弊。对于每个月需要两次以上LVP,或腹水呈分叶状难以抽放,又或不耐受LVP治疗的患者,应积极考虑TIPS治疗。但是,对于血清胆红素>5mg/dl、肝功能分级Child评分>11,MELD评分>18或年龄>70岁的患者,因为TIPS术后的死亡率较高,建议谨慎行TIPS治疗。其他患者如果没有心衰、肺动脉高压等情况,TIPS是延长生存时间和提高生活质量的理想选择。
5. 布加综合征
布加综合征(Budd-Chiari syndrome,BCS)是指肝静脉或(和)下腔静脉肝后段狭窄、闭塞所引起的肝静脉回流受阻,从而导致门静脉高压的一组临床症候群。它起源于小静脉的闭合和/或肝静脉主干的血栓。根据血栓形成的速度和程度,可将BCS分为急性、亚急性和慢性三种情况。对于急性者,抗凝和支持治疗(扩容、抗生素、利尿剂)可作为侧支血管形成前的过渡治疗。对亚急性和慢性者,门脉高压并发症是其主要临床表现。此类患者药物治疗失败可选做侧侧吻合分流术或肝移植[22]。TIPS治疗布加综合征的安全性和有效性已经被证实。布加综合征患者接受TIPS治疗后5年生存可达90%、10年生存可达80% [23-25]。
6. 顽固性肝性胸腔积液
肝性胸水多因腹腔液漏入胸腔形成,可见于有/无腹水症状的患者。肝性胸水多发生于右侧胸腔。多个病例队列研究证实TIPS治疗肝硬化合并顽固性肝性胸腔积液具有肯定的疗效,可以降低胸水复发率和减少胸腔穿刺放腹水的频率[26,27]。由于缺少对照研究,目前还不明确TIPS是否能改善肝性胸水患者的生存,但是,肝性胸水患者的整体生存比较差。对于顽固性肝性胸水的患者,可选择的治疗手段比较少,因此TIPS可以作为其重要治疗方法之一。
7. 肝肾综合征
肝肾综合征(hepatorenal syndrome,HRS)是指门静脉高压形成后,内脏血管扩张、有效循环血容量降低、血管收缩功能代偿性增强、肾血管严重收缩、肾血流量不足而引起的功能性肾衰竭。HRS分为HRS-1和HRS-2。HRS-1表现为急性进展性的肾功能衰竭,即血肌酐在两周之内增加两倍超过226mmol/L。它可以自发出现,但更多发生于一些诱发因素之后,尤其是自发性细菌性腹膜炎。HRS-2则表现为缓慢进展的肾衰竭,血肌酐在113-226mmol/L之间[28]。肝硬化患者发生HRS-1和HRS-2后的中位生存时间分别只有1-3周和6个月[29]。
因为缺乏循证医学证据,国际腹水协会并不推荐将TIPS作为HRS-1的一线治疗,而且HRS-1患者常合并有严重的肝衰竭,也使其无法耐受TIPS手术。但是,血管收缩药物治疗之后,可行TIPS以稳定肾功能、并提高肝移植的疗效。另外,也有研究证明TIPS可以做为替代治疗用于不耐受特利加压素和白蛋白治疗的HRS-1患者。在HRS-2患者中,TIPS可以逆转HRS并控制腹水的发生。但此结果仍需要进一步RCT研究的证实,以明确TIPS手术在治疗HRS中的价值[29]。
8. 肝肺综合征
肝肺综合征主要是因为在肺内形成了自发性的分流,从而导致了顽固的低氧血症。目前,TIPS治疗肝肺综合征的证据仅限于个案报道。虽然TIPS治疗肝肺综合征的作用机制不明,但是能有效的提高患者血氧浓度[30]。
9. 门静脉血栓
肝硬化患者约有29%会出现门静脉血栓。1年、5年、8-10年的门静脉血栓累积发病率分别为12.8%、20%、38.7%。华法林治疗可达到39%完全缓解、45% 部分缓解,但也有18%的患者对华法林治疗无反应[31]。也有研究表明,对肝硬化门静脉血栓的患者在排除了食管胃底静脉曲张后,使用低分子肝素抗凝治疗6个月,能有效减少门静脉血栓的形成并提高患者生存率[32]。有研究证明凝血功能失衡并非肝硬化患者门静脉血栓形成的主要因素,血流动力学的改变才是主要影响因素。有研究证明了对于肝硬化失代偿期出现门静脉血栓的患者,TIPS是安全可行的,并且门静脉主干堵塞的程度是患者生存的唯一预测因素[33]。TIPS治疗门静脉血栓的疗效还需要更多的临床研究进行评价。
门静脉海绵变性,一直以来被认为是TIPS的禁忌症。一项研究中纳入了从2002年7月到2009年12月之间非肝硬化门脉海绵变性的患者共46例。在这些患者中,TIPS技术成功率可达35%。与TIPS失败组相比,TIPS成功组门静脉压力梯度显著降低(26.3±1.1比12.4±1.1,P<0.001),再出血率也显著降低(14%比69%,P=0.057)。这一结果表明,TIPS治疗门静脉海绵变性是安全可行的[34]。
10. 出血性门脉高压性胃病
门脉高压胃病主要依靠内镜诊断。在诊断为门脉高压胃病之前,需排除其他表现为粘膜充血改变的病因。胃镜下多表现为马赛克症、樱桃红斑甚至棕黑色红斑。既往,有几个小样本的队列研究评价了TIPS治疗门脉高压胃病的疗效,其中一篇报道75%的患者得到了不同程度的缓解[35]。
11. 肝移植患者
对于肝移植后的患者,TIPS术也是安全可行的。肝移植患者接受TIPS治疗的指证是顽固性腹水、顽固性肝性胸水和反复发作的静脉曲张出血。TIPS可以作为再次肝移植的过渡性治疗。TIPS成功治疗肝移植后肝窦阻塞综合征(Sinusoidal Obstruction Syndrome,SOS)的病例也有报道。尽管SOS非常的罕见,他们认为对药物治疗失败的SOS病例应及时应用TIPS治疗[36]。
TIPS手术禁忌症:
绝对禁忌证包括1)食管静脉曲张出血的一级预防; 2)自发性细菌性腹膜炎;3)全身处于感染状态;4)严重肝功能不全、慢性肝性脑病;5)严重右心功能不全;6)严重心肾功能障碍;7)肝脏肿瘤生长于TIPS穿刺处、支架处;8)难以纠正的凝血功能异常。
相对禁忌证包括1)Caroli病(肝内胆管扩张)、胆道阻塞性扩张;2)脾功能亢进;3)肝脏体积明显缩小,硬度明显增高;4)多囊性肝病。
目前尚无研究比较TIPS和其他治疗方法在食管静脉曲张出血的一级预防方面的安全性和有效性。关于外科分流进行一级预防的研究表明,虽然外科分流可以有效地预防出血,但是死亡率明显上升[37]。TIPS的原理与外科分流类似,可以给患者带来肝性脑病,肝衰竭等,因此作为手术绝对禁忌征。相对禁忌症可以使手术难度加大,降低手术成功率。如果术者经验丰富,TIPS也可以成功进行,不过需要综合考虑TIPS的难度和病人的需要。
三、TIPS术前准备
(一)术前准备
1.常规患者术前准备:
1)术前4-6小时禁食水、备皮、抗生素皮试。2)有效控制严重的胸、腹水。3)保护肝肾功能。4)近期有活动性出血的患者给予降低门静脉压力、抑酸、支持、纠正贫血、纠正低蛋白血症治疗,改善患者一般状况。5)术前常规建立静脉通路、备血、备三腔二囊管。6)术前2天低蛋白饮食。7)签署手术志愿书。
2.择期病人术前准备:
1)实验室检查:包括肝、肾功、离子、血糖、血凝、乙肝系列、丙肝抗体、肝纤维化系列、甲胎蛋白等。通过实验室检查,可以准确评估患者伴有全身肝肾功能异常、凝血机制异常等严重的手术禁忌症。对于可以治疗或纠正的患者予以及时的处理。术前后计算Child-Pugh、MELD评分,以准确掌握适应症,并对预后进行准确的评估。
对于原因不明的肝硬化患者应进一步行自身免疫性肝病及自身抗体系列的检查,以除外自身免疫性肝病、干燥综合征、胆汁淤积性肝硬化等疾病。必要时行肝脏穿刺活检术,明确诊断。
2)心电图、了解心肺功能情况,胃镜检查了解食管胃静脉曲张程度
3)影像学检查:
胸片检查;肝脏B超:超声检查可判断肝脏的大小,有无腹水形成。超声能够动态的准确的观察肝静脉、门静脉、脾静脉的宽度,血流方向及速度。以除外Budd-Chiari综合征等血管因素引起的疾病。肝脏平扫和增强CT扫描:可以了解肝脏大小,肝硬化程度,肝裂增宽的情况,下腔静脉肝后段的范围,门静脉及肝静脉的位置关系,胸腹水情况。有无腹水形成,有无膈肌抬高或纵隔推移,是否伴有门静脉血栓形成,血栓的部位,新鲜、陈旧的程度。有无海绵样变性形成。有无肝脏恶性肿瘤或动静脉瘘形成。对于判断困难者可行MRI检查或门静脉系血管三围重建检查:可以进一步了解肝后段下腔静脉、肝静脉与门静脉的位置关系,门静脉血栓范围及程度。
对于影像学检查发现门静脉分支及主干或肠系膜上静脉有栓子形成的患者,需先行间接门脉造影检查,以充分了解门静脉及肠系膜静脉情况。对于门静脉显影不佳或伴有海绵样变性形成时应选择经皮经肝途径或经皮经脾途径,必要时二者联合进行直接门静脉、脾静脉、肠系膜上静脉造影,准确的判断上述血管情况,避免盲目的经颈内静脉穿刺,使手术失败,或肝外穿刺等严重并发症发生。
3.急诊病人术前准备:
1)急诊病人一般能够完成实验室各项检查,情况允许,应尽可能完成择期病人的术前准备,尤其是急诊CT,通过影像检查能够明确肝脏大小及形态,特别是对肝静脉及肝内外门静脉能够准确的判断,了解相互的解剖关系,以利于术中门静脉穿刺,顺利完成TIPS。
2)但对于严重出血风险患者,为争取抢救时机可行急诊超声检查对患者的肝脏及血管情况予以初步的预判断,以便急诊施行手术,术中可先行间接门静脉造影对门静脉及肠系膜上静脉的情况予以判断。
(二)主要器械
1.门脉穿刺系统:如RUPS-100(Cook公司)和TIPSS1000。2.5F血管鞘组、5F Cobra、单弯管、直头测孔导管或猪尾巴导管。3.超滑黒泥鳅导丝0.035in(1in=2.54cm) Amplaz超硬导丝,穿刺针等常规器材。4.球囊导管 8mmX40mm、10mmX40mm 或10mmX60mm。5.球囊压力泵。6.血管支架支架或覆膜支架。7.弹簧钢圈。8.其他:测压管(仪)、无菌辅料、高压造影连接导管、心电监护仪。
(三)术中准备药品
1.局麻药:常用2%利多卡因。2.抗凝:常用肝素钠、低分子肝素钙。3.造影剂:非离子型造影剂。4.镇静:注射用地西泮。5.止痛剂:盐酸哌替定注射液。6.溶栓剂:尿激酶、重组人抗凝血酶原激活剂r-tPA。7.抢救药品:多巴胺、肾上腺素、盐酸异丙嗪、地塞米松、立止血。8.血管扩张剂:前列腺素E1。
四、TIPS术操作规范流程和重要注意事项
(一)常规TIPS操作步骤:
1.门静脉显像方法:包括间接门静脉造影,肝脏增强CT检查,门静脉血管三围重建。推荐术前应用间接门静脉造影检查。
间接门静脉造影:患者仰卧位,心电监测,面罩或鼻导管给氧。常规消毒手术区域皮肤。右侧或左侧的颈部及腹股沟区皮肤铺无菌手术巾。选择腹股沟韧带中点下方1.0-1.5cm处,触摸到动脉波动最强点为穿刺点,2%利多卡因局部麻醉皮肤、皮下及股动脉鞘。在拟穿刺点皮肤横切口3mm,进行股动脉穿刺,穿刺成功后,引入导丝及5F血管鞘,退出内芯,保留肝素水,沿导丝送入5F Cobra导管,选择性插管至肠系膜上动脉,以备延时间接门静脉造影所用。通常延时3-5S,造影剂量为6-8 ml/S,总量25ml。造影时机常选择在颈内静脉插管成功,RUPS100穿刺系统导入肝右静脉后进行。此时造影有助于观察RUPS-100所处的肝静脉与门静脉的大致位置关系。
2.颈内静脉穿刺:
患者仰卧位,头偏向穿刺的对侧,通常选择右侧。2%利多卡因局部麻醉,对于年老、儿童或疼痛耐受性差的患者可采用基础诱导麻醉下进行手术。选择穿刺点,选择穿刺点以右侧胸锁乳突肌中点的外缘即胸锁乳突肌三角区的头侧为中心,或选择右下颌角下方2-2.5cm处为宜。此点穿刺不易进入胸腔,引起气胸。在拟穿刺点皮肤横切口3mm后,充分扩张皮下通道,采用静脉穿刺针呈负压状态进针,行颈内静脉穿刺术。穿刺针呈30-45°角进针,进针深度约3~5cm。穿刺成功后,将导丝送入下腔静脉,并用10F扩张鞘扩张局部穿刺通道,沿导丝引入RUPS-100穿刺系统,调整导丝进入肝右静脉,将穿刺系统选择性插入肝静脉,测量并记录游离肝静脉压。当右侧颈内静脉狭窄闭塞或穿刺困难时,可选择左侧颈内静脉进行穿刺,穿刺方法及穿刺点选择同右侧颈静脉穿刺,在穿刺困难时可选择经股静脉穿刺导丝标记或B超引导下穿刺颈内静脉并进行下一步操作。
3.门静脉穿刺:
穿刺门静脉根据CT、MRI或间接门静脉造影检查判断肝静脉、门静脉走形及位置关系。对门静脉增粗明显,肝静脉走形自然者,可以准确判断相互关系的可以直接经肝静脉进行门静脉穿刺。或以肝静脉内RUPS100的位置及间接门静脉造影显像对其分支的二维关系进行准确的门静脉定位,塑型RUPS100导向器前端的角度,依据造影的定位进行门静脉穿刺,以避免盲目穿刺、损伤肝实质引起的肝功能损害、肝包膜下或腹腔出血、肝外穿刺等严重术中并发症。当肝静脉显示平直或肝静脉闭塞时,可以选择第二肝门附近的下腔静脉肝后段进行门静脉穿刺。此时必须准确判断穿刺点有足够的肝实质包绕,否则会引起严重的腹腔出血。
4.建立门腔通道
从肝静脉穿刺门静脉成功后,通过“冒烟”(注入造影剂)判断所穿刺管腔是否为肝内门静脉分支。判断准确无误后,用0.035 超滑泥鳅导丝调整进入门静脉主干至脾静脉或肠系膜上静脉。引入造影导管(猪尾或直测孔)至脾静脉,脾脏切除者导丝进入肠系上静脉,测量门、脾静脉压力并记录,进行直接门静脉造影,造影剂量为6-8 ml/S,总量15ml。通过造影判断穿刺血管的位置及进针点。并了解食管胃底静脉曲张的位置、程度,有无脾肾分流道形成等,以备栓塞时用。送入超硬导丝至肠系膜上静脉,助手固定导丝,将RUPS-100鞘组推进至门静脉内,此时门腔静脉通道成功建立。
5.曲张静脉栓塞:栓塞时机可在门腔静脉通道建立以后直接栓塞,也可以在支架置入后进行。推荐在门腔静脉通道建立以后进行栓塞[38]。
依据直接门静脉造影,对食管胃底曲张静脉的位置、程度、直径予以判断,以便选择合适的导管及栓塞剂进行栓塞,并观察有无脾肾、胃肾分流形成,避免选择栓塞剂不当引起异位肺栓塞等严重并发症。采用单弯导管或Cobra导管对胃冠状静脉、胃短静脉及所属食管胃静脉曲张静脉进行栓塞。常用栓塞剂推荐弹簧钢圈、无水乙醇、5%鱼肝油酸钠和/或明胶海绵或聚乙烯醇颗粒。目前多采用弹簧钢圈。栓塞后换入造影导管再次测量门和/或脾静脉压力,并进行准确记录。一般栓塞后门静脉压力较栓塞前压力升高2-5cmH2O。对于异常脾肾、胃肾分流道的栓塞应着实慎重,可采用较大的弹簧钢圈进行,对分流道粗大者,可经下腔静脉-肾静脉途径用球囊封堵后再进行栓塞,并可留置球囊24-48h后拔出。通过对曲张静脉或异常分流的栓塞可以减少分流量,有效增加肝脏的灌注,增加支架内血流。避免支架再狭窄和肝性脑病的发生。
6.球囊扩张及支架置入
沿超硬导丝送入球囊导管,推荐球囊导管规格为 10mmX40mm、10mmX60mm,对分流道进行球囊扩张。由于肝硬化严重,有时在球囊扩张已达到工作压力,球囊充盈状态良好,但仍有球囊切迹时,持续10S后,压力泵回抽,将球囊中点置入切迹明显处,再次进行扩张,持续10S。以达到有效扩张,避免支架置入后此处狭窄,引起局部涡流形成,引起支架功能失常。球囊切迹明显时剪辑图像(留图标记),结合球囊扩张时的切迹及血管造影选择合适的血管内支架,依据骨性标记精确定位后释放,一般推荐选用直径8~10mm,长度60~80mm的自膨式金属内支架或覆膜支架。在置入金属支架后,再次行直接门静脉造影,了解支架位置及通畅情况,并观察曲张静脉的消失情况,必要时行支架内球囊扩张或曲张静脉再栓塞。造影剂量为8 ml/S,总量15ml。再次测量门脾静脉压力及游离肝静脉压力,计算肝静脉压力梯度。
(二)TIPS治疗门静脉血栓或癌栓伴或不伴有海绵样变性的操作步骤
对于一般的患者经过上述的方法即可完成TIPS治疗。但对于门静脉部分或完全血栓形成或癌栓伴或不伴门静脉海绵样变性的患者,当血管造影仅部分门静脉显影或门静脉无法显示的患者。传统TIPS术完成非常困难。这时TIPS可按以下步骤进行[33-42]。
1.直接经颈行TIPS术:
对于B超、CT、MRI检查提示肝内门静脉显影良好,门静脉分支或主干内部分血栓形成,可行常规的术前间接门静脉造影检查。在门静脉部分显示情况下,直接经颈内静脉穿刺门静脉,穿刺成功后行直接门静脉造影检查,判断血栓的范围及程度。对于肝癌伴有动静脉瘘形成时,由于动静脉瘘的压力差异,肝动脉血流经瘘直接进入门静脉,门静脉血流有可能成离肝血流,所以间接门静脉造影无法显示门静脉。此时应选择经肝动脉的门静脉造影。对于新鲜的血栓可经RUPS-100外鞘进行血栓抽吸、球囊扩张,以尽可能完全抽吸门静脉内的血栓,再行球囊扩张肝实质,置入支架完成TIPS术。
2.经皮经肝途径门静脉成形联合TIPS术
对B超、CT、MRI或血管三围重建等检查提示肝内、外门静脉分支未显影,且经过间接门静脉造影检查后确认门静脉血栓形成,无法经颈直接完成TIPS术时。选择B超引导下穿刺肝内门静脉分支,对所穿中的血管进行准确的判断后,换入5FCobra导管,进行门静脉探查,使其进入肠系膜上静脉或脾静脉。行门静脉直接造影检查判断血栓的范围、程度,了解肠系膜血栓的范围及曲张静脉的情况,判断穿中的血管及位置。在正侧位造影判断无误后,可经颈内静脉途径,以导丝或血管鞘头的标记进行门静脉穿刺。对狭窄严重,预计穿刺成功后导丝通过困难者,可经皮途径进行门静脉球囊扩张预成形治疗后,再经颈内静脉途径穿刺门静脉,此时成功率明显提高。 当血栓范围已达肠系膜上静脉主干时,对于未切脾患者,不主张将支架深入肠系膜上静脉内。对此点可进行充分的球囊扩张后,置入溶栓导管进行抗凝、溶栓的治疗。术后用5mm弹簧钢圈对经皮经肝穿刺道进行穿刺道栓塞,以预防腹腔出血。
3.经皮经脾途径门静脉成形联合TIPS术
门静脉广泛血栓形成,血栓激化伴或不伴有海绵样变性血管形成,经皮经肝途径无法穿刺到肝内门静脉或虽穿刺到门静脉,而导丝导管无法进入到肠系膜上静脉,无法有效开通门静脉主干时,而脾静脉显示良好者,可经脾脏途径穿刺增宽的脾静脉,以建立门静脉入路,行直接门静脉造影,显示其血栓范围程度,采用导丝、导管技术,探查门静脉主干及其分支的位置,留置导丝或导管于肝内门静脉内为标记“靶子”经颈内静脉途径进行门静脉穿刺,穿刺成功后即可同常规TIPS术建立有效分流道。
脾脏为多血供的血窦,易发生皮质破裂出血,常选用微穿刺针进行穿刺。X线引导下穿刺,依据CT脾脏血管显像进行定位,多选用脾脏下极沿腋中线进行穿刺。穿刺时,嘱患者闭气,持续迅速的刺入脾脏,深度3-5cm,退出针芯,边退针边回抽回血,有血液回流后,注入造影剂,判断所穿中的血管,穿刺成功后送入微穿刺鞘,退出导丝,换入0.035in超滑黑泥鳅导丝,进行下一步操作。亦可选择超声引导下脾静脉穿刺,定位后局部麻醉,成功后用导丝、导管调整后入门静脉主干起始部。使导丝和导管通过狭窄阻塞的门静脉内,进行血管标记,再经颈内穿刺门静脉完成TIPS术。建议脾静脉穿刺采用B超引导下进行。
由于门静脉血栓形成早期症状较为隐匿,一旦发生症状,多已成慢性,并可能发展至肠系膜上静脉、脾静脉。TIPS治疗的难度无疑增加,因此门静脉血栓的治疗需要专业的团队及相关科室的配合才能予以完成。对于肠系膜上静脉部分血栓形成患者,可以考虑TIPS术后结合肠系上膜静脉的导管溶栓治疗,已达到肠系膜上静脉再通。即使门静脉主干完全血栓形成闭塞或已经机化无法开通,但只要肠系膜上静脉血流通畅,可以考虑采用粗大的海绵样侧枝血管建立有效的门腔静脉分流道。而对于肠系膜上静脉主干或其属支内广泛血栓形成患者即使建立TIPS通道,也无法保障其支架内血流有效灌注及长期通畅。
五、TIPS并发症及其防治措施
TIPS的并发症主要分为TIPS操作相关并发症以及术后并发症[43-46]。
最严重的TIPS操作相关并发症为误穿颈动脉造成的出血,肝动脉、肝内或肝外门静脉及肠系膜上静脉等血管壁撕裂伤造成的腹腔出血以及肝被膜穿刺伤造成的出血;还包括误穿入胆管或胆囊内形成门静脉胆管瘘或胆汁性腹膜炎,穿刺后感染或脓肿形成、赘生物感染、心律失常、造影剂过敏反应以及支架松动移位等。误穿主要与操作者的经验和技术有关;此外,部分患者的肝脏显著缩小,且伴发的张力性腹水使肝脏上移,也将增加穿刺门静脉造成血管壁撕裂伤出血的危险性。大多数出血是自限性的,有学者通过植入覆膜支架进行止血;大出血应密切观察,必要时开腹行修补术。为避免腹腔出血,穿刺门静脉应至少离门静脉分叉处2cm。手术相关的血源性感染,在进展期肝病的患者中以葡萄球菌及大肠埃希菌等革兰阳性细菌居多,而在胆道疾病的患者中多为肠道革兰阴性菌。一旦确诊,应立即给予抗生素治疗。
术后并发症最为常见的是肝性脑病、分流道或支架的狭窄阻塞,还包括急性右心衰、急性肝衰、溶血性贫血及手术感染等。
30%-50%的患者在TIPS术后一年内会发生脑病,尤以术后1个月内显著增高[47]。两项有关覆膜支架的研究提示肝性脑病发生率达20-40%,其中3%-8%会进展为难治性脑病[5,6]。其主要发病机制可能与肠源性毒素吸收增加及术后血氨过高有关。目前,还没有有效的药物可用于TIPS术后肝性脑病的预防。有研究报道通过分流门静脉左支能够一定程度降低术后脑病发病率。我中心的随机对照研究证实,TIPS术后一周内应用门冬氨酸鸟氨酸能够有效的抑制术后血氨升高、改善患者神经-心理学状态[48]。术后脑病的危险因素主要包括术前肝性脑病病史、术后门体压力梯度大于12mmHg、严重的肝病、非酒精性肝硬化、高凝状态、高龄、女性、支架直径、酗酒、机械通气及异常增高的血清肌酐[49]。门体分流相关的脑病一般对标准治疗(乳果糖、限制蛋白摄入及消除诱发因素等)效果较好,可加用新霉素及甲硝唑等抗菌素;对上述治疗均无效的难治性脑病,可采用缩小或阻塞分流道两种方法。将扩张的球囊置于分流道,造成分流道血栓形成,达到缩小分流道进而防治脑病,如果复发门静脉高压或形成完全性血栓,应再次实施开通术,降低再发出血造成致命性血流动力学改变的危险性。当前,肝移植被考虑为难治性脑病的最终治疗方法[47]。
TIPS分流道狭窄或闭塞可以发生于术后的任何时间,是TIPS术后静脉曲张再出血及腹水复发的主要原因。一般分为早期及中远期狭窄或闭塞,前者多与支架释放时未完全支撑肝实质部分分流道、支架释放后扭曲、成角使肝组织回缩、继发血栓形成有关;后者多与支架内假性内膜过度增生有关[50]。多个研究报道支架的位置与术后狭窄有一定的关系,通过对在我中心接受TIPS手术的307例患者分析后发现,支架上端抵达肝静脉口、下端顺应门静脉血管壁能够有效的降低术后狭窄率[51]。术后应对支架通畅情况进行规律监测,直接门静脉造影与门体压力梯度的测量是术后评估门静脉系血管及分流道的最佳标准,但由于此技术的侵袭性及造影剂的使用,除术后短期评估以外,多采用彩色超声多普勒观察分流道情况。术后应于7-14天即开始监测,主要指标有分流道血流最大速度(正常为60-220cm/s)门静脉主干血流最大速度及方向(正常为>30cm/s、向肝血流),并结合肝脏的整体情况做出判定。术后抗凝预防血管内膜增生及早期血栓形成是有效的,但对于既往频繁出血、INR>5或无法监测凝血功能的患者来说,不提倡术后抗凝治疗[52,53]。晚期的分流道狭窄或闭塞发生率高达80%,覆膜支架有效地解决了上述问题(一年内分流道开通率可达84%)[5,6]。
六、TIPS技术成功标准
对于有经验的介入医生来说,TIPS的手术成功率可达90%以上。根据美国肝病学会指南[9],TIPS的技术成功主要是指分流道的建立以及门静脉压力梯度降至12mmHg以下,然而根据我们的临床实践,这种情况下患者术后肝性脑病发生率将显著升高,故在支架的成功植入后术后门静脉压力梯度较术前降低20%,即可被认为TIPS手术成功。临床成功主要是指门静脉高压并发症的消除,其成功率可达90%。
七、小结
TIPS将传统的外科分流模式改变为肝内分流模式,兼备创伤小、无需全身麻醉以及并发张少等优点。当前,TIPS治疗曲张静脉再出血和难治性腹水的有效性与安全性已得到大量随机对照研究充分证实。相信随着TIPS技术的不断完善与门脉高压症的认识,肝肾综合征、肝肺综合征以及门静脉血栓形成等新的适应证将会得到进一步的证实。此外,虽然覆膜支架的应用已有效地解决了TIPS术后分流道狭窄或闭塞,但术后肝性脑病等其它并发症仍限制着TIPS更广泛的应用,改良穿刺和分流路径或限制分流的支架值得期待。
八、参考文献
1.R?sch J, Hanafee WN, Snow H. Transjugular portal venography and radiologic portacaval shunt: an experimental study. Radiology. 1969;92(5):1112-4.
2.Colapinto RF, Stronell RD, Gildiner M, et al. Formation of intrahepatic portosystemic shunts using a balloon dilatation catheter: preliminary clinical experience. Am J Roentgenol. 1983;140(4):709-14.
3.Palmaz JC, Sibbitt RR, Reuter SR, et al. Expandable intrahepatic portacaval shunt stents: early experience in the dog. Am J Roentgenol. 1985;145(4):821-5.
4.R?ssle M, Richter GM, N?ldge G, et al. Performance of an intrahepatic portacaval shunt (PCS) using a catheter technique – a case report.Hepatology 1988;8:1348A
5.Bureau C1, Garcia-Pagan JC, Otal P, et al. Improved clinical outcome using polytetrafluoroethylene-coated stents for TIPS: results of a randomized study. Gastroenterology. 2004;126(2):469-75.
6.Perarnau JM, Le Gouge A, Nicolas C, et al. Covered vs. uncovered stents for transjugular intrahepatic portosystemic shunt: a randomized controlled trial. J Hepatol. 2014;60(5):962-8.
7.Zheng M, Chen Y, Bai J, et al. Transjugular intrahepatic portosystemic shunt versus endoscopic therapy in the secondary prophylaxis of variceal rebleeding in cirrhotic patients: meta-analysis update. J Clin Gastroenterol 2008;42:507–16.
8.Salerno F, Camma C, Enea A, et al. Transjugular intrahepatic portosystemic shunt for refractory ascites: a meta-analysis of individual patent data. Gastroenterology 2007;133:825–34.
9.Boyer TD, Haskal ZJ. The role of transjugular intrahepatic portosystemic shunt (TIPS) in the management of portal hypertension: update 2009. Hepatology 2010;51:306-306.
10.de Franchis, R., Revising consensus in portal hypertension: report of the Baveno V consensus workshop on methodology of diagnosis and therapy in portal hypertension. J Hepatol, 2010. 53(4): 762-8.
11.Rossle, M., TIPS: 25 years later. J Hepatol, 2013. 59(5): 1081-93.
12.García-Pagán JC, Caca K, Bureau C, et al. Early use of TIPS in patients with cirrhosis and variceal bleeding. N Engl J Med 2010;362:2370–2379.
13.Garcia-Pagan JC, Di Pascoli M, Caca K, et al. Use of early-TIPS for high-risk variceal bleeding: results of a post-RCT surveillance study. J Hepatol 2013;58:45–50.
14.Rosemurgy AS, Serafini FM, Zweibel BR, et al. Transjugular intrahepatic portosystemic shunt vs. small-diameter prosthetic H-graft portacaval shunt: extended follow-up of an expanded randomized prospective trial. Journal of Gastrointestinal Surgery 2000;4:589-97.
15.Henderson JM, Boyer TD, Kutner MH, et al. Distal splenorenal shunt versus transjugular intrahepatic portal systematic shunt for variceal bleeding: a randomized trial. Gastroenterology 2006;130:1643-51.
16.Tripathi D, Therapondos G, Jackson E, et al. The role of the transjugular intrahepatic portosystemic stent shunt (TIPSS) in the management of bleeding gastric varices: clinical and haemodynamic correlations. Gut 2002;51:270-4.
17.Barange K, Peron JM, Imani K, et al. Transjugular intrahepatic portosystemic shunt in the treatment of refractory bleeding from ruptured gastric varices. Hepatology 1999;30: 1139-43
18.Lo GH, Liang HL, Chen WC, et al. A prospective, randomized controlled trial of transjugular intrahepatic portosystemic shunt versus cyanoacrylate injection in the prevention of gastric variceal rebleeding. Endoscopy 2007;39:679–85
19.Ginès P, Cárdenas A, Arroyo V, et al. Management of cirrhosis and ascites. New England Journal of Medicine 2004;350:1646-1654.
20.R?ssle M, Gerbes AL. TIPS for the treatment of refractory ascites, hepatorenal syndrome and hepatic hydrothorax: a critical update. Gut 2010;59:988-1000.
21.Salerno F, Cammà C, Enea M, et al. Transjugular intrahepatic portosystemic shunt for refractory ascites: a meta-analysis of individual patient data. Gastroenterology 2007;133:825-834.
22.Valla D-C. Budd–Chiari syndrome and veno-occlusive disease/sinusoidal obstruction syndrome. Gut 2008;57:1469-1478.
23.Garcia-Pagán JC, Heydtmann M, Raffa S, et al. TIPS for Budd-Chiari syndrome: long-term results and prognostics factors in 124 Patients. Gastroenterology 2008;135:808–815.
24.Qi X, Yang M, Fan D, et al. Transjugular intrahepatic portosystemic shunt in the treatment of Budd-Chiari syndrome: a critical review of literatures. Scand J Gastroenterol, 2013. 48(7): 771-84.
25.Qi X, Guo W, He C, et al. Transjugular intrahepatic portosystemic shunt for Budd-Chiari syndrome: techniques, indications and results on 51 Chinese patients from a single centre. Liver Int. 2014;34(8):1164-75.
26.Dhanasekaran R, West JK, Gonzales PC, et al. Transjugular intrahepatic portosystemic shunt for symptomatic refractory hepatic hydrothorax in patients with cirrhosis. Am J Gastroenterol 2010;105:635-41.
27.Krok KL, Cardenas A. Hepatic hydrothorax. Semin Respir Crit Care Med 2012;33:3-10.
28.Salerno F, Gerbes A, Ginès P, et al. Diagnosis, prevention and treatment of hepatorenal syndrome in cirrhosis. Postgrad Med J 2008;84:662-670.
29.Arroyo V, Fernandez J. Management of hepatorenal syndrome in patients with cirrhosis. Nat Rev Nephrol 2011;7:517-26.
30.Paramesh AS, Husain SZ, Shneider B, et al. Improvement of hepatopulmonary syndrome after transjugular intrahepatic portasystemic shunting: case report and review of literature. Pediatr Transplant 2003;7:157-62.
31.Werner K, Sando S, Carey EJ, et al. Portal Vein Thrombosis in Patients with End Stage Liver Disease Awaiting Liver Transplantation: Outcome of Anticoagulation. Dig Dis Sci 2013:1-5.
32.Congly SE, Lee SS. Portal vein thrombosis: should anticoagulation be used? Curr Gastroenterol Rep 2013;15:1-7.
33.Han G, Qi X, He C, et al. Transjugular intrahepatic portosystemic shunt for portal vein thrombosis with symptomatic portal hypertension in liver cirrhosis. J Hepatol. 2011;54(1):78-88.
34.Qi X, Han G, Yin Z, et al. Transjugular intrahepatic portosystemic shunt for portal cavernoma with symptomatic portal hypertension in non-cirrhotic patients. Dig Dis Sci, 2012. 57(4): 1072-82.
35.Kamath PS, Lacerda M, Ahlquist DA, et al. Gastric mucosal responses to intrahepatic portosystemic shunting in patients with cirrhosis. Gastroenterology 2000;118:905-11.
36.Smith FO, Johnson MS, Scherer LR, et al. Transjugular intrahepatic portosystemic shunting (TIPS) for treatment of severe hepatic veno-occlusive disease. Bone Marrow Transplant 1996;18:643-646
37.Conn HO, Lindenmuth WW May CJ, Ramsby GR. Prophylactic portacaval anastomosis. A tale of two studies. Medicine 1971;51:27-40
38.Chen S, Li X, Wei B, et al. Recurrent variceal bleeding and shunt patency: prospective randomized controlled trial of transjugular intrahepatic portosystemic shunt alone or combined with coronary vein embolization. Radiology, 2013. 268(3): 900-6.
39.Qi, X, G. Han, Transjugular intrahepatic portosystemic shunt in the treatment of portal vein thrombosis: a critical review of literature. Scand J Gastroenterol. 2013;48(7):771-84.
40.Liu L, Zhao Y, Qi X, et al. Transjugular intrahepatic portosystemic shunt for symptomatic portal hypertension in hepatocellular carcinoma with portal vein tumor thrombosis. Hepatol Res, 2014. 44(6): 621-30.
41.褚建国, 孙晓丽, 朴龙松等 门静脉血栓形成的TIPS治疗和临床结果. 空军总医院学报, 2003(19): 93-6.
42.韩国宏,孟祥杰,殷占新等 经皮脾静脉途径联合TIPS治疗伴海绵样变性的门静脉血栓. 介入放射学杂志 2009; 18(3) : 177-81
43.Boyer, T.D., Transjugular intrahepatic portosystemic shunt: current status. Gastroenterology, 2003. 124(6):1700-10.
44.陈云燕, TIPSS的并发症. 介入放射学杂志, 1994(3):174-5.
45.滕皋军, 徐克. TIPS 再狭窄的研究现状和进展. 介入放射学杂志, 2005. 14(1): 87-91.
46.李麟荪, 滕皋军. 介入放射学临床与并发症. 人民卫生出版社. 2010-12 641-656.
47.Riggio O, Nardelli S, Moscucci F, et al. Hepatic encephalopathy after transjugular intrahepatic portosystemic shunt. Clin Liver Dis, 2012. 16(1): 133-46.
48.Bai M, He C, Yin Z, et al. Randomised clinical trial: L-ornithine-L-aspartate reduces significantly the increase of venous ammonia concentration after TIPSS. Aliment Pharmacol Ther. 2014; 40(1):63-71.
49.Bai M, Qi X, Yang Z, et al., Predictors of hepatic encephalopathy after transjugular intrahepatic portosystemic shunt in cirrhotic patients: a systematic review. J Gastroenterol Hepatol, 2011. 26(6): 943-51.
50.祁兴顺,韩国宏,樊代明. 经颈内静脉肝内门体分流术临床应用新进展. 介入放射学杂志 2011; 20(6) : 499-504
51.Bai M, He CY, Qi XS, et al. Shunting branch of portal vein and stent position predict survival after transjugular intrahepatic portosystemic shunt. World J Gastroenterol. 2014; 20(3):774-85.
52.Sauer P, Theilmann L, Herrmann S, et al., Phenprocoumon for prevention of shunt occlusion after transjugular intrahepatic portosystemic stent shunt: a randomized trial. Hepatology, 1996. 24(6): 1433-6.
53.Villa E, Cammà C, Marietta M, et al. Enoxaparin prevents portal vein thrombosis and liver decompensation in patients with advanced cirrhosis. Gastroenterology, 2012. 143(5): 1253-60.
|

