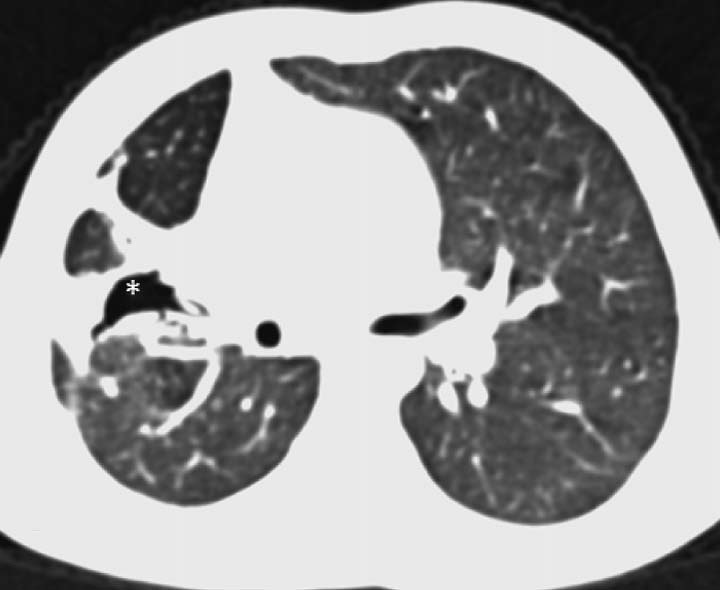
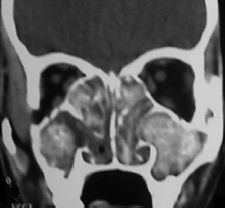
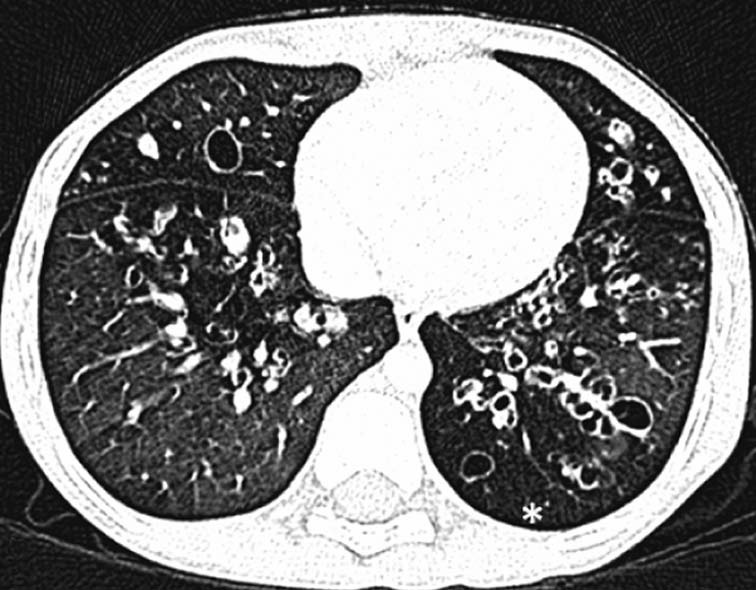
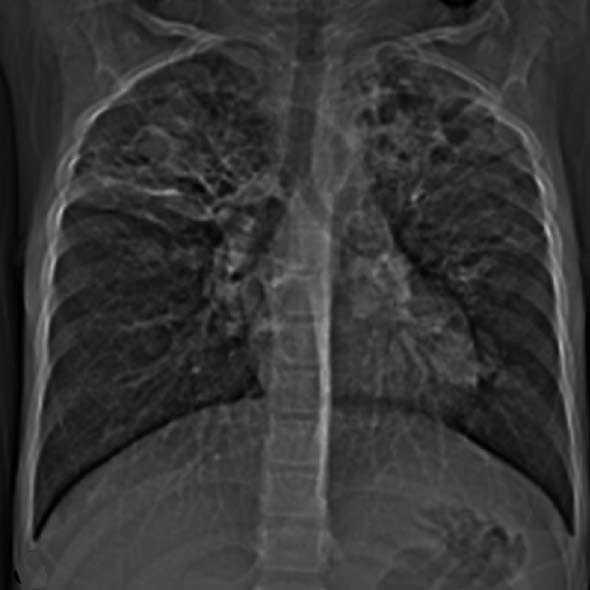
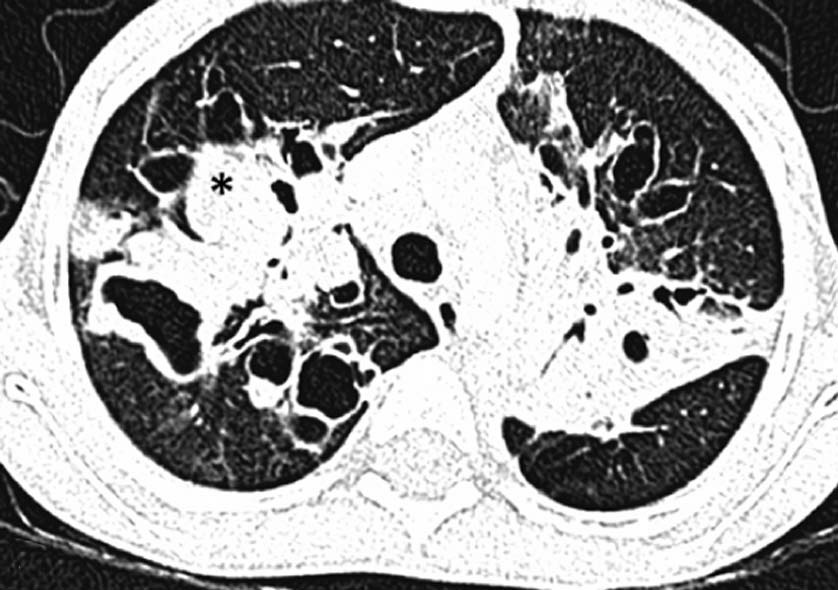
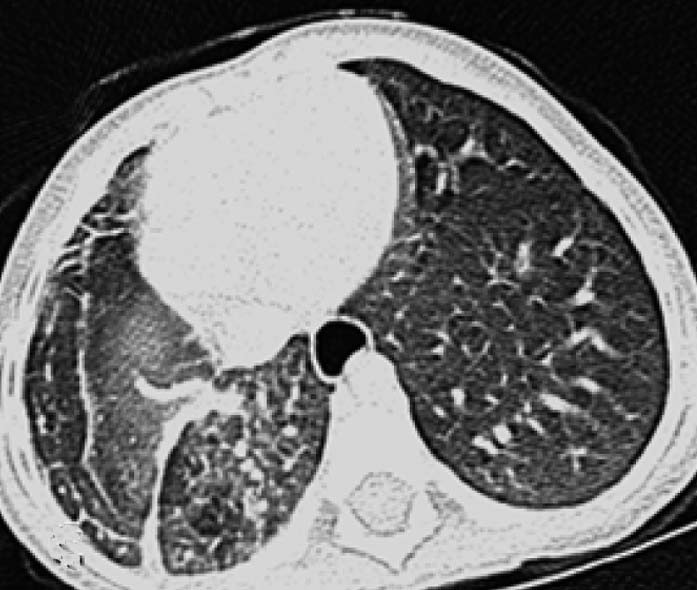
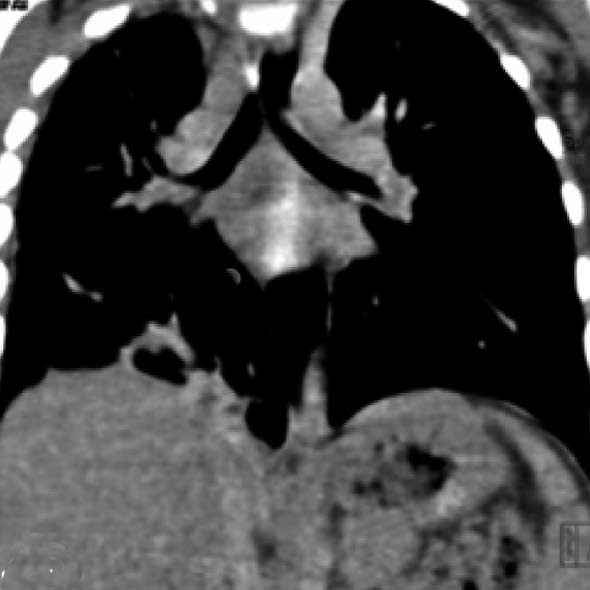
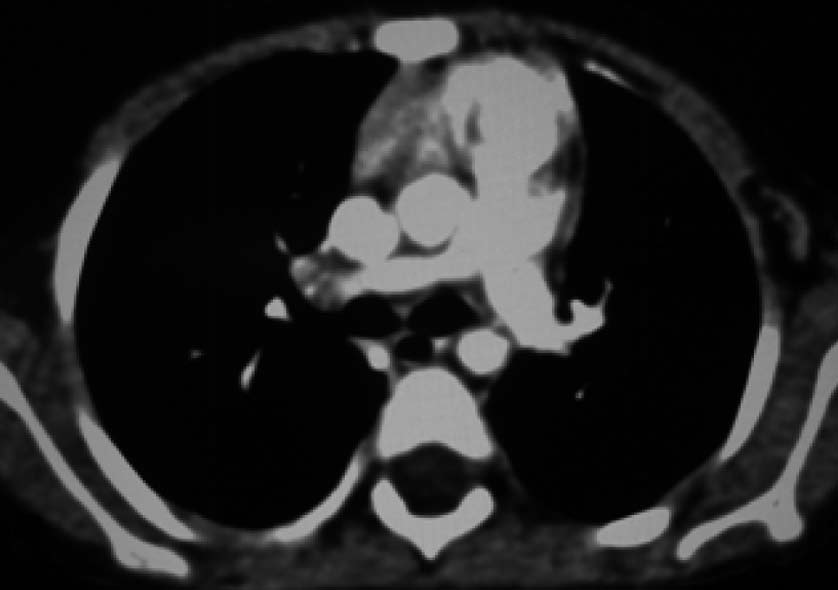
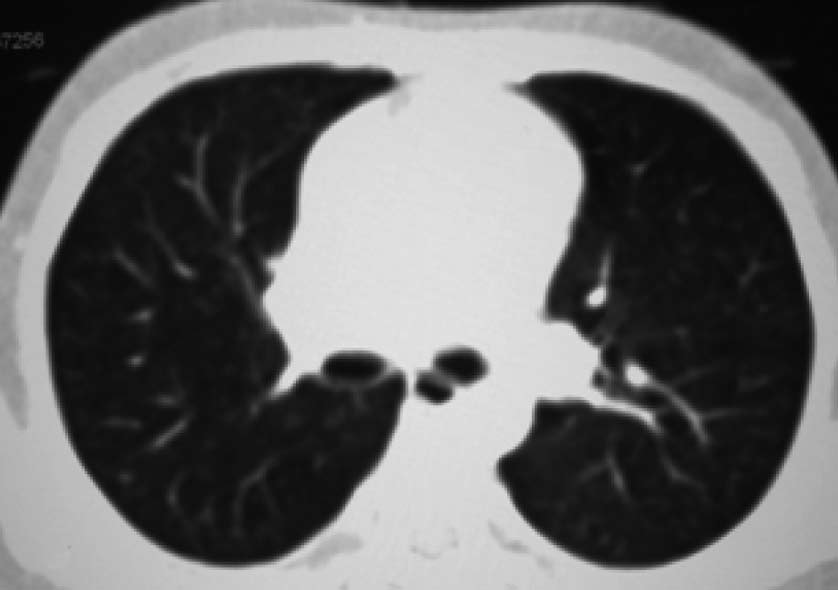
| 定义:来自呼吸道咳出的血或血痰(blood tinged-sputum)【1】。儿科大咯血定义为24小时内失血>8ml/kg【2】。 小儿咯血原因: 和成人不同,而且随小儿年龄变化而可以非常不同【4】。 early childhood 1. 感染(infection):气管支气管炎,肺炎和肺脓肿可以导致咯血。感染的发生可以是细菌、病毒、霉菌或寄生虫导致。虽然结核是成人出血的主要原因,但很少在儿科咯血文献中得到报告【22】。胸片可以显示肺浸润 (pulmonary infiltrates), 过度充气(hyperinflation)和有或没有气液平面的空洞。 有相关的胸膜渗出(pleural effusion)和淋巴结肿大(lymphadenopathy)。CT发现可以是实变、毛玻璃样变、间质增厚(interstitial thickening), 含气(air-trapping), 不规则壁(shaggy walls)和气液平面的腔。CT 也能够证实各种并发症,如脓胸(empyema)- 增强脏层和壁层胸膜增厚,, ‘‘split pleura ’’ sign-胸膜分裂征), 支气管胸膜腔瘘(bronchopleural fistula),等。 7岁女孩,肺包囊虫破裂
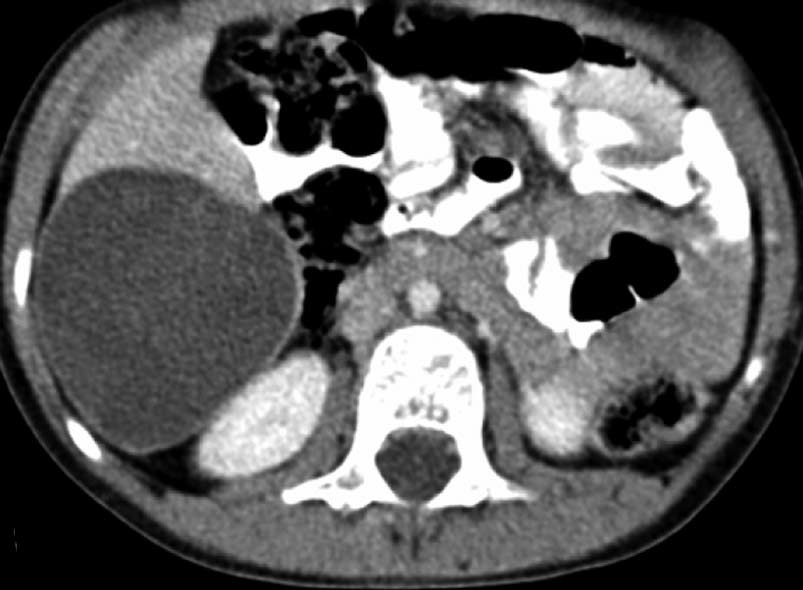
寄生虫性囊肿(Parasitic cysts) (棘球绦虫 Echinococcus) 由于破裂到气道能引起咯血。这些光滑壁的水样密度的病变,并由于与邻近支气管沟通而充满气体。 These may be seen as fluid density lesions with a smooth wall and air foci due to communication with the adjacent bronchus (Figure 3A). 分离膜(Detached membranes) 和子囊( daughter cysts)可以在囊内看见。 同时发生的囊肿可以发现在其它器官,最常见在肝脏。
最常见的真菌感染是曲霉菌。它可以有各种不同的表现,被称:
(1)为曲霉菌球(aspergilloma) (2)变应性支气管肺曲霉菌病(allergic bronchopulmonary aspergillosis,ABPA)、
(3)不完全侵袭性曲霉菌病(semi-invasive aspergillosis)
(4)气道或血管侵袭性曲霉菌病(airway or angioinvasive aspergillosis)【23,24】。 曲霉菌球(Aspergilloma)是由霉菌以前存在的腔的腐生定植(saprophytic colonization),典型表现为腔内“空气半月征(air-crescent’ sign)“。它可以是移动的和显示位置姿态的变化。 ABPA 急性期的肺浸润可呈一过性、持续性,以肺上叶为多见。一过性改变主要为肺浸润、粘液填塞(mucous plugged bronchi )、或病变气道内的分泌物所致,表现为牙膏征、双轨征和手套征(finger-in-glove’ appearance)。慢性期可表现为永久性改变,包括中心性支气管扩张(central bronchiectasis),常为近端支气管呈柱状或囊状扩张,远端支气管可正常,这种特征性的中心性支气管扩张对诊断ABPA有重要意义。后期改变可有空腔形成、局限性肺气肿、上叶肺不张以及肺纤维化等表现。
有些病人也可以变应性霉菌性鼻窦疾病(allergic fungal sinonasal disease)或变态反应性真菌性鼻窦炎。侵袭性曲霉菌病常出现在免疫系统受损伤的病人。在CT上侵袭性气道疾病表现为支气管周围周围的实变和多分支小叶中心结节【25】。环周毛玻璃样改变结节(halo 征)或基于胸膜楔形实变区域是血管侵袭曲霉菌病的标识性改变【26】。
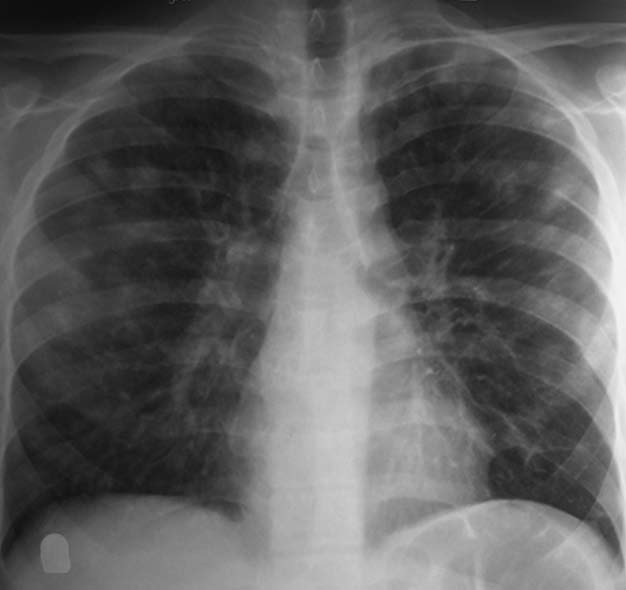
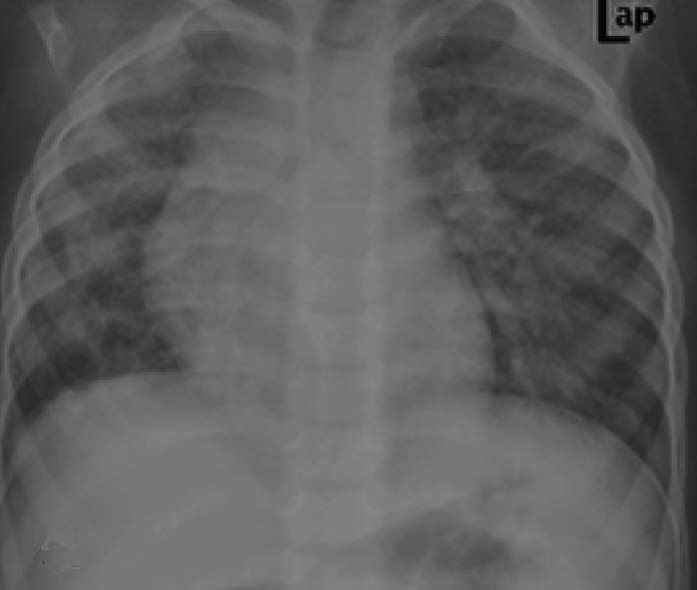
12岁女孩,变应性支气管肺曲霉菌病。
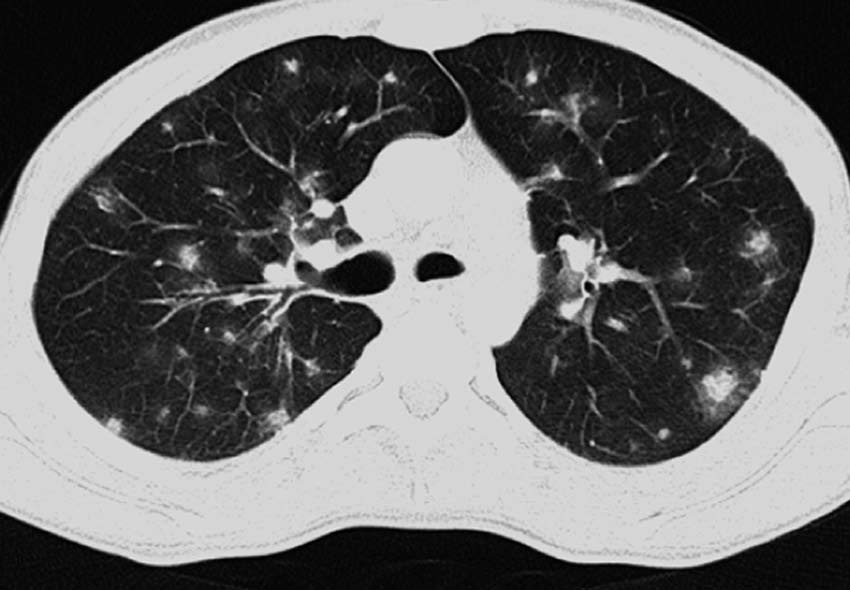
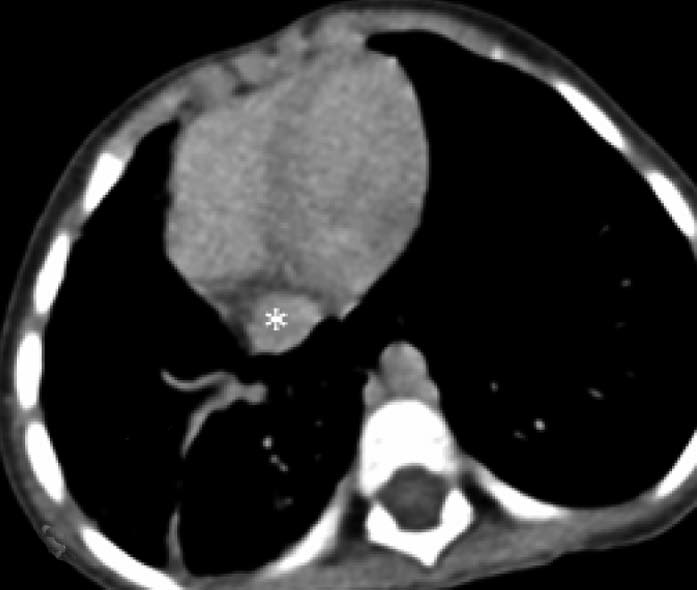
17岁男孩,急性淋巴细胞白血病,伴血管侵袭性曲霉菌病
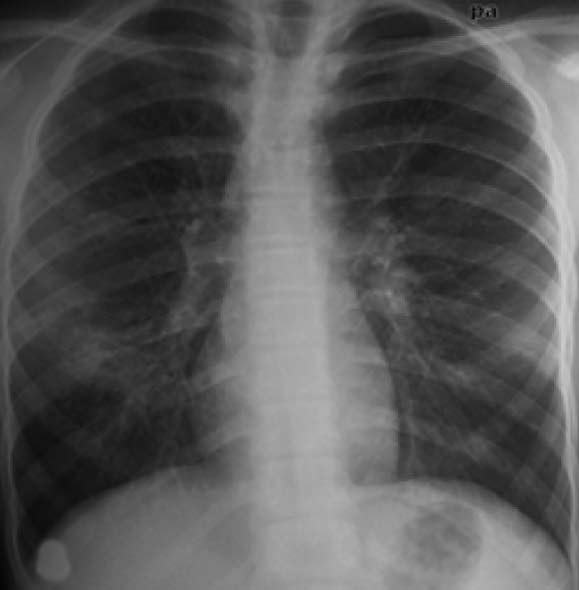
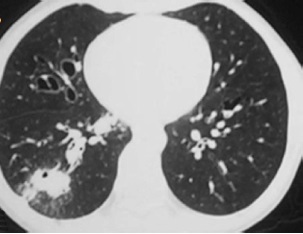
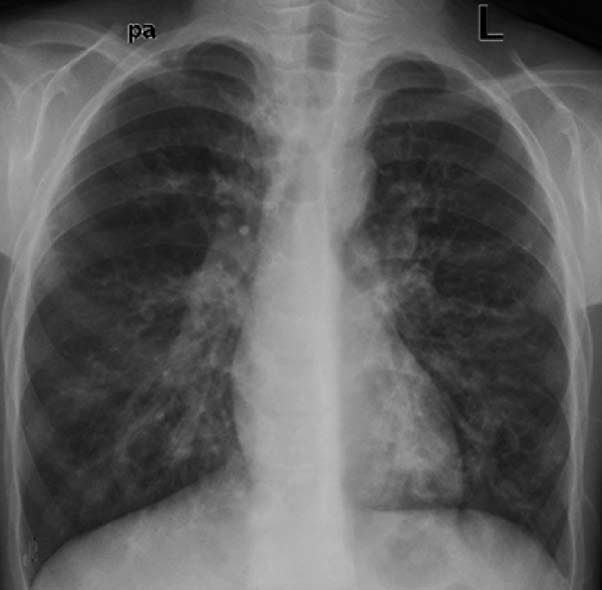
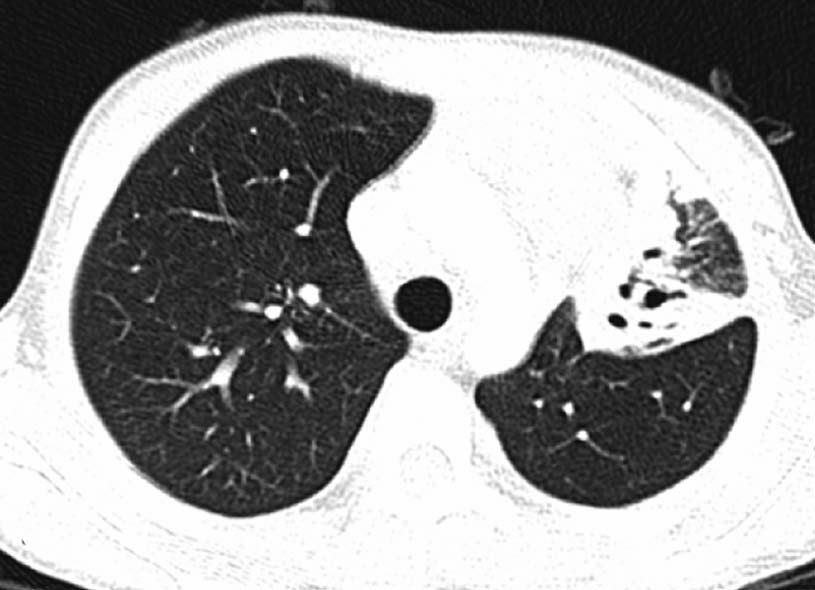
10岁男孩,感染性支气管扩张症。
2. 奶蛋白过敏(milk protein allergy)或 Heiner 综合症【8】 3. 先天性心脏病(congenial heart disease),这个年龄段咯血主要原因。
Older or late Childhood:最常见病因是急性下呼吸道感染(细菌、病毒、霉菌和寄生虫)占40%的原因【3】 4. 血管炎(vasculitis),常见 5. 支气管肿瘤(支气管类癌和支气管腺瘤):常见。 气管肿瘤是罕见引起咯血的原因之一。支气管类癌是最常见的儿童原发性肺肿瘤。病变可以是中央型,也可以是支气管周围型。影像学发现包括肺门或肺门周围分叶状肿块和气道阻塞改变,如肺不张、实变、支气管囊肿(bronchocele)或过度充气【38】。在CT上,类癌可以显示边缘清楚(well-defined)位于中心的肿物可以致气道狭窄或变形,包含弥漫或断续的钙化(punctuate calcification)。它显示明显均匀一致的造影剂增强。但是,所有类癌并不增强。有可能看见肺阻塞性变化和纵膈/肺门淋巴结肿大【39】。
支气管扩张(Bronchiectasis) 能够继发于吸入肺炎、感染、囊性纤维和ciliary dyskinesias。胸片,表现为轨道征( ‘‘tram-track’’), 平行不透光影,圆形不透光影、管型结构。但是胸片对发现轻中度疾病不敏感。CT有较高的敏感性,在CT影像上支气管扩张的特征是缺乏正常支气管渐渐变细,在肺周围1cm可见支气管的存在,而气管动脉比超过1(印鉴征-signet ring sign)。病因可以通过解剖位置和病理分布而缩窄。吸入性肺炎倾向于下叶(右>左)。囊性纤维显示为上叶过度充气和纤维侵润。由于ciliary dyskinesias导致的支气管扩张多出现在下叶【27】。
7. 肺血管疾患:肺动脉或静脉发育不良(Aplasia/hypoplasia of pulmonary artery or veins);原发性肺动脉高压;肺动脉狭窄;肺动脉血栓栓塞(Pulmonary thromboembolism);肺动静脉畸形(Pulmonary arteriovenous malformation)。将近5%的囊性纤维化病人可以表现为严重咯血【7】。这与多支气管肺动脉吻合存在相一致,支气管动脉肥大引起。
7岁男孩囊性纤维
单侧肺动脉缺如(Unilateral Absence of a Pulmonary Artery,UAPA):20%的患者以咯血为首发症状【40】。咯血的原因是过度的侧支循环。有的患者咯血有一定的自限性,但有的患者会导致大咯血甚至死亡。常被误诊为支气管扩张。临床不论以反复肺部感染为表现的支气管扩张还是以反复咯血为表现的支气管扩张均应考虑到UAPA,借助于胸部平片和胸部多排CT可以鉴别。 肺叶静脉发育不良
肺动静脉畸形(Pulmonary arteriovenous malformations):
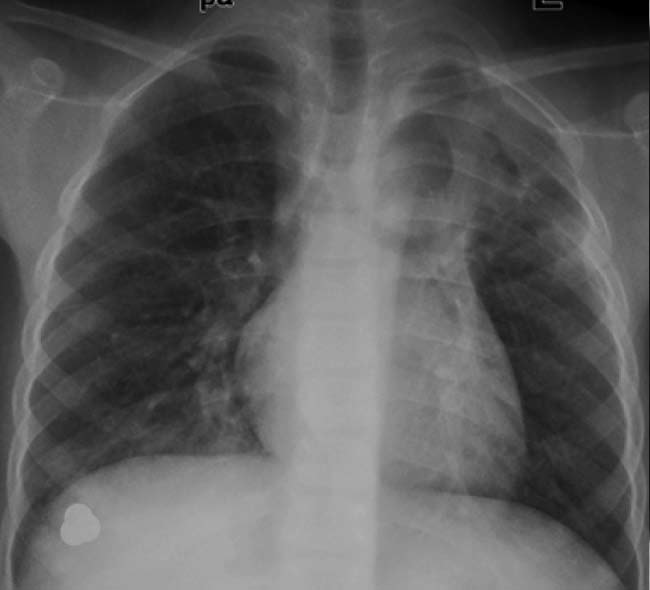
肺动静脉畸形是肺动脉分支和肺静脉之间直接沟通没有毛细血管床。它和遗传性出血性毛细血管性扩张症有很强的相关性【34】。胸片是诊断和随访的重要方法。典型的发现是圆形或卵圆形肿块,呈分叶状,大小1-5厘米。2/3位于下叶。可见连接的血管由肺门发出。MDCT可以更精确地识别肺动静脉畸形和连接的血管。肺动静脉畸形的快速血流在MRI呈低信号。血管造影仍然是诊断肺动静脉畸形的金标准。并在栓塞或外科切除前定义肺动静脉畸形的病理解剖情况。
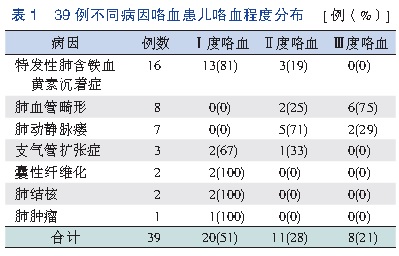
肺特发性含铁血黄素沉着症( Idiopathic pulmonary hemosiderosis,IPH)
肺特发性含铁血黄素沉着症是罕见的肺部疾患,表现为咯血、贫血和胸片上弥漫实质浸润三联征(triad)【35】。通过在支气管肺泡洗液(broncho-alveolar lavage fluid)、痰或胃汲取液中发现含铁血黄素巨噬细胞(hemosiderin-laden macrophages)得到确诊。继发性含铁血黄素沉着症与全身血管炎、出血性疾病和心脏疾病相关。影像学发现是非特异性和需要与临床和实验室检查结合达到IPH的诊断。胸片显示对称性弥漫或斑片状肺泡阴影很少出现在肺尖,随访过程中这些斑片状可以消失。CT能显示弥漫性或斑片状毛玻璃阴影或有些病例还有间质增厚【36】。
异物(Foreign body)
异物吸入可以是<3岁患儿咯血的主要原因之一。误吸异物时,如果异物是不透光的可以通过胸片看见。和胸片相关的发现包括非特异性的浸润,肺不张、过度充气的区域、肺实质实变或支气管扩张。胸片可以表现为正常占30%病例,MPR和CT腔内虚拟支气管镜可以清楚地勾勒出异物的形状、位置和大小。它能显示相关的肺实质变化。因此,影像可以帮助外科医生计划应用支气管镜安全 的移除异物【37】。
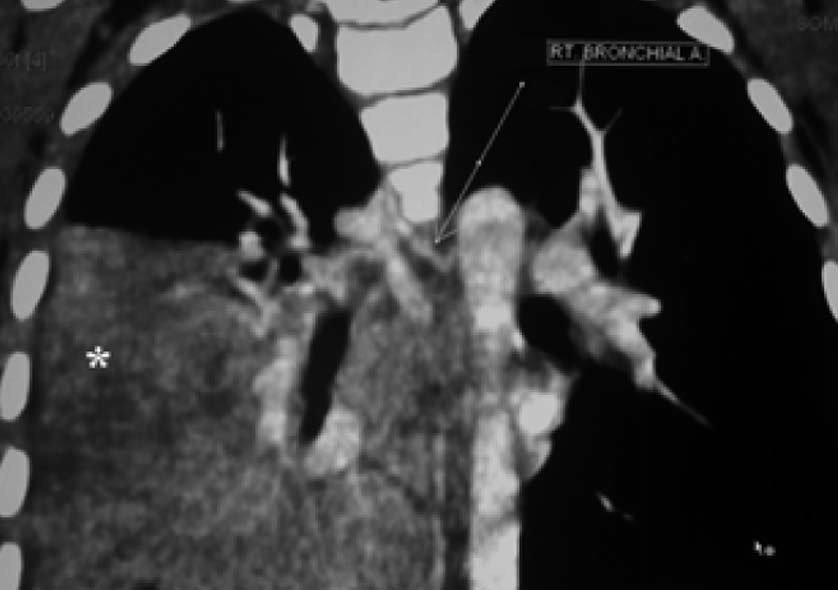
支气管动脉瘤
Patel R, Uchida D, Feola GP, Meier JD. Bronchial artery pseudoaneurysm as an unsuspected cause of hemoptysis in a pediatric patient. Ann Otol Rhinol Laryngol. 2014 Aug;123(8):591-5.
8. 炎症(inflammation) 9. 肺泡出血综合症(Alveolar hemorrhage syndrome)。 肺含铁血黄素沉着症虽不常见,但在儿童可以引起严重的咯血。 10. 特发性(Idiopathic) 11. 风湿病相关疾病(Associated with rheumatologic disease) 12. 肺肾综合征(Pulmonary-renal syndrome) 13. 非气管来源肿瘤 14. 外伤 肺接受双重供血。一个来自较高压力的支气管动脉(占1%),为气道和肺动脉滋养血管,其它99%来自压力相对低的肺动脉并参与气体交换。支气管血管在靠近肺动脉营养血管水平体循环和肺动脉毛细血管之间由薄壁吻合【5,6】。 肺血管阻塞性疾病(先心、血管炎和栓塞)由于肺动脉血流减少,导致这些吻合网开放,使本已脆弱血管加入来自支气管动脉的高压血流。咯血是由于血流破裂进入肺泡和支气管。 小儿咯血主要来自支气管动脉。大咯血危机生命的主要原因为出血淹没(flooding)气道导致窒息(asphyxiation)。 在气管支气管感染的情况下,作为气道炎症的结果,气管充血、脆弱更易于出血。慢性感染(如支气管扩张症)由于血管生长因子的释放可以导致全省血流增加,导致新生血管和倾向于破裂“弱”血管形成。 小儿咯血的影像学评估 角色 : 小儿咯血虽不常见,但备受父母和儿科医师的担忧(immense concern)。由于难以诱出清晰的病史和进行详尽的体检使诊断变得困难,特别是咯血量较少的患儿倾向将血痰吞咽使发病之初可能没有注意到。影像学扮演的重要角色包括(1)出血来源;(2)潜在原因;(3)制定治疗计划(roadmap for invasive procedure)。明确咯血表现,确定出血原因下一步才是考虑治疗的防范。 影像学检查方法:
评价和解释 1. 肺实质:出血位置的定为基于:on the basis of presence 1)在段和叶支气管内液体密度物质的存在(fluid density material in the segmental and lobar bronchi) 2)表现为肺泡出血的模糊实变毛玻璃样改变(ground-glass opacity with hazy consolidation which represents alveolar hemorrhage) 但: 1)急性出血可能掩盖潜在的病理;( Acute hemorrhage can mask the underlying pathology) 2)血凝块也能够相似于肿块;(Blood clots can also simulate more ominous entities like masses)
2. 气管支气管树:有无狭窄,包括腔内(异物、肿瘤)或腔外原因(淋巴结,纤维纵膈炎)(This should be evaluated for presence of any stenosis
which may be due to intraluminal (foreign body, neoplasm) or extraluminal (lymphadenopathy, fibrosing mediastinitis) causes。多平面重建影像( Multiplanar reformatted images,MPR)可以精确地发现病变、描述狭窄的程度,远端(支气管)影像, 在选择的位置计算隆突到病变的距离【9】。
. 3. 肺动脉:外在或内在原因导致的任何狭窄肺动脉狭窄。伴随胸膜下区域增强存在可以认为肺梗死。肺动脉也能够显示扩张(Rasmussen 动脉瘤)和肺动静脉畸形。
4. 支气管动脉(Bronchial arteries):咯血95%来自于支气管动脉【12】。支气管动脉直径超过2mm被认为异常【13】。70% 的支气管动脉发自T5~T6水平的降主动脉。通常有1或2支动脉供应每一侧肺,或独立或共干支气管动脉供应每一侧肺。在轴位影像刚好在主动脉弓下水平下纵膈后它们显示为增强结节聚集。活动性出血罕见被CT发现。不规则支气管动脉被定义为T5-T6水平之外发出的动脉。它们开口最常见的位置主动脉弓凹侧【14】。
5. 非支气管动脉(Non-bronchial systemic arteries):支气管动脉能够发自头臂动脉、锁骨下动脉、腋动脉、乳内动脉和膈下动脉的膈下动脉分支以及腹腔动脉【15,16】。在CT上,可以看见与支气管形成不平行的迂曲扩张的动脉。伴随增强动脉,在胸膜外脂肪,胸膜增厚大于3mm的存在是这些血管存在的线索【17】。 6. MRI:在急性咯血影像评价MRI没有任何实用价值。因它有优越软组织分辨率,在急诊情况下它可以很好的评价纵膈和肺门,但它不能提供更好的肺实质信息,仅可以用于证实动静脉畸形和描述在纤维化纵隔炎内软组织的特征。随着超高极化核3He 和129Xe引进,MRI的范围从有限的应用扩大,高敏感地评价肺结构、功能和代谢情况【18】。哮喘和囊性纤维化病人的动态影像和通气显示阻塞和通气缺损的个体化局部类型。其在早期诊断,检测疾病进展和评价对治疗的反应可能还要走很长一段时间【19-21】。 2. Knott-Craig CJ, Oostuizen JG, Rossouw G, Joubert JR, Barnard PM. Management and prognosis of massive hemoptysis. Recent experience with 120 patients. J Thorac Cardiovasc Surg. 1993 Mar; 105(3):394-7. 3. Turcios NL, Vega M. The child with hemoptysis. Hosp Pract (Off Ed). 1987 Oct 15; 22(10):214, 217-8. 4. Sim J, Kim H, Lee H, Ahn K, Lee SI. Etiology of hemoptysis in children: a single institutional series of 40 cases. Allergy Asthma Immunol Res. 2009 Oct; 1(1):41-4. 5. PUMP KK. The bronchial arteries and their anastomoses in the human lung. Dis Chest. 1963 Mar; 43():245-55. 6. Deffebach ME, Charan NB, Lakshminarayan S, Butler J. The bronchial circulation. Small, but a vital attribute of the lung. Am Rev Respir Dis. 1987 Feb; 135(2):463-81. 7. Stern RC, Wood RE, Boat TF, Matthews LW, Tucker AS, Doershuk CF. Treatment and prognosis of massive hemoptysis in cystic fibrosis.
Am Rev Respir Dis. 1978 May; 117(5):825-8.
8. Dearborn DG. Pulmonary hemorrhage in infants and children. Curr Opin Pediatr. 1997 Jun; 9(3):219-24. 9. Sundarakumar DK, Bhalla AS, Sharma R, Hari S, Guleria R, Khilnani GC. Multidetector CT evaluation of central airways stenoses: Comparison of virtual bronchoscopy, minimalintensity projection, and multiplanar reformatted images. Indian J Radiol Imaging 2011; 21: 191-194 [PMID: 22013293 DOI: 10.4103/0971-3026.85366] 40. de Mello Junior WT,coutinho Nogueira JR,Santos M,et al. Isolated absence of the right pulmonary artery as a cause of massive
hemoptysis. Interact Cardiovasc Thorac Surg,2008,7:1183-1185.
|