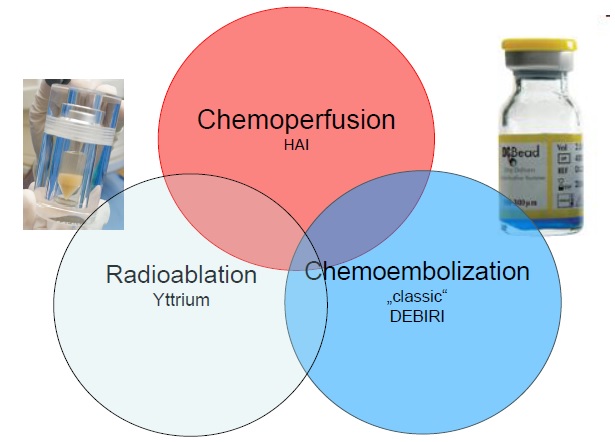
背景因素 不可切除的结肠癌肝转移,以目前的全身化疗方案1、2年的生存率分别是55%和33%。 当作为一线化疗失败后是个什么样的情形? 1. 作为二线联合伊立替康(irinotecan)或 奥沙利铂(oxaliplatin)+5-FU/甲酰四氢叶酸(leucovorin)乏善可陈。总体反应率(RR=CR+PR)4-21%;无进展中位生存期(Progression-Free-Survival,PFS)2.5-4.8月[1-3]。 2. 联合分子靶向药物(avastin/cetuximab)增加客观反应率(Objective Reaction Rate,ORR)23%和疾病进展时间(Time To Progression,TTP)4.1月。 3. 并不是所有的病人都能耐受多药物的全身化疗 有一个概念称之为转移性结肠癌肝直接治疗(Liver-directed therapies in m-CRC),包括: - 肝切除 - 经皮热消融 - 肝动脉灌注化疗(Hepatic Artery Infusion Chemotherapy)-HAI - 动脉化疗性栓塞(Transarterial Chemoembolization)-TACE - 动脉放疗性栓塞(Transarterial Radioembolization)-RE 我们为什么要在全身化疗中进行局部治疗呢?主要原因包括,大约有1/3转移性结肠癌的病人仅局限在肝内;当肝转移是疾病的仅有的位置时,完全消融是唯一治愈的希望,切除后5年生存率在35%~50%之间。当肝转移癌是病变的唯一位置或病变的主要位置时,肿瘤细胞减灭术对于病人可以获益,只要允许治愈性切除。因为2/3病人最终死于肝转移,这种治疗潜在增加整体生存率。 经动脉治疗是结肠癌肝转移肝直接治疗的一部分,其肿瘤细胞减灭术或许对病人有益。什么是经肝动脉治疗呢?
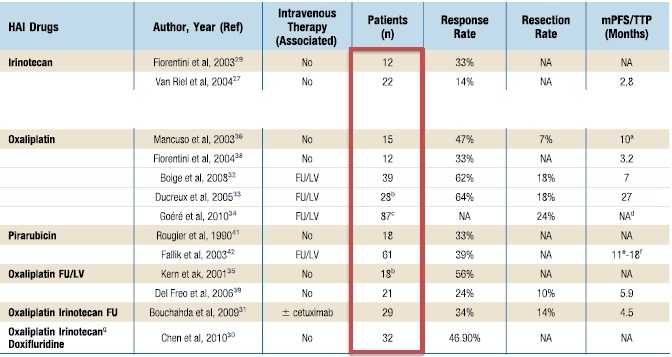
为什么和什么时候我们应该考虑进行经动脉的肝转移癌的介入治疗呢? 1. 肝转移癌一般由肝动脉血管网优先灌注。所以经肝动脉灌注化疗药物时,肿瘤部分灌注优先 2. 肿瘤可以暴露在高浓度的化疗药物中,避免了首过效应(First Effect,又称第一关卡效应,其指某些药物经胃肠道给药,在尚未吸收进入血循环之前,在肠粘膜和肝脏被代谢,而使进入血循环的原形药量减少的现象,在这里指药物还没有进入肿瘤前被血浆蛋白结合或被代谢,进入肿瘤原型药物减少的现象)和全身副反应。 3. 肝内转移癌多数不是外科手术的适应症 4. 大约有1/3的结肠癌肝转移最终仅局限在肝内 5. 一般当一线或二线治疗失败的情况下考虑进行经肝动脉的治疗。 本栏目所涉及的仅仅是结肠癌经动脉治疗中的化疗性栓塞,又被称为TACE(Transcatheter arterial chemoembolization)在文献检索中篇幅较少。  文献量小或者疗效不佳,或被其他治疗取代或者因为研究不充分。这里检出其中部分文章。 究竟影响结肠癌肝转移病变的障碍是什么呢?下表有个说明。
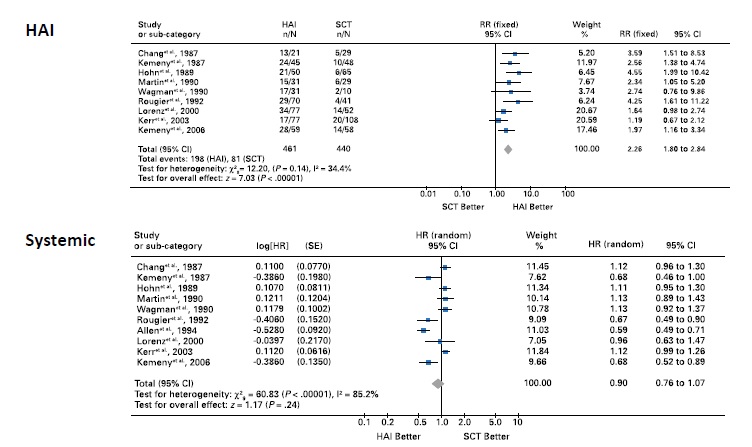
肝动脉化疗性灌注与全身化疗对比的荟萃分析[9](基于 Fluoropyrimidine-氟尿嘧啶的方案)
这一结果表示氟尿嘧啶方案肝动脉灌注的失败? 肝动脉灌注的其它方案呢?
Lang等人1993年报告46例结肠癌肝转移患者经肝动脉进行选择性化疗性栓塞。经导管75%选择肝肿瘤动脉,25%经肝总动脉灌注阿霉素(doxorubicin)+碘油(Lipiodol)。8例完全缓解(CR),13例稳定(SD)达2年,7例生存期超过3年[4]。 Sanz-Altamira 等人1997年 报告II期临床试验(治疗作用初步评价阶段,包括目标适应症的疗效和安全性)。40例肝转移患者(1000mg 5FU,10mg 丝裂霉素,10ml 碘油+明胶海绵)进行选择性肝动脉灌注栓塞。中位生存期(表示只有50%的个体可以活过的时间)10月,较长中位生存期的病人生存质量较好,并且转移限定在[5]。 Muller 等人在2003年报告66例结肠癌肝转移患者,其中54%以前进行过各种方案的化疗。共进行了299次TACE治疗。方案包括持续性肝动脉内5FU+ 粒细胞集落刺激因子(GM-CSF)一次性灌注,马法兰化疗性栓塞。按WHO实体肿瘤评价标准,CR1.0%,PR 42.4%,SD 18.2%,TTP 8月。28个月观察未达到中位生存[6]。 Vogl 等人2012年报告224例结肠癌肝转移患者共计进行750次TACE。分组如下
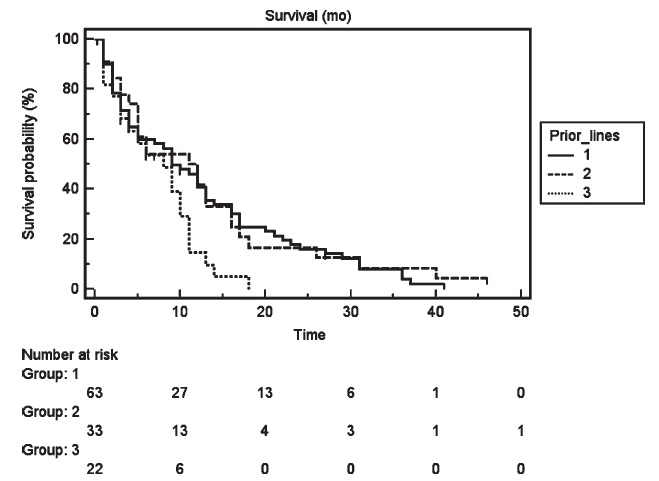
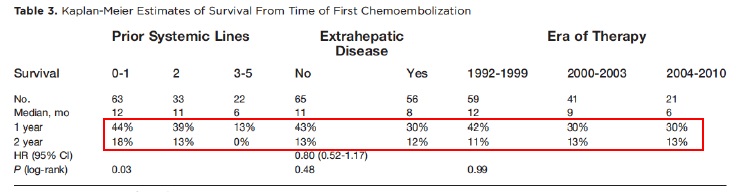
Marissa Alber 等人2011年报告121例,全身化疗1-5线化疗控制肝转移癌失败患者,共计245次化疗性栓塞,平均每个病人两次。主要方案10mg 丝裂霉素C/50mg 阿霉素类/100mg 顺铂+碘油+PVA。
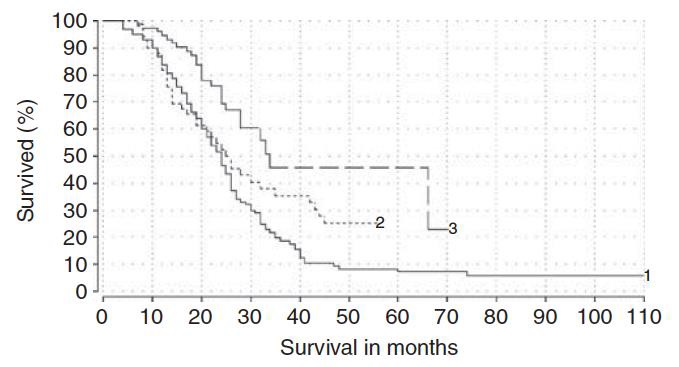
TTP = 5个月;N=84 评价肿瘤指标,其中 N=42例下降> 50%;1-、-2、-5年存活率分别为36%、13%、2%。中位生存时间不伴有肝外转移(EHD)=11月(好于补救化疗* salvage chemotherapy?),伴有肝外转移的中位生存时间=8个月。
* 补救化疗(salvage chemotherapy):一线化疗方案失败。需换用其它的二线、三线化疗方案 结论: 1. 结肠癌肝转移,目前的研究还不十分充分 2. 纳入研究标准不不统一 3. 各种方案不尽相同,化疗药物选择,化疗药物数目选择,栓塞剂的选择和栓塞次数的选择都不一样 4. 如何报告结果不统一 5. 不管怎么说,TACE 被证实是有效的,尽管化疗药物选择,栓塞剂选择和栓塞方法的选择不一。 评论: 截止今天,结直肠癌肝转移仍然是一种全身性疾病,肝直接治疗(Liver-Directed Treatments,LDTs)的治疗适应症有限。目前为止还没有强有力的数据支持结直肠癌肝转移经LDTs治疗后整体生存率提高,相关的试验多为II-III期的临床试验。也没有确保生存质量情况下最佳时机的专家共识。LDT常常在没有其它事情可做的情况下的一种应用。多学科综合治疗协作组(MDT)在其临床判断过程中,从开始就没有把介入放射学作为整体考虑进去,LDT也不是在所有医院都在应用。 1. De Gramont A, Vignoud J, Tournigand C, Louvet C, André T, Varette C, Raymond E, Moreau S, Le Bail N, Krulik M. xaliplatin with high-dose leucovorin and 5-fluorouracil 48-hour continuous infusion in pretreated metastatic colorectal cancer. 2. De Gramont A, Vignoud J, Tournigand C, Louvet C, André T, Varette C, Raymond E, Moreau S, Le Bail N, Krulik M. Oxaliplatin with high-dose leucovorin and 5-fluorouracil 48-hour continuous infusion in pretreated metastatic colorectal cancer. Eur J Cancer. 1997 Feb;33(2):214-9.
5. Sanz-Altamira, Pedro M.; Spence, Liam D.; Huberman, Mark S.; Posner, Marshall R.; Steele, Glenn Jr.; Perry, Laura J.; Stuart, Keith E. Selective chemoembolization in the management of hepatic metastases in refractory colorectal carcinoma: A phase II trial. Diseases of the Colon & Rectum. 40(7):770-775, July 1997.
6. Müller H, Nakchbandi V, Chatzisavvidis I, von Voigt C. Repetitive chemoembolization with melphalan plus intra-arterial immuno-chemotherapy within 5-fluorouracil and granulocyte-macrophage colony-stimulating factor (GM-CSF) as effective first- and second-line treatment of disseminated colorectal liver metastases. Hepatogastroenterology. 2003 Nov-Dec;50(54):1919-26.7. Vogl TJ, Jost A, Nour-Eldin NA, Mack MG, Zangos S, Naguib NN. Repeated transarterial chemoembolisation using different chemotherapeutic drug combinations followed by MR-guided laser-induced thermotherapy in patients with liver metastases of colorectal carcinoma. Br J Cancer. 2012 Mar 27;106(7):1274-9. 8. Marissa Albert, Matthew V. Kiefer, Weijing Sun, Daniel Haller, Douglas L. Fraker, Catherine M. Tuite, S. William Stavropoulos, Jeffrey I. Mondschein and Michael C. Soulen. Chemoembolization of colorectal liver metastases with cisplatin, doxorubicin, mitomycin C, ethiodol, and polyvinyl alcohol. CANCER Volume 117, Issue 2, 15 January 2011, Pages: 343–352 9. Mocellin S, Pilati P, Lise M, Nitti D. Meta-analysis of hepatic arterial infusion for unresectable liver metastases from colorectal cancer: the end of an era? J Clin Oncol. 2007 Dec 10;25(35):5649-54. 10. Seront E, Van den Eynde M. Liver-directed therapies: does it make sense in the current therapeutic strategy for patients with confined liver colorectal metastases? Clin Colorectal Cancer. 2012 Sep;11(3):177-84. | |||||||||||||||||||||||||||||||||||||||||||