什么是严重肾严重出血栓塞的绝对适应症? 临床标准:存在肾严重出血或持续性血尿,需要积极的治疗。 讨论:给一个症状性疾病下定义的目的是要说明(精确说明或是模糊说明)疾病严重的程度或许也负担指导治疗的功能。例如严重咯血,为500ml/24hrs,或严重产后出血的定义都意味着积极栓塞的适应症。严重肾出血意味着需要积极地干预治疗。很明显如果出血量大到病人生命体征不稳定,应该积极地治疗(文献上还有用需要输血来形容出血严重性)。但有时肾一次性出血量很大,但主要出血被肾包膜限制,尽管腹膜后有巨大血肿,只要出血停止可以观察至血肿吸收。 或许可以给肾严重出血的量一个规定,如500ml,或单位时间内出血的量,如500ml/日,或一个范围,如500~800ml等;其实临床上很难计算严重肾出血的出血量,不管是血尿还是肾周围血肿;为了形容出血的严重性可以用持续时间来形容出血的严重性。文献上还会形容出血严重的情况如需要输血多少的单位,如5个单位;或血色素下降等; 什么样的肾出血量有肾动脉栓塞的需求?没有专家共识,更不用说各种高级别的证据研究。其实由于出血被限制在肾筋膜内,所谓“填塞效应”,会压迫出血的犯罪血管,导致自发性出血停止,甚至自愈,导致严重肾出血也有自发性出血停止。另外,出血量不多,没有达到所谓的“严重出血”,但明显有动静脉瘘或假性动脉瘤形成,也不能保证不是栓塞的适应症,因为你不能保证这些病变在患者的预期寿命中不会出血。 所以,真要规定某某出血量,持续某某时间就一定是有肾动脉栓塞需求的标准还是非常困难的。版主认为,即使是出血,可以确定出血的犯罪血管,如果你又有经验(使用微导管的经验和特定栓子的经验)精确进行栓塞,确保靶血管本身栓塞,不影响非靶血管。你就可以实施栓塞治疗。 但你一定心理有数,大多数病人不治疗也可以治愈,你就要不断地压制你想要栓塞的冲动。各种因素的综合平衡,甚至要想到一旦操作出现某种意外情况,如造影显示出血是个肾段近端的宽口动脉瘤等,你导管室有足够的备货吗,实施瘤囊填塞吗,若行载瘤动脉的栓塞,肾功能承受的了吗?这样的问题其实很小,但在每个导管室很普遍。这种临床决定的煎熬,并非临床路径所能规定的,和循证医学所能指导的,全凭你的经验! 但至少肾严重出血表现为生命体征不稳定,影像学证实有明确的造影剂自由外溢(free extravasation)都是你要积极的处理的,最大限度地保护靶肾功能的肾动脉栓塞无论如何是首选,不用管AAST(American Association for the Surgery of Trauma)说什么。 CT标准:肾筋膜的完整性、周围血肿边距、造影剂外溢 增强CT是腹盆部创伤病人严重肾出血,肾动脉栓塞相对可靠的指标[9]。但这一指标特异性和阳性预测值(positive predictive value,PPV)都很低。CT发现阳性血管病变的肾创伤病人,随后仅50%的病人血管造影发现出血犯罪血管。这可能是由于周围组织和血肿压迫出血的血管的结果。 肾脏位于腹膜后,有坚韧的肾筋膜(Gerota's fascia)包裹。当血肿在肾筋膜内填塞的时候,肾血管损伤出血可以自我限制,而肾筋膜破裂,血肿的填塞就不会形成[10]。Fu等人[11] 以CT肾筋膜连续性破坏为标准划分肾动脉栓塞适应症的有效性,其阳性预测值为92%,阴性预测值为78%。对比Charbit等人的研究[12]认为肾筋膜的连续性并非除外肾动脉栓塞的好的CT标准,因为在疾病的早期阶段,进行CT检查减少这一参数的预测值。肾筋膜是一个纤细的组织结构,厚度小于2mm,在CT上很难发现。肾筋膜被包埋在血肿内其完整性也很难识别。 腹膜后间隙由几个潜在相互交通的间隔(compartments)组成[13]。虽然并不能预测是否由于大血肿或周围组织压迫的填塞已经发生,但广泛的血肿暗示有严重的出血。但造影剂外溢和血肿是预测肾动脉栓塞需求是最有效的[14]。有理由认为CT显示同时存在的造影剂外溢和广泛的血肿表明填塞还没有形成。如果此种情况严重或持续,出血将不会自发停止,甚至当大血肿压迫出血动脉时也很难停止出血。因此重要的是对于严重血肿的病人活动性出血的存在,尤其是动脉出血或出血来自持续出血或复发出血危险性较高的近段血管的出血[15]。 Nuss 等人证实[16]周围血肿边缘距离(peripheral hematoma rim distance ,PRD)>4cm 结合造影剂外溢与肾动脉血管内栓塞需求密切相关。Dugi 等人[17]和Charbit 等人[12]用不同的PRD的限定值报告类似的结果。但Lin 等人[14]认为,虽然PRD与肾动脉栓塞需求密切相关,并且PRD结合造影剂外溢或血肿的范围,或结合两者都提高阳性预测值和阴性预测值,但这些标准没有一个比造影剂外溢和血肿的范围相结合,更能预测严重肾出血血管内栓塞的需求。 回顾性分析肾动脉栓塞需求CT标准的敏感性、特异性,预期值[14] 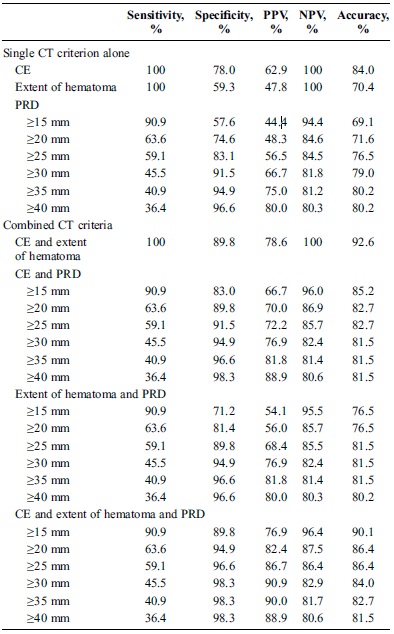
那么,没有造影剂的外溢就不需要肾动脉栓塞吗? 文献上报告[12,17] %~8%的病人没有造影剂外溢也进行了肾动脉栓塞。Shanmuganathan 等人[18] 证实出血的犯罪血管可能由于CT增强的技术不标准而漏掉。暂时性出血停止也可以导致CT和血管造影的造影剂外溢的阴性发现,一旦休克复苏治疗增加血压时再次出血。 讨论:或许有人认为这个标准可能太低,不需要进行血管造影。或许也有人认为标准太高,早应该进行血管造影。但对于一个严重肾出血的患者,可能还是多发、复合损伤的患者,我们其实不需要等到病人达到标准或直到失血性休克或者直到出现进行性出血的征象才考虑进行栓塞。 早期控制出血甚至对于未出血的血管病变如假性动脉瘤或动静脉畸形实施出血前的栓塞,除了可以预防潜在的肾严重出血,而且精确地栓塞可以最大限度地保护肾功能。这一方法被称为“损伤控制(damage control)的积极处置的策略,不仅减少出血和输血相关的低体温、酸中毒、凝血障碍和并发症[7],而且避免较大血肿导致的疼痛、十二指肠阻塞和罕见的腹腔间隔是综合症[8]。 Charbit等人[12]83%(10/12)获益于血管造影时的栓塞;文献中这一比率在16%~54%之间[10,11,16]。有些病人进行栓塞时不必要的,应该联合考虑临床情况和CT征象,而不是仅考虑CT的征象[10,11,16]。 什么是严重肾出血栓塞的相对适应症? 什么不是严重肾出血肾血管栓塞的适应症? (保守治疗的适应症) 多数病人经过保守治疗以后,肾血管损伤可以自发性愈合;因此经皮血管病变的治疗或外科手术仅仅在严重出血、肾出血持续72小时,或肾功能进行性恶化的情况下进行[1,2]。目前没有关于严重肾出血肾动脉栓塞绝对适应症的专家共识。反之也是一样的,没有除外肾动脉栓塞的CT和临床标准的专家共识。肾严重出血肾动脉栓塞可以最大限度地保存肾功能,而保守治疗除外肾动脉栓塞的需求则更能最大限度地保存肾功能。 根据AAST(American association for surger of trauma)的器官损伤分级(Organ Injury Sscale ,OIS)[19],腹部增强CT被认为是最初评价创伤病人肾损伤的金标准[21,22]。如果没有肾出血或静脉蒂损伤发现,60%-80%的创伤肾推荐非手术治疗[5,6]。无手术止血,或非手术肾切除和保守治疗的成功率80~100%[20]。而AAST OIS增加,成功率下降[5,23]。
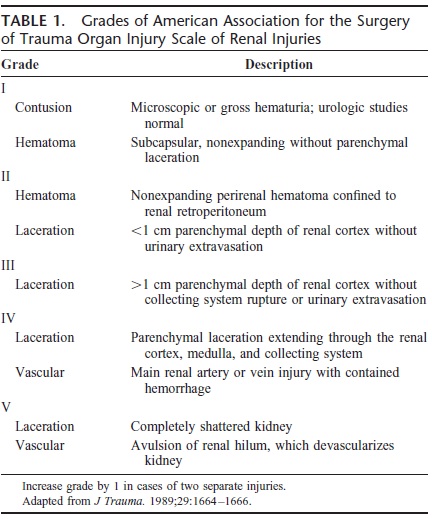 文献中肾创伤严重肾出血,需要肾动脉栓塞的患者为10%-40%[10,11,16]。肾动脉栓塞可以减少高级别肾损伤保守治疗的失败率[4,10]。血管造影适应症被定义为临床肾来源的持续出血的状态,栓塞依据血管造影标准进行,特别是肾的影像学检查和活动性出血的表现[10]。 多发性复合伤常常难以判定肾来源的出血。研究显示为所有高级别肾损伤病人,分析血管造影不可能[10,16]。CT用于选择性病人,这些病人可能受益于肾动脉严重出血后的肾动脉栓塞。可能的标准包括[11,16]: (1)周围血肿边缘距离(peripheral hematoma rim distance):Dugi 等人[17]显示PRD是肾创伤的后肾动脉栓塞的独立的预测因子,PRD被设置为3.5cm,但这项研究中没有病人接受肾动脉栓塞。Charbit等人[12]按照≥3.5cm,阳性预测值为100%,但阴性预测值很低。而设置PRD为2.5cm预测精确性达到87%。 (2)肾筋膜的连续性中断(discontinuity of Gerota fascia):Fu等人[11]报告12例肾筋膜连续性中断的病人其预测肾动脉栓塞的阳性预测值为92%,阴性预测值为89%。很多作者认为这并非是一个除外高级别肾损伤病人肾动脉栓塞的很好的CT标准。因为早期CT扫描减少这一参数的预测值。但其仍然是肾间隙出现出血填塞的良好标识。如果肾筋膜破裂,填塞止血就不会发生,血肿将继续向肾周围间隙扩散,肾损伤和血流动力学改变将会恶化。 (3)血管内造影剂外溢(intrvascular contrast extravasation,ICE):肾血管造影剂外溢是预测严重肾出血关键的危险因素。Dugi等人[17]研究显示55%病人CT有血管内造影剂外溢病人进行了干预治疗,相比之下没有这一CT征象的病人仅有8%。Fu等人[11]报告所有高级别肾损伤CT有ICE的患者进行了血管造影,其中54%进行了肾动脉栓塞;但是该研究并没有提示是否没有这一CT征象的患者也从栓塞中获益。Nuss等人[16]报告所有高级别肾损伤有CT-ICE征象的患者进行了肾动脉栓塞术。Charbit等人[12]显示这一数据为58%,需要输血的患者为78%;缺乏这一征象的需要进行肾动脉栓塞术的分别为7%和17%。比较Nuss等人[16]报告相一致的患者需要进行肾动脉栓塞的患者为0%。 临床上表现为持续出血高级别肾损伤患者,单独CT缺乏ICE并不能除外肾动脉栓塞术的需求。Charbit等人[12]病例组中三例显示这类病人有血管撕裂而接受了栓塞。 如此说来,没有一个单独的CT标准可以除外血管造影的适应症,CT的标准应该联合应用。Charbit[12] 建议以ICE为中心的高级别肾损伤严重肾出血病人的CT算法。
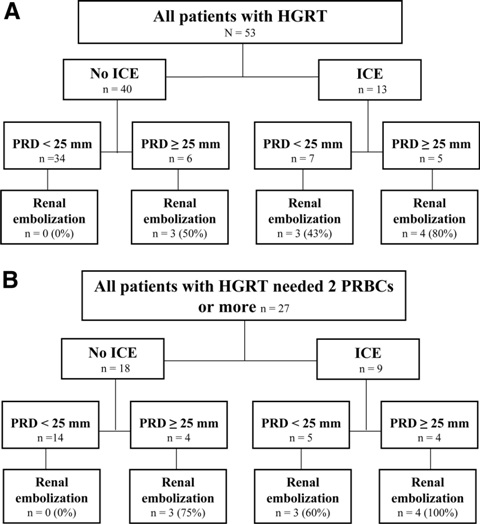 这些病人中,CT扫描存在ICE需要进行血管造影,肾栓塞的阳性预测值为78%,如果缺乏ICE,血管造影是否做取决于PRD是否为2.5cm,如果是2.5cm,应该进行肾动脉栓塞以改善肾的预后。 Charbit 等人[12]证实应用CT扫描策略可以了解高级别肾创伤病人靶血管持续出血的情况,保证保守治疗较高的成功率。这一研究仅有20%的病人需要进行肾动脉栓塞术。单独用一个CT标准缺乏特异性和不能满足除外肾动脉栓塞的需求。他们的结论是没有血管内,周围边缘距离<2.5cm,可除外肾动脉栓塞术的适应症,甚至病人需要输血的时候。按Charbit等人的标准,保守治疗的失败率仅为4%,说明其判断肾动脉栓塞的标准的敏感性是正确的。这项研究首次按照肾动脉栓塞术比较高级别肾损伤患者群保守治疗的成功率和结果。事实上,Charbit这种基于保守治疗的成功判断其策略的成功性,这一结果并不十分清楚。血管造影上活动性出血抑制并不是评价治疗的充分标准。再者,以前的研究[10,11,16]也并没有考虑临床状况进行血管造影和栓塞; Nuss等人研究报告进行血管造影50例高级别肾损伤进行保守治疗,其中8例(16%)进行了栓塞治疗,但没有一个病人肾损伤级别超过5的被包括在内,这里有很明显的选择性偏差,也都不报告任何的病人结果。Fu等人阐述26例高级别肾损伤病人进行保守治疗,进行过血管造影中的14例(54%)进行了栓塞。不幸的是,这些作者并没有报告这些病人的结果,他们仅仅选择CT-ICE阳性的病人,这也是选择性偏差。Hagiwara等人[10]21例类似的病人中8例(38%)进行了栓塞,并没有比较栓塞和未栓塞组之间的比较。 Charbit 等人认为基于保守治疗是失败率非常低的现实,80%高级别肾损伤的病人不需要进行肾动脉栓塞。保守治疗的成功率是很高的,达95%。 由于肾动脉栓塞和尿道引流所做的贡献,肾静脉蒂撕裂变成仅有的非手术治疗的适应症和需要外科手术。或仅仅肾损伤患者生命体征不稳定受益于肾动脉栓塞[25]。 有些研究提示应该对所有高级别肾损伤的病人进行诊断性血管造影[10]。但因为血管损伤,下肢缺血或多发创伤病人控制活动性出血这些危及患者生命的状态导致这一诊断性措施并不能付诸临床实践[24]。肾动脉栓塞术的适应症是基于临床状态和来自肾脏持续性出血的情况。多发性创伤的病人可以多处出血,有时很难确定哪一个损伤再出血。对于这些病人CT扮演着损伤的充分评估、定义损伤的预后和指导治疗策略的角色[22]。因此,CT的目的是定义需要做或者不需要血管造影的特别的标准,这些标准具有较强的阴性预测值和阳性预测值。到目前为止,并没有研究单纯CT检查除外肾动脉栓塞的标准,尤其是临床进行性出血病人。没有关于指导肾动脉栓塞的特殊CT扫描参数的专家共识。以前的研究[5,17]报告OIS级别和撕裂的位置是预期控制出血肾动脉栓塞需求的适应症。Charbit等人的研究认为这些参数对于肾动脉栓塞需求没有什么显著影响。但他们也认为肾动脉栓塞组的病人50%OIS为5级,比较没有进行肾动脉栓塞术的病人为19%。
严重肾出血疾病的经皮肾血管内治疗甚至可以用于所有类型的肾损伤,血管内栓塞减少保守治疗失败带来的不必要的肾切除,最大限度地保存肾功能。因为另一个选择是肾切除或肾动脉结扎结果导致一个肾的丢失[3,4]。 AAST(American Association for the Surgery of Trauma)肾器官损伤严重性分级目前仍被广泛被执行,相关议题仍然强调需要外科手术,与其同时代的肾动脉栓塞的结果分析并没有包括在其中[5,6]。虽然没有肾动脉栓塞关于肾严重出血适应症的共识,AAST 规定外科手术探查的绝对适应症是持续和潜在危机生命的严重肾出血,但事实上一旦开腹探查,肾切除的比率非常的高,很多都是不必要的肾切除,因为不能想象外科大夫开腹后什么事都没有做就关腹下台了。事实上,肾严重出血肾血管栓塞在临床上扮演着比外科探查重要的多的角色[22]。
1. Dorffner R, Thurnher S, Prokesch R, et al. Embolization of iatrogenic vascular injuries of renal transplants: immediate and follow-up results. Cardiovasc Intervent Radiol 1998; 21:129–134. 3. Somani BK, Nabi G, Thorpe P, McClinton S. Endovascular control of haemorrhagic urological emergencies: an observational study. BMC Urol 2006; 6:27. 5. Shariat S, Roehrborn C, Karakiewicz P, Dhami G, Stage KH. Evidence based validation of the predictive value of the American Association for the Surgery of Trauma Kidney Injury Scale. J Trauma. 2007;62:933-939. 6. Santucci RA, Fisher MB. The literature increasingly supports expectant (conservative) management of renal trauma–a systematic review. J Trauma. 2005;59:493–503. 7. Duchesne JC, McSwain NE Jr, Cotton BA, Hunt JP, Dellavolpe J, Lafaro K, Marr AB, Gonzalez EA, Phelan HA, Bilski T, et al. Damage control resuscitation: the new face of damage control. J Trauma. 2010;69:976-990. 8. Daly KP, Ho CP, Persson DL, Gay SB. Traumatic retroperitoneal injuries: review of multidetector CT findings. Radiographics. 2008;28:1571-1590. 9. Mavili E, Do¨nmezH,O¨ zcan N, Sipahio?luM, Demirtas¸ A. Transarterial embolization for renal arterial bleeding. Diagn Interv Radiol. 2009;15:143-147 10. Hagiwara A, Sakaki S. The role of interventional radiology in the management of blunt renal injury: a practical protocol. J Trauma. 2001;51:526-531. 11. Fu CY, Wu SC, Chen RJ, Chen YF, Wang YC, Chung PK, Huang HC, Huang JC, Lu CW. Evaluation of need for angioembolization in blunt renal injury: discontinuity of Gerota’s fascia has an increased probability of requiring angioembolization. Am J Surg. 2010;199:154-159. 12. Charbit J, Manzanera J, Millet I, Roustan JP, Chardon P, Taourel P, Capdevila X. What are the specific computed tomography scan criteria that can predict or exclude the need for renal angioembolization afterhigh-grade renal trauma in a conservative management strategy? J Trauma. 2011;70:1219-1228. 13. Daly KP, Ho CP, Persson DL, Gay SB. Traumatic retroperitoneal injuries: review of multidetector CT findings. Radiographics. 2008;28:1571-1590. 15. Kitase M, Mizutani M, Tomita H, Kono T, Sugie C, Shibamoto Y. Blunt renal trauma: comparison of contrast-enhanced CT and angiographic findings and the usefulness of transcatheter arterial embolization. Vasa. 2007;36:108-113. 16. Nuss GR, Morey AF, Jenkins AC, Pruitt JH, Dugi DD 3rd, Morse B, Shariat SF. Radiographic predictors of need for angiographic embolization after traumatic renal injury. J Trauma. 2009;67:578-582. 17. Dugi DD 3rd, Morey AF, Gupta A, Nuss GR, Sheu GL, Pruitt JH. American Association for the Surgery of Trauma grade 4 renal injury substratification into grades 4a (low risk) and 4b (high risk). J Urol. 2010;183:592-597. 18. Shanmuganathan K, Mirvis SE, Boyd-Kranis R, Takada T, Scalea TM. onsurgical management of blunt splenic injury: use of CT criteria to elect patients for splenic arteriography and potential endovascular therapy. adiology. 2000;217:75-82. 19. Moore EE, Shackford SR, Pachter HL, et al. Organ injury scaling: spleen, liver, and kidney. J Trauma. 1989;29:1664 –1666. 20. Broghammer JA, Fisher MB, Santucci RA. Conservative management of renal trauma: a review. Urology. 2007;70:623– 629. 21. Kawashima A, Sandler CM, Corl FM, et al. Imaging of renal trauma: a comprehensive review. Radiographics. 2001; 21: 557–574. 23. Santucci RA, McAninch JW, Safir M, Mario LA, Service S, Segal MR. Validation of the American Association for the Surgery of Trauma organ injury severity scale for the kidney. J Trauma. 2001;50:195-200. 24. Teixeira PG, Inaba K, Hadjizacharia P, et al. Preventable or potentially preventable mortality at a mature trauma center. J Trauma. 2007;63: 1338–1346. 25. Brewer ME, Strnad BT, Daley BJ, et al. Percutaneous embolization for the management of grade 5 renal trauma in hemodynamically unstable patients: initial experience. J Urol. 2009;181:1737–1741. |

