PTA技术
PTA最好应在充分准备和良好设备的情况下进行。除了具有运作正常的血管造影设备,其他最小需求是:1)监测动脉内压力,血压,心电和血氧的能力;2)具有清醒麻醉和复苏的经验;和 3)充好电的除颤器,用于抢救的药品和其他设备;另外应建立对各种型号导管,鞘管,球囊,支撑架,导丝,溶栓导管的良好库存,和导管室内相关人员协作精神。
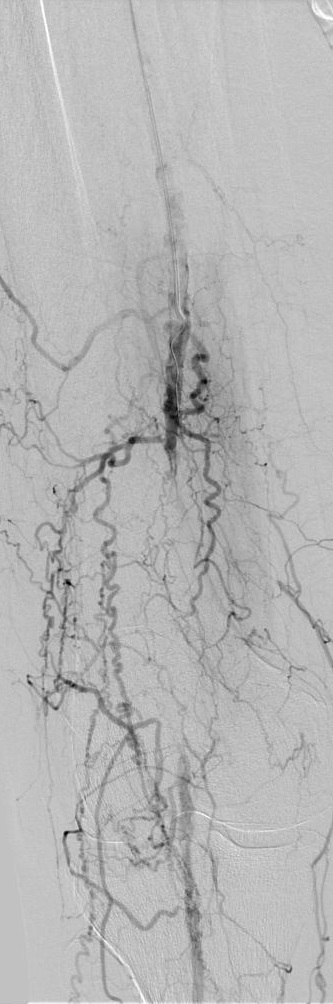
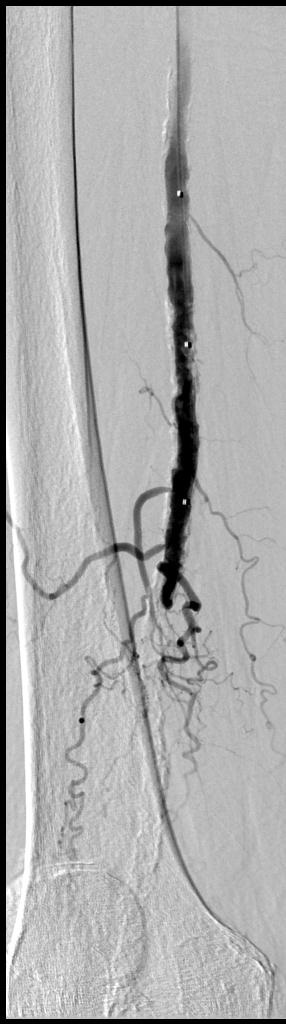
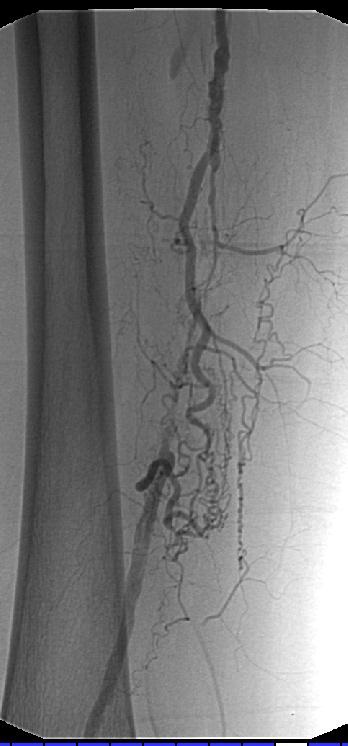
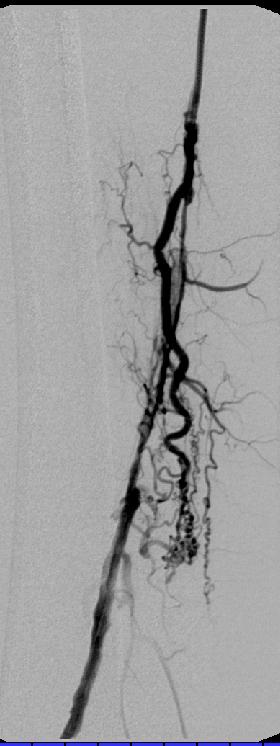
完整的下肢动脉诊断性血管造影应包括腹主动脉到足动脉,除非病人的临床情况,如血清肌酐升高,要求造影剂的使用减少到最小。
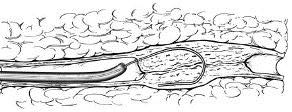
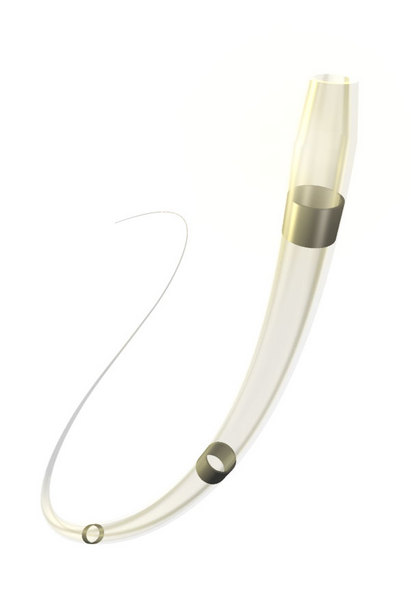
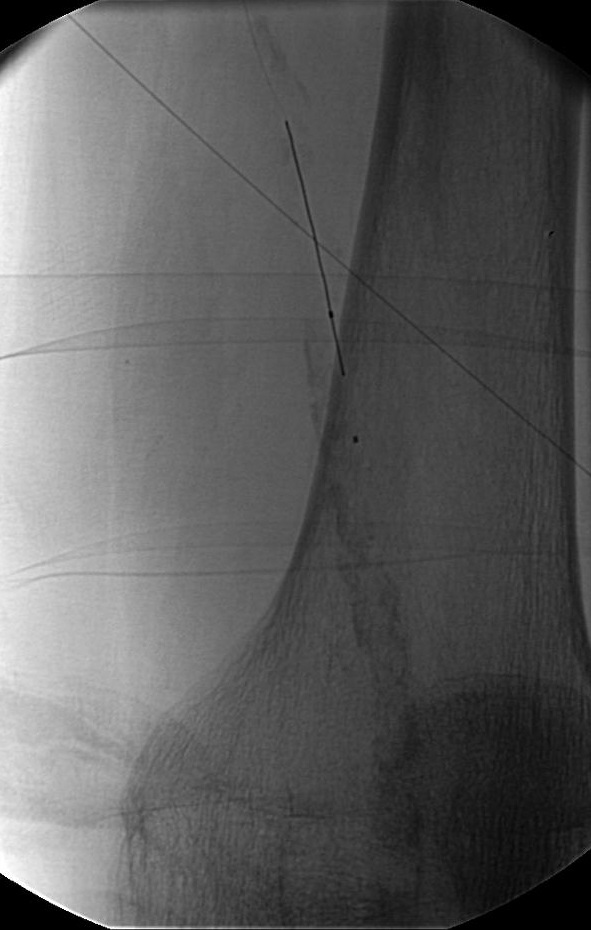
现代导管技术是应用 Seldinger 技术,将球囊导管被通过引导导管经导丝引入至病变内。在历史上曾经通过动脉穿刺,将球囊导管直接插入,偶尔形成的球囊翅会通过取出已被扩张过的球囊导管而使动脉穿刺点变宽。并且,引导导管在血管造影的时候是很有帮助的,特别是在为髂动脉和下肢动脉进行对照血管造影时,由于导鞘的内腔应稍大于球囊导管的直径,这样使得操作过程中可以不用将球囊导管从动脉系统中撤出来就可以进行造影剂的注射。例如,股动脉已经被扩张,导丝的远端将被保留在病变远端,同时球囊导管将被撤到病变近端。这样,造影剂注入可以使被治疗的部位得到观察。如果需要,球囊通过引导导管可以再次进入病变区域重复扩张,也可以被置换更大直径的球囊,也可以置换成相应的血管支撑架。
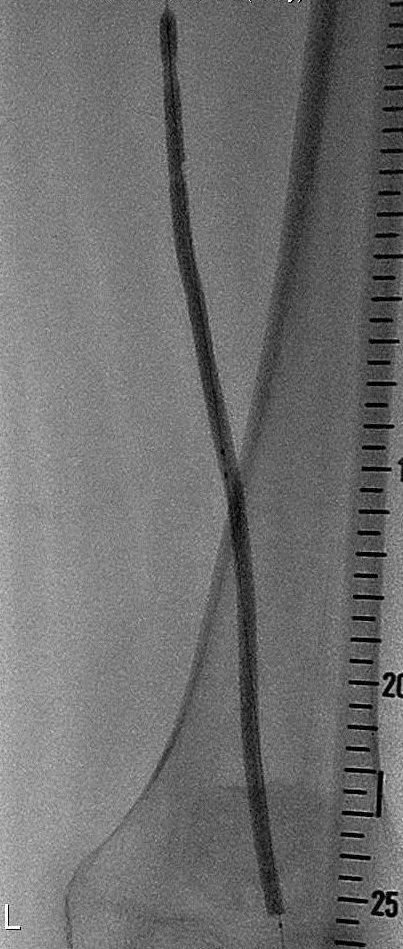
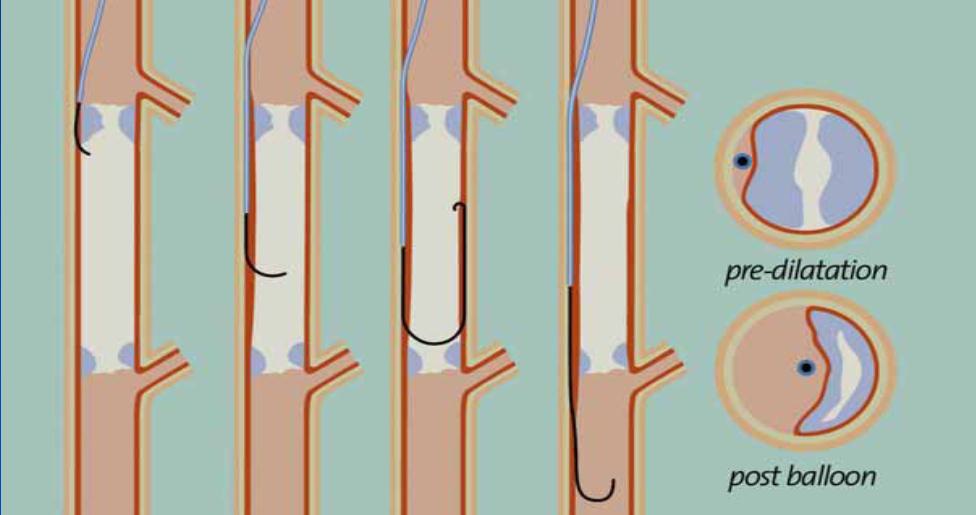
球囊的直径的选择是基于病变相邻的正常动脉的直径。现代血管造影可以通过DSA血管造影设备的软件系统,通过参考已知的物体对象的大小(如导管或导丝)经计算机测出正常动脉的直径。对于同轴心狭窄病变球囊直径应比邻近动脉大1mm。而对于偏轴心狭窄病变球囊直径应比邻近动脉直径小1-2mm,因为球囊扩张将仅伸展包含最少斑块一面的血管壁的部位,而不是象同心轴病变那样扩张整个环行血管壁。如果可能,球囊长度不应超过病变的长度,因为扩张相邻正常的动脉可以损伤正常血管内膜和中层,增加血栓形成或继发内膜增生的危险。球囊扩张时用“路图”影像,可以使操作者测量相对于邻近正常动脉腔直径的球囊大小。
PTA入路 1.动脉穿刺入路
通常根据病变的位置采用病变同侧或对侧入路为股动脉穿刺路径。人性化考虑以及双髂动脉闭塞病变也可以从肱动脉入路,这要求较长的器械推送装置和引导导管的备货,以及操作人员的操控导管的经验。如果从近侧通过股动脉病变不可能的情况下,通过透视引导进行腘动脉穿刺,甚至腓动脉或胫前动脉穿刺。但必须考虑到腘动脉穿刺入路的并发症高。彩色多普勒超声引导下的穿刺可以用于同时防止腘静脉意外穿刺导致动静脉瘘。而且胫神经可以被穿刺直接损伤或继发于术后血肿引起的肌间隔综合症(compartment syndrome)。
下肢股浅动脉病变或/和腘以下动脉的的治疗可以采用顺行方式进行动脉穿刺。通过人为改变穿刺针的方向,使其向下穿刺。股总动脉穿刺点不要太靠近上方(如腹股沟韧带上方穿刺)以防止腹腔或腹膜后出血。
对髂动脉病变,球囊导管也采用同侧逆行路径。
如果经同侧入路不可能的病人,结合“穿越技术”或“横渡技术”(Cross-over technique)采用对侧入路。对于主动脉分叉病变,采用“球囊亲吻技术”(Kissing balloon technique)的病人需要双侧穿刺以便同时扩张位于主动脉双侧分叉内的球囊。
在罕见的情况下,一开始就需要用肱动脉穿刺路径(因为有较高的出血和肱神经丛损伤的并发症,腋动脉穿刺路径几乎已经被放弃了)或桡动脉穿刺入路。因为髂动脉血管成形术需要较大的直径的血管鞘,这一路径需要应用“拖出技术”(Pull-through-technique).
2.关于“Pull-through术” 通过成功地置入肱动脉鞘逆行插入导丝,在通过阻塞的髂动脉病变进入股动脉。在股动脉,“J”形钛镍导丝(0.035导丝,Terumo,Frankfurt,德国)逆行进入导管鞘一直达到止血阀的水平。然后撤出导管鞘,导丝被留在原位。将导丝从股动脉内拉出后,再置入带有内扩张导管的直径较大的导管鞘进入股动脉,球囊导管和支撑架可以通过导管鞘进入病变部位。“拖出技术”已经广泛应用于锁骨下动脉病变,主动脉病变,髂动脉病变的血管成形术。这种技术的应用使圈套器诱捕方法变得多余。
Pull-through技术还可以与横渡技术相结合,跨过主动脉分叉处到对侧。这已经被用于髂动脉或股总动脉堵塞的病例中。
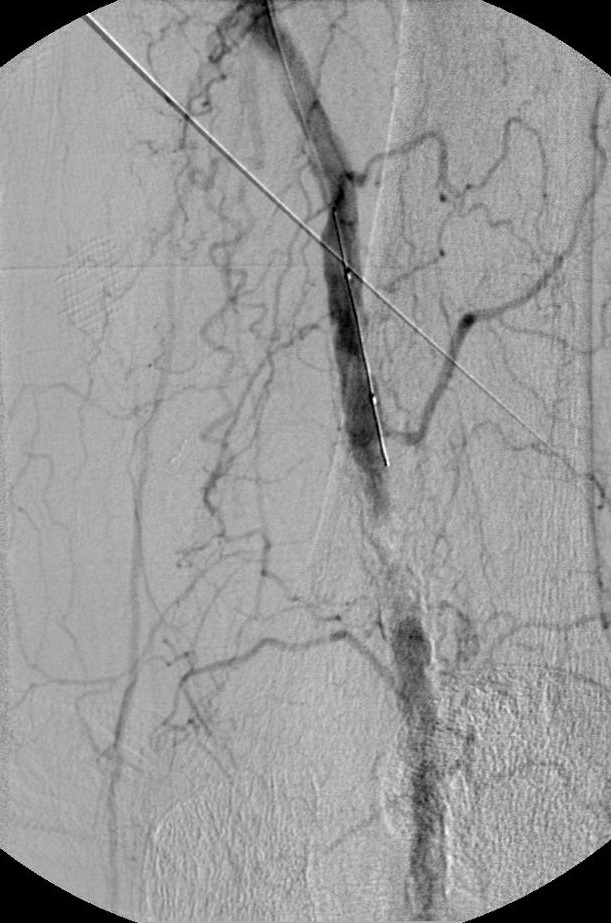
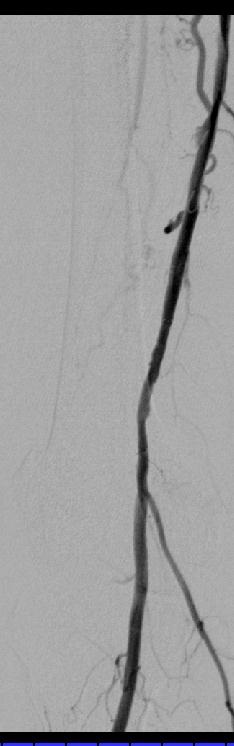
导丝通过技术 一旦导丝正确地进入股浅动脉(非夹层内),导管引导被跟进,通过引导导管注射造影剂获取阻塞病变部位的“路图”。一般选用比引导导管鞘直径小的球囊导管以便造影剂可以在保留球囊导管的情况下通过导管鞘进行注射。但“路图”技术也可以选择引导导管与球囊导管直径相当。术前血管造影通过侧支循环显示远端动脉主干非常有助于在正确的方向上操作血管内的导丝。
通常用带有 "J " 形尖端,柔软的Terumo导丝非常容易通过狭窄病变。而困难的是让导丝通过阻塞的病变。比较短的阻塞病变,应采用直头血管造影导管(这种导管有较长的、薄的、逐渐变细的头部)并让导丝尖端刚好突出导管头。然后在“路图影像技术(Road mapping technique)”的引导下联合操作导管,导丝仔细的通过病变。
新的通道至少部分可能是通过内膜下的,只是我们没有意识到。这并不是一件坏事,这一技术已经被建议称为有意识特殊弧形导管操作方法(an intentional procedure with cruved catheter)。导丝从动脉近端进入阻塞段的动脉内膜下层,并沿着阻塞段内膜下层的间隙到达远端开放的动脉腔内。导管从内膜下间隙再进入远端动脉腔内(PIER技术)。然后腔外间隙被扩张为一个新的管腔。
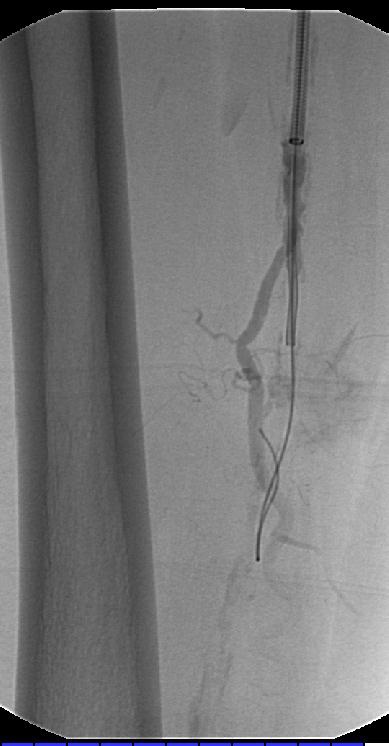
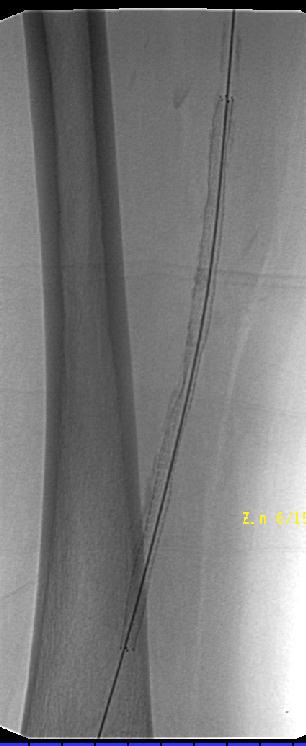
导丝通过病变后,球囊导管通过导丝在透视下引导下进到靶血管位置。精确的定位是通过球囊上的标志。现在一般用“新一代”高膨胀系数的球囊导管,这种导管,能承受高压,外形小,扩张后的直径大(Ultrathin®,Medi-Tech,Boston Scientific,5到7F,膨胀后球囊直径3至12MM,球囊长度2至8CM; Cook 球囊导管)
历史上曾用聚乙烯制作的低压球囊的缺点是:当病变比较坚硬的时候球囊的近端和远端会过分膨胀导致血管壁的过分伸展和形态学上的结构破裂,最终导致动脉的完全破裂和出血。相反,高压球囊的膨胀是均匀的分布在所有部分。一旦球囊到达其命名上的直径,再增加压力不会使球囊的直径进一步增加。
被选择的球囊的直径应与被治疗血管的直径相适应。动脉直径的测量位置应选择在病变的末端或以对侧血管为参考。动脉的直径在数字减影血管造影设备上应用DSA软件进行测量,或应用不透光的尺子。考虑到扩张后动脉壁会发生弹性回缩,球囊扩张直径应超出血管直径的10%左右。如果球囊的直径和被治疗的血管直径一样大,血管壁的回缩弹力不会被超越,这将导致病变扩张后的再缩窄。
球囊的长度应该和病变的长度相一致。特别长的病变可以用10厘米长的球囊扩张。否则球囊必须分段扩张整个病变。
球囊扩张时间应该持续到20秒,当病人不能忍受疼痛时停止扩张。疼痛是由于球囊过度扩张血管浆膜引起的,由于有血管破裂的危险,疼痛不应超出可以忍受的范围。所以疼痛是球囊直径选择是否合适的一个重要的指标。如果病人不感觉痛,球囊可以进一步膨胀或球囊的直径太小。当病人不能够忍受的疼痛时,球囊的压力应减少。如果病人表现为对疼痛特别的敏感,停止膨胀球囊让病人休息。一般长球囊扩张时的疼痛较短球囊剧烈。因此,建议用短球囊处理短的残余狭窄。
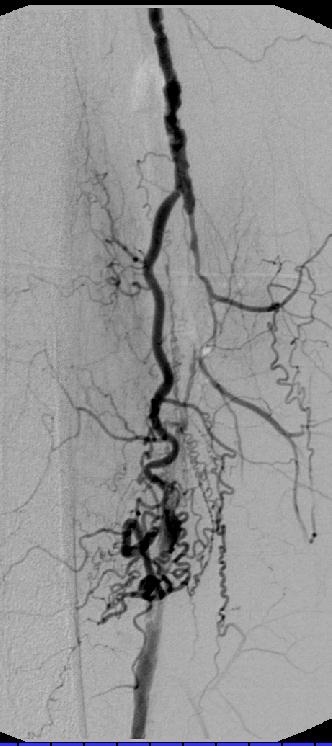
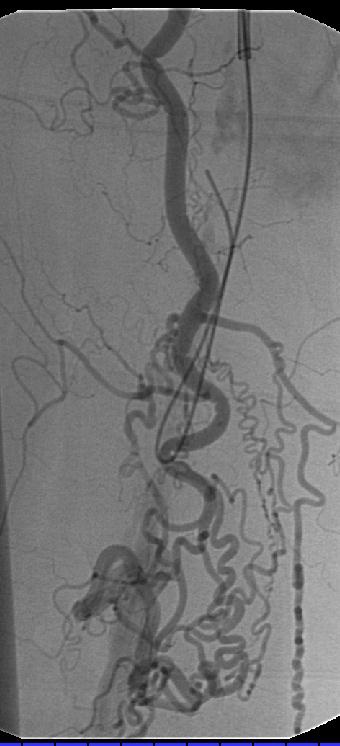
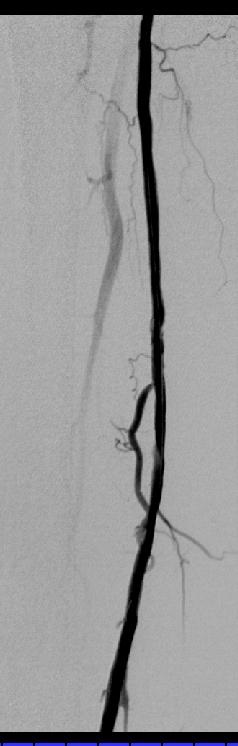
对于特别坚硬的狭窄,如PTA后的再狭窄,血液透析的分流通道,或支撑架内的狭窄,扩张时间可以持续5分钟或更长才能够完全使血管再开放。因为PTA治疗血液透析分流通道时病人非常的疼,所以可以在皮下的病变血管壁周围进行局部麻醉。发生在动静脉瘘的静脉部分中的很坚实的狭窄中,有着将近20个大气压的特殊的球囊是有必要的。用5ml注射器可以手工得到8个大气压的压力。为了得到高于该水平的压力,必须使用有着气压计的特制的注射器(Boston Scientific,Natick,MA)。 扩张后球囊导管回缩并从治疗的部位撤除。通过导管鞘注射造影剂进行对比血管造影,决定治疗是否结束或重复扩张。
Met 等人曾对下肢动脉阻塞性疾病内膜下血管成形术进行系统回顾【1】 111.206.128.143 |