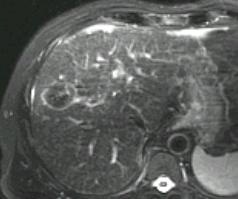
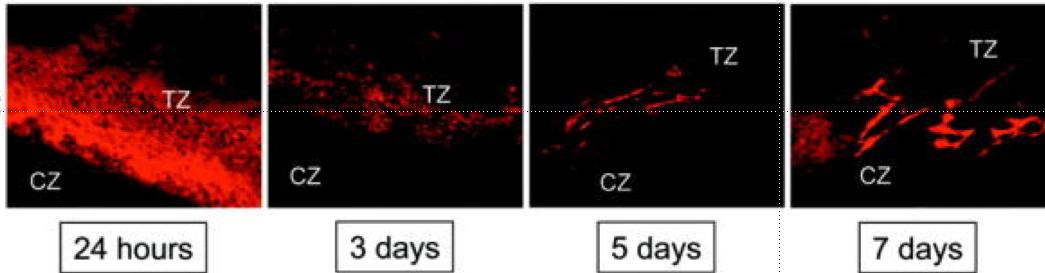
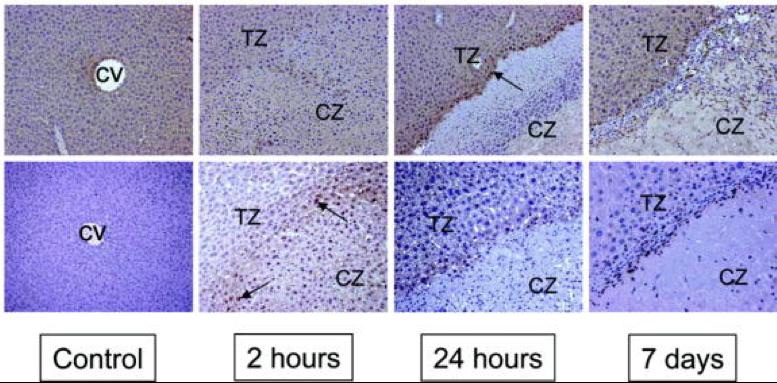
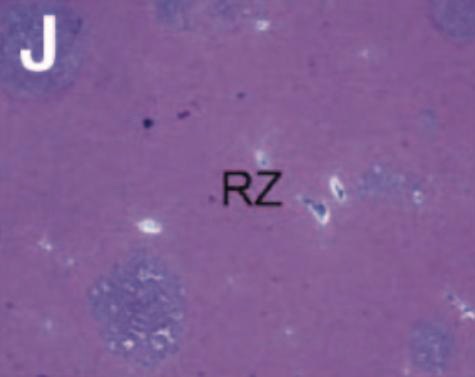
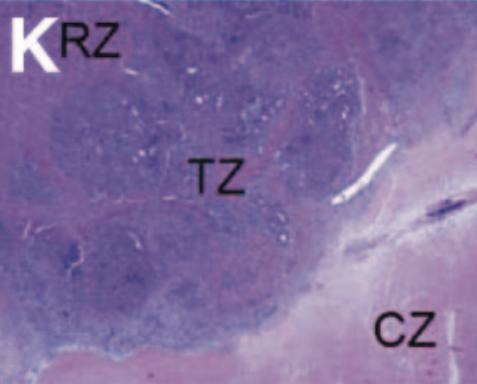
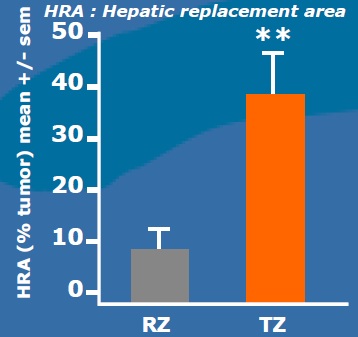
射频消融+化疗同一时间进行使安全的(RF + chemo delivered at the same time is safe)
评价射频消融+化疗主要适应症是结直肠癌肝转移的姑息治疗和治愈性治疗
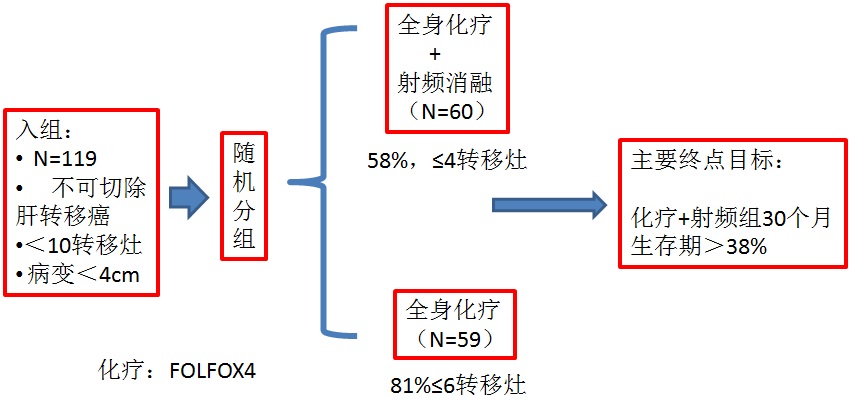
不能手术切除的肝转移癌病人首先考虑化疗,是因为化疗导致肿瘤缩小有利于外科切除根治性治疗。若化疗反应差或需要射频消融作为一种姑息治疗。 当化疗的选择有限的情况下,术前 Oxaliplatin/Irinotecan是作为一线最初的选择。
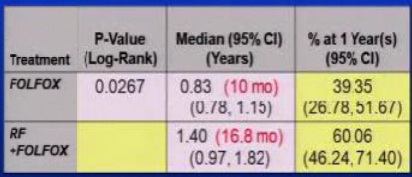
目前对于辅助治疗的证据是病人接受两个化疗方案之一,获得非常不同的疗效。5FU/LV 一直没有显示出影响生存的效果,但是Oxaliplatin (FOLFOX) 和 Irinotecan (FOLFIRI)则不同。结肠癌切除术后或同时存在肝转移的病人接受FOLFOX/FOLFIRI 或 5FU/LV的5年生存率分别为54%和35%。(Liu et al. Int J Colorect Dis, October 2010: 25; 1243-9)。 在治愈性射频消融人群中,有非常好的证据支持消融后进行辅助化疗。消融的微创特性是化疗可以在消融术后10天内进行。
同一病人的随访情况
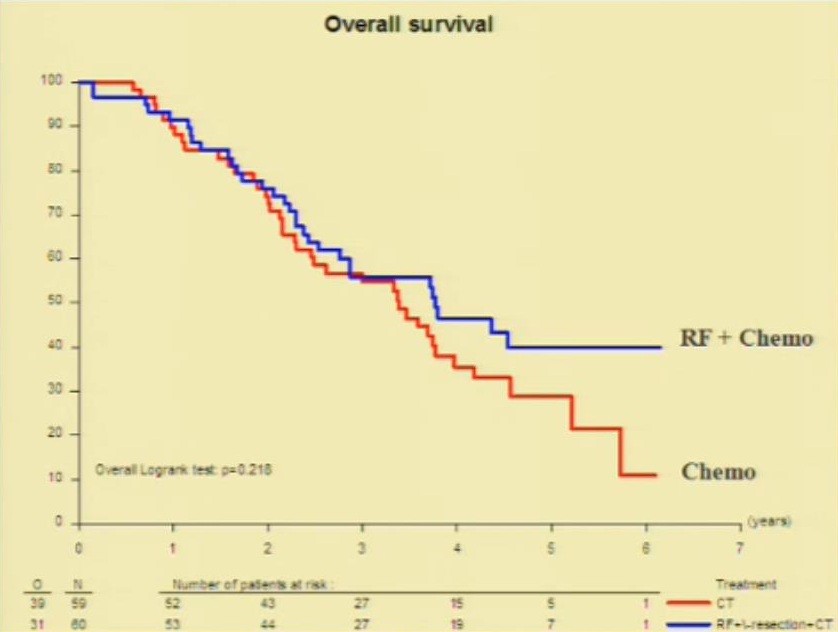
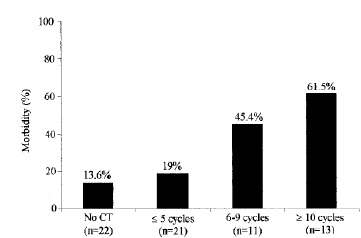
Morbidity of surgery, influence of : number of chemotherapy cycles date of discontinuation【2】
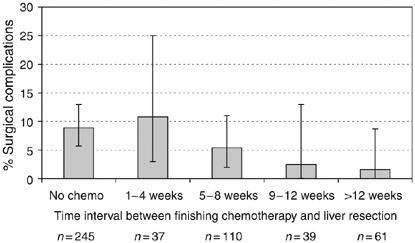
Safe liver resection following chemotherapy for colorectal metastases is a matter of timing【3】
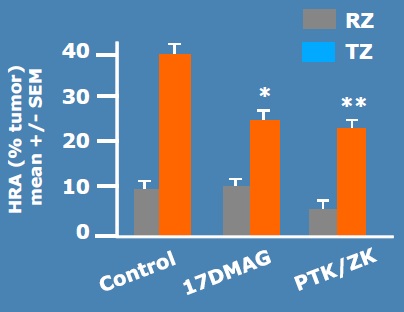
射频消融联合靶向治疗?【4】
Started before RFA and continued 48 hours
17DMAG : aHSP-90 inhibitortargetingHIF-1&HIF-2(InvivoGen, San Diego, CA)
PTK/ZK : a non selective VEGF receptor tyrosine kinase inhibitor (Schering AG, Berlin, Germany)
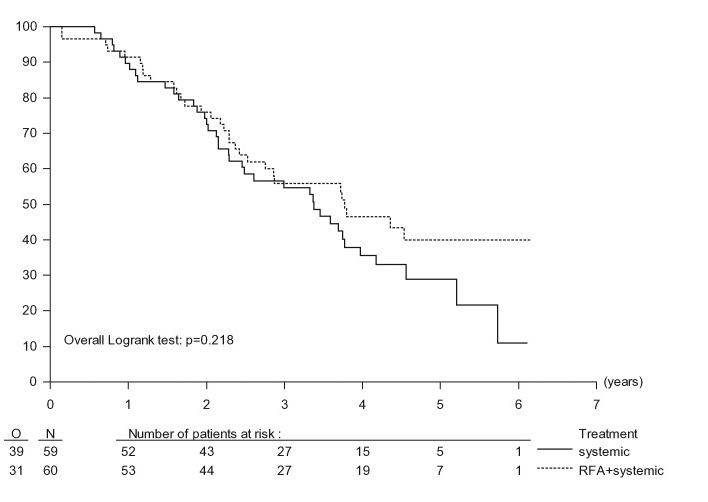
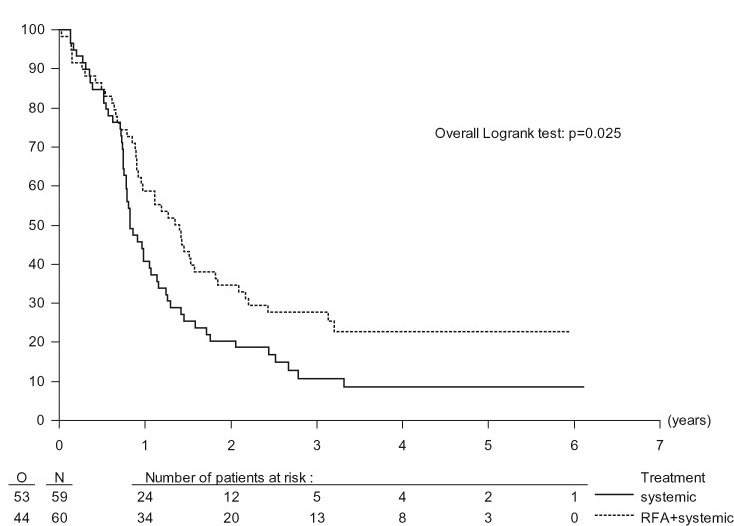
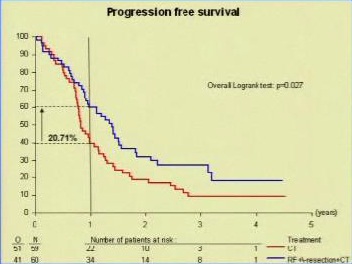
1. Ruers T1, Punt C, Van Coevorden F, Pierie JP, Borel-Rinkes I, Ledermann JA, Poston G, Bechstein W, Lentz MA, Mauer M, Van Cutsem E, Lutz MP, Nordlinger B; EORTC Gastro-Intestinal Tract Cancer Group, Arbeitsgruppe Lebermetastasen und—tumoren in der Chirurgischen Arbeitsgemeinschaft Onkologie (ALM-CAO) and the National Cancer Research Institute Colorectal Clinical Study Group (NCRI CCSG).Radiofrequency ablation combined with systemic treatment versus systemic treatment alone in patients with non-resectable colorectal liver metastases: a randomized EORTC Intergroup phase II study (EORTC 40004).Ann Oncol. 2012 Oct;23(10):2619-26. Epub 2012 Mar 19. |