尽管对于不能手术肝癌病人的姑息治疗还包括局部注射治疗、免疫治疗、放射治疗、熱消融治疗等等,但TACE仍然是目前不可切除肝癌最好的选择。 TACE的局限性非常明显。尽管各种TACE的方法根据分期不同在最初治疗后取得较好的生存率的改善,但治疗后期由于较高的复发率,限制了病人长期疗效。
据不同的报告,TACE术后3年复发率为35%~75%,即使是外科切除(五年复发率68~70%),局部酒精注射(4年复发率为58%)一样存在较高的复发率。而TACE治疗后的肝癌患者,50%-90%术后死亡原因是复发性疾病。而TACE术后肝内复发往往是唯一复发的位置,发生在68%-96%的患者。这一结果提示,在TACE最初的有效治疗后,预防复发可能是改善肝癌病人长期结果的关键因素之一。
TACE后肝癌的复发率和生存率
控制TACE术后的复发是提高整体生存率的关键 TACE后复发的分类
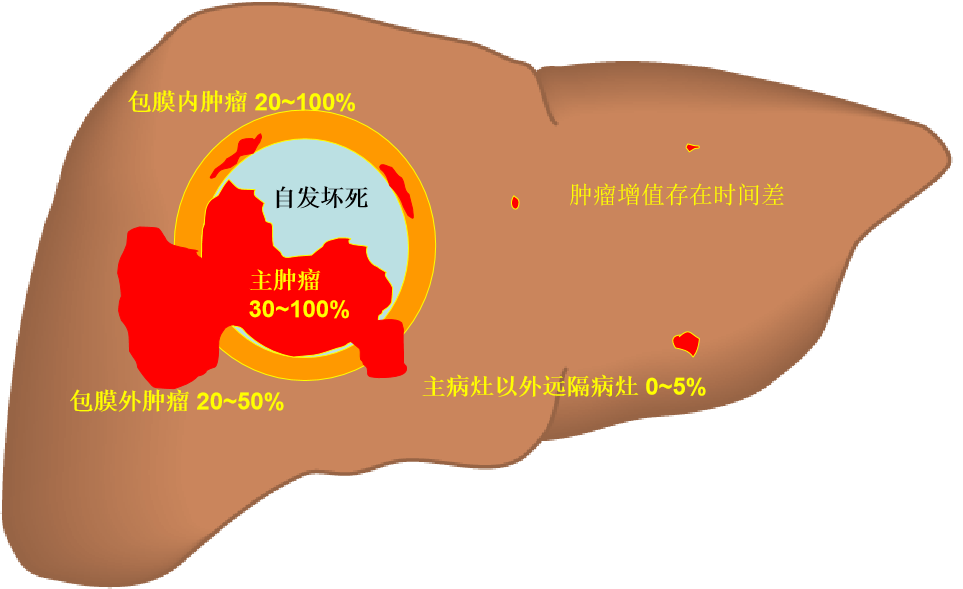
主病灶复发:>B期(BCLC 分期)TACE术后,随着时间的推移几乎占复发病例的100%,现代导管技术和射频消融等局部技术对主病灶复发控制能力正在不断的提高。肝内远隔病灶复发:3年内复发率占70%,是目前TACE失败的主要原因。肝外病灶复发和血管侵入:占全部病例的8~14% TACE后不同病灶的完全坏死率(BCLC,B期)
TACE术后复发的原因 主病灶,肝内转移病灶以及肝外播散病灶的复发原因可能可不相同 肝癌通常源于慢性病毒性肝炎或酒精性肝病,这可能和多个、癌前细胞独立增殖相关。肝癌复发的本质大致有两类:一是肝癌多中心发生,即肝癌性切除后,由于肝癌生长的土壤中涉及癌基因、抑癌基因、转移相关基因、生长因子及其受体、粘附分子及细胞外基质、肿瘤血管、机体免疫等多环节。上述任何环节都可用来研究猜测指标,干预任何环节也有可能预防或延缓肝癌的复发转移。 暴露在连续致癌因素(癌基因、抑癌基因、转移相关基因、生长因子及其受体、粘附分子及细胞外基质、肿瘤血管、机体免疫)等多环节的攻击下,发生单中心或多中心癌变当这些增殖进一步暴露在连续致癌因素的攻击下,发生单中心或多中心癌变。 Wayne JD 等发现伴有肝硬化、肿瘤大小、有门静脉癌栓等是肝癌术后复发的主要因素。分子生物学方面研究表明[5], 原发性肝癌术后复发转移涉及癌基因、抑癌基因、生长因子及受体、黏附分子、蛋白水解酶、肿瘤血管生成等诸多因素
肿瘤术后复发主要有两种情况: 一是手术不彻底导致癌细胞在体内残留(包括原发器官内或其它部位) , 一段时间残癌增大; 二是重新从癌前病变演化而来的复发。目前研究表明肝内转移和多中心发生是PLC 术后复发的两大机理。在肿瘤发生发展过程中, 并非所有细胞均呈同步增生, 其分化增殖速度具有一定的时间差, 因此, 当手术切除某一生长较快的肿瘤时, 已存在若干处于癌前病变阶段的病灶。 在肿瘤发生发展过程中, 并非所有细胞均呈同步增生, 其分化增殖速度具有一定的时间差, 因此, 当TACE控制某一生长较快的肿瘤时, 已存在若干处于癌前病变阶段的病灶。因此,在最初的肝癌主病灶有效治疗后,肝内复发可以表现为肝硬化肝脏内新的肿瘤形成或肝内转移的肿瘤。 当我们进行TACE的时候,已经存在有真实肿瘤只是我们看不见或正在成长的癌前病变。 TACE术后主病灶复发多数是由于治疗不足,或不可能达到充分的治疗。出现肝外的转移原因的机理可能更为复杂
肝癌抗复发治疗的难点主要由于TACE术后,出现远离主病灶“转移性”复发机理不清;对于微小病灶对缺血治疗和化疗有抵抗;侧支循环代偿供血使主病灶发生完全坏死的可能性极小。 目前TACE预防复发的策略 危险因素的预防:抗病毒治疗;TACE术后的全身化疗;反复TACE和局部化疗;TACE+RFA或PEIT;TACE术后的免疫治疗;TACE术后的其它治疗。
Someya 等[1]认为HBeAg 阳性影响肝癌术后复发的独立危险因素, 活动性肝炎其肿瘤局部的炎症因子多, 增加了侵袭性。以及病毒活跃复制使得肝癌再发的机会增多。KuBo 等[2]认为HBeAg 阳性病例伴肝内播散者比例较高。HBeAg阳性患者术后复发较高, 可能系HBeAg增加微小播散的机会, 抑或HBeAg 增加了多肿瘤中心的机会。对HBeAg阳性肝细胞癌外科术后联合抗病毒治疗或大部分文献的认可,但在TACE治疗中的应用尚待有价值的文献发表。
1. Someya T. Interferon lowers tumor recurrence rate after surgical resection or ablation of hepatocellular carcinoma: a pilot study of patients with hepatitis B virus- related cirrho sis. Gastroenterology 2006, 12 (14) : 1206~ 1213. |