虽然不是不可能,但在解释任何人类疾病干预治疗机制方面都具有挑战性。有一点没有人怀疑高血压发病机制之一是神经源性的,即交感神经系统过度激活在高血压的发生、发展及后果方面扮演着至关重要的角色。在高血压治疗的历史上,令人诧异的是有关人类高血压有关交感神经激活的作用和针对这一系统的靶向治疗策略的临床研究一直没有作为优先考虑的事项。这或许归结于肾素-血管紧张素-醛固酮系统抑制剂被引入临床后,它们确实发挥了降低血压和保护心血管和肾的重要作用。 但在事实上,尽管有效的抗高血压药物引入改变了当时抗高血压治疗的策略,但不充分的血压控制仍然是全球范围内死亡的首要原因【1】。将近10人受到血压升高导致的健康受损[2]。换句话说,抗高血压药物治疗尽管有效性和广泛普及,药物控制高血压的策略仍然没有达到人们预期的愿望[3,4],高血压的发病机制未明,也是药物治疗的局限所在。除了在很多欠发达地区高血压的知晓率差,治疗率低,更由于人们对每天服药的治疗方式顺从性差以外,在发达国家难治性高血压的发生率仍在在20~30%的范围[3,6,7]。这些病人处在发生严重心血管事件的高危状态[8]。一个重要的原因是由于对高血压药物耐受或耐药,服用多种抗压药物仍不能达到血压的控制,通常被称为难治性高血压[5]。为了克服抗高血压药物的耐药性,人们重新拾起交感神经系统作为非药物治疗靶点的兴趣。事实上,外科试图通过手术的方式降低严重高血压患者交感神经活性和血压始于20年代[9,10]。虽然受到副作用的困扰,但此类病人血压控制的改善和生存率的提高证实这一老概念的有效性。 交感神经纤维支配调控所有的心血管器官,如心脏、周围血管,依现代的语境或许最为重要的是肾脏。存在于肾脏的传出交感和传入感觉神经纤维构成复杂而精细的网络,其中的信号通路,提供了脑干综合结构对肾作为受动器官对控制血压调整的影响。
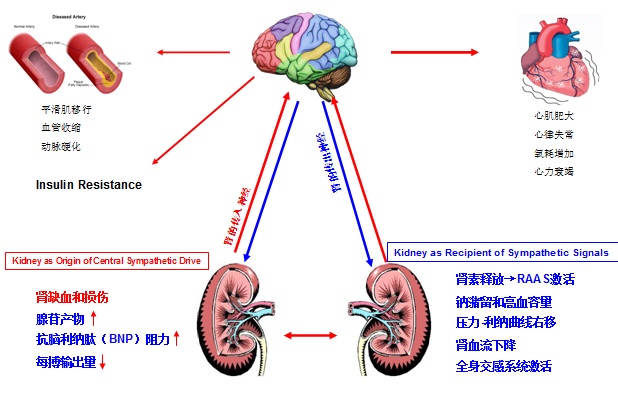 高血压肾交感神经的作用 肾交感神经由传入和传出神经组成。经中枢发出的传出神经,经交感神经干的胸段和腰段发出节前神经元轴突,到达椎前和椎旁交感神经节。相关肾组织结构接受来自伴行于肾动脉进入肾门的节后交感神经(又称肾节前纤维)所传入神经信号直接输入所支配,这些肾组织包括肾血管结构,肾小管和肾小球旁器[11]。因此,肾交感传入神经激活可以增加去甲肾上腺素的产生和释放,β1肾上腺素能受体可介导肾素的释放,α受体激活通过肾小管钠的重吸收使水钠潴留[12],和神经介导的血管收缩[13,14并导致]导致肾血流量下降,同样使肾小球旁器肾素的释放激活肾素-血管紧张素-醛固酮系统[15]。这些都导致血压的升高。
应用稀释示踪剂方法测量来自肾的去甲肾上腺素溢出到血浆,其提供了确凿的证据:原发性高血压的病人肾去甲肾上腺素溢出率增加[16,17]。而且,来自心脏去甲肾上腺素溢出增加也经常表现为与高血压病人相一致的典型的血流动力学状况[18,19]。而实验已经证实激活肾交感神经能够增加NE的产生和释放,而其作用于β1肾上腺素能受体导致肾素的释放,作用于α1受体导致钠的重吸收和肾血管收缩。 原理
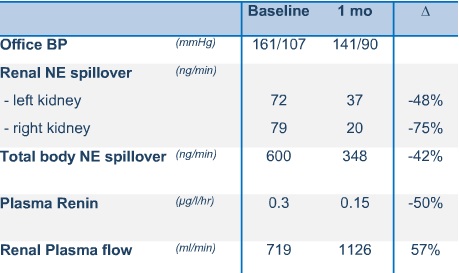
在正常情况下,肾脏通过水钠的重吸收,肾素释放的调节以及交感神经的相互作用维持血压在正常范围内。而这种平衡一旦破坏,负责肾脏交感神经传入和传出神经纤维相互被激活促进高血压的发生和发展。 似乎最为关键的是证实去肾交感神经支配术的确减少肾交感神经的活性。为了这一目的,10例病人应用放射性示踪剂稀释方法评估其肾的去甲肾上腺素动力学作为测量肾交感神经活性的指标。的确,双肾去肾交感神经支配术后,来自肾的去甲肾上腺素溢出减少47%(95% CI 28-56%),从而证实去肾交感神经支配术在完成输出肾交感神经消融术后的有效性。另外,这一治疗的直接结果是其中一个病人肾素分泌减少大约50%[25],这可能和血压下降的结果有关,或许部分由于通过中枢交感输出反应的介入减少循环中血管紧张素II水平。但是一个病人的单独的肾素反应不能反映顽固性高血压人群,进一步研究将充分地证实这一有吸引力的假设。 通过微神经照相术(microneurography)这一切应与基线到12个月之间中枢交感神经输出进行性减少的发现相对应[25],也可能带来与肾交感神经消融相关的传入神经的变化。 通过输入和输出神经信号的变化能够解释的另一个概念包括去肾交感神经支配术术后心脏压力反射敏感性(cardiac baroreflex sensitivity)改善(从7.8→11.7ms/mmHg)和心脏MRI左室质量(指数)从基线到12月时,下降7%(从78.8 → 73.1g/m2) 肾到中枢交感驱动减少:顽固性高血压病人肌肉交感神经活性[25]
原理证明:生理学的相关变化[25]
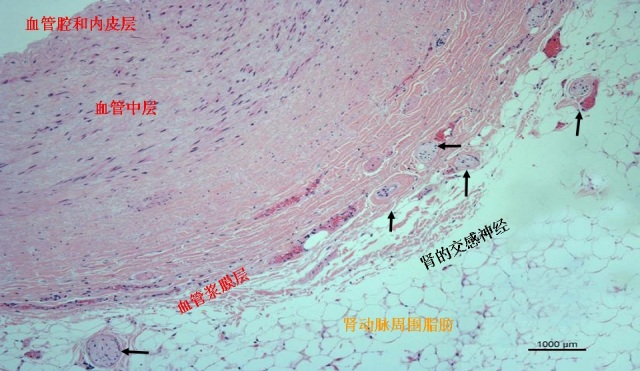
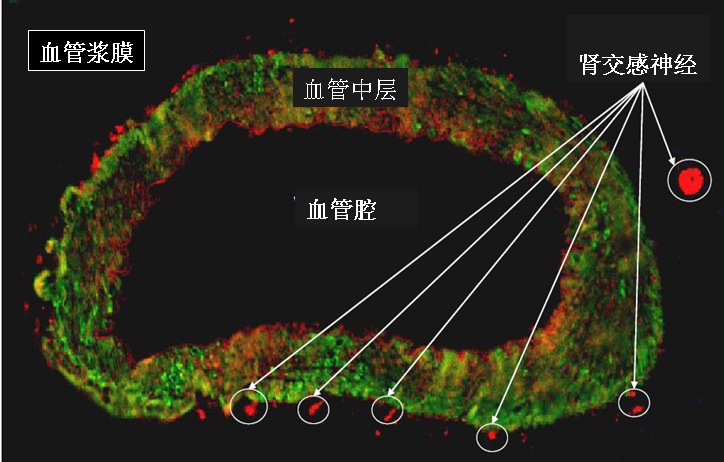
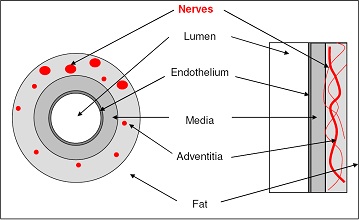
RDS 主要利用肾脏的交感神经主要分布在肾动脉壁的浆膜面内(下图),通过基于经皮导管技术在肾动脉管腔内实施射频消融,将肾动脉周围的肾传入和传出交感神经毁损,阻断其信号的传入和传出达到降低血压的目的。
兔肾动脉浆膜内交感神经
1. Perkovic V, Huxley R, Wu Y, Prabhakaran D, MacMahon S. The burden of blood pressure-related disease: a neglected priority for global health. Hypertension 2007; 50:991–997. 2. Perkovic V, Huxley R, Wu Y, Prabhakaran D, MacMahon S. The burden of blood pressure-related disease: a neglected priority for global health. Hypertension 2007; 50:991–997. 3. Hajjar I, Kotchen TA. Trends in prevalence, awareness, treatment, and control of hypertension in the United States, 1988–2000. JAMA 2003; 290:199–206. 4. Sarafidis PA, Bakris GL. Resistant hypertension: an overview of evaluation and treatment. J Am Coll Cardiol 2008; 52:1749–1757. 5. Mancia G, De Backer G, Dominiczak A, Cifkova R, Fagard R, Germano G, Grassi G, Heagerty AM, Kjeldsen SE, Laurent S, Narkiewicz K, Ruilope L, Rynkiewicz A, Schmieder RE, Boudier HA, Zanchetti A, Vahanian A, Camm J, De Caterina R, Dean V, Dickstein K, Filippatos G, Funck-Brentano C, Hellemans I, Kristensen SD, McGregor K, Sechtem U, Silber S, Tendera M, Widimsky P, Zamorano JL, Erdine S, Kiowski W, Agabiti-Rosei E, Ambrosioni E, Lindholm LH, Viigimaa M, Adamopoulos S, Agabiti-Rosei E, Ambrosioni E, Bertomeu V, Clement D, Erdine S, Farsang C, Gaita D, Lip G, Mallion JM, Manolis AJ, Nilsson PM, O’Brien E, Ponikowski P, Redon J, Ruschitzka F, Tamargo J, van Zwieten P, Waeber B, Williams B; Management of Arterial Hypertension of the European Society of Hypertension; European Society of Cardiology. 2007 Guidelines for the Management of Arterial Hypertension: The Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). J Hypertens 2007; 25:1105–1187.
6. Black HR, Elliott WJ, Grandits G, Grambsch P, Lucente T, White WB, Neaton JD, Grimm RH Jr, Hansson L, Lacourciere Y, Muller J, Sleight P, Weber MA, Williams G, 7. Cushman WC, Ford CE, Cutler JA, Margolis KL, Davis BR, Grimm RH, Black HR, Hamilton BP, Holland J, Nwachuku C, Papademetriou V, Probstfield J, Wright JT Jr, Alderman MH, Weiss RJ, Piller L, Bettencourt J, Walsh SM; ALLHAT Collaborative Research Group. Success and predictors of blood pressure control in diverse North American settings: the antihypertensive and lipid-lowering treatment to prevent heart attack trial (ALLHAT). J Clin Hypertens (Greenwich) 2002; 4:393–404. 8. Calhoun DA, Jones D, Textor S, Goff DC, Murphy TP, Toto RD, White A, Cushman WC, White W, Sica D, Ferdinand K, Giles TD, Falkner B, Carey RM. Resistant hypertension: diagnosis, evaluation, and treatment. A scientific statement from the American Heart Association Professional Education Committee of the Council for High Blood Pressure Research. Hypertension 2008; 51:1403–1419. 9. Smithwick RH, Thompson JE. Splanchnicectomy for essential hypertension; results in 1,266 cases. J Am Med Assoc 1953; 152:1501–1504. 10. Morrissey DM, Brookes VS, Cooke WT. Sympathectomy in the treatment of hypertension; review of 122 cases. Lancet 1953; 1:403–408. 11. Barajas L. Innervation of the renal cortex. Fed Proc 1978; 37:1192–1201. 12. Bell-Reuss E, Trevino DL, Gottschalk CW. Effect of renal sympathetic nerve stimulation on proximal water and sodium reabsorption. J Clin Invest 1976; 57:1104–1107.
13. Kirchheim H, Ehmke H, Persson P. Sympathetic modulation of renal hemodynamics, renin release and sodium excretion. Klin Wochenschr 1989; 67:858–864. 25. Schlaich MP, Sobotka PA, Krum H, Lambert E, Esler MD. Renal sympathetic-nerve ablation for uncontrolled hypertension. N Engl J Med 2009; 361:932–934. |