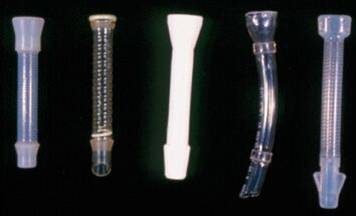
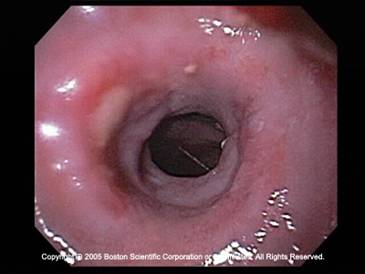
食道和贲门癌发病率增加,尤其是腺癌。其预后差,5年生存率<20%。50%的病人发现时已经为晚期。自从食道支撑架被引入治疗食道贲门梗阻以来,其应用显著地增加。除了用于食道和贲门癌导致的吞咽困难的姑息治疗,也用于食道气管瘘、术后吻合口狭窄和良性狭窄治疗的选择。良性狭窄病变的支撑架在植入食道狭窄病变后的4~8周后撤出,以防止肉芽组织增生导致支撑架再次阻塞。支撑架也作为治疗的平台,放疗性支撑架和压迫食道静脉曲张。 食道支撑架的历史: 在自膨式金属支撑架应用之前,临床上主要使用塑料支撑架。
上述文章介绍了塑料或硅胶食道支撑架的情况,最大的问题是穿孔率达到10%左右。自从90年代初期非覆膜自膨式金属食道支撑架逐渐被引入市场,塑料支撑架已经含有应用。  发表在新英格兰医学杂志的这篇文章比较塑料支撑架和非覆膜金属支撑架对于恶性食道病变导致的吞咽困难治疗的效果。 其结果如下:
此表表明,尽管塑料支撑架再阻塞率低,但在死亡率、穿孔率和支撑架移位方面远比非覆膜金属支撑架差的多。这种第一代金属裸支撑架由于肿瘤生长导致复发性吞咽困难的发病率较高。为了防止肿瘤通过支撑架网眼向支撑架内生长和防止支撑架移位,许多抗吞咽困难复发和抗移位支撑架被设计出来,包括部分或全部覆膜支撑架以及双层支撑架。
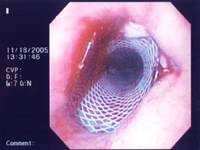
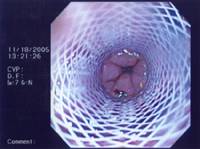
多数情况下自膨式金属支撑架可以门诊操作,中位操作时间为15~20分钟。技术成功率接近100%。几乎所有的病人吞咽困难在几天内迅速缓解。  全部或部分覆膜支撑架  双层支撑架
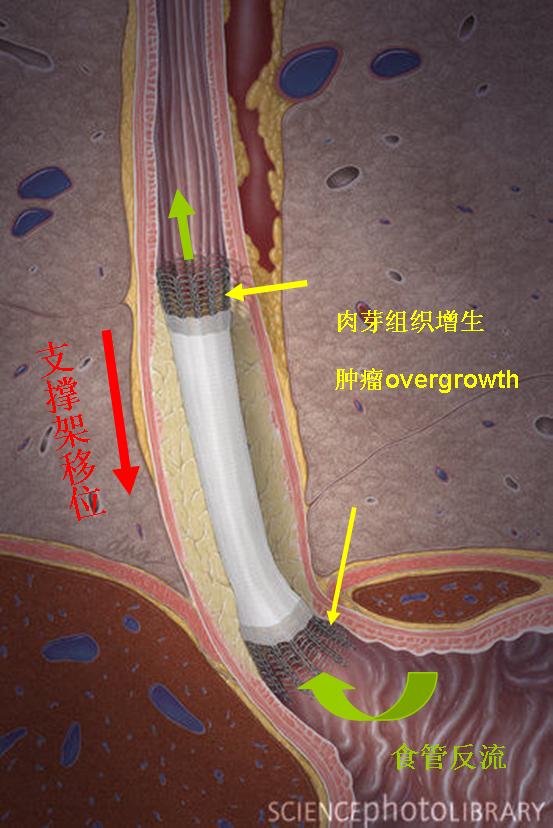 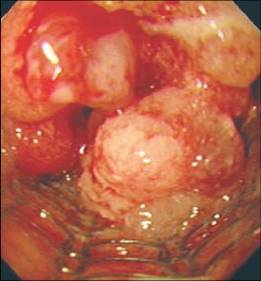 这种部分覆膜的自膨式金属支撑架,在支撑架的主体部分增加了一层薄的硅胶或塑料的膜以防止肿瘤通过网眼向支撑架内生长(ingrowth)导致复发性吞咽困难。而不久以后发现增生的肉芽组织在支撑架裸露的两端生长起到固定支撑架和防止支撑架移位的作用。但这种肉芽组织增生也同样导致支撑架的再阻塞,因为大量的肉芽组织同样可以向支撑架内生长阻塞支撑架。  新的支撑架不断地被设计以克服老一代支撑架所遇到的问题(并发症),主要包括支撑架移位或非肿瘤生长和肿瘤性生长导致的支撑架植入后的复发性吞咽困难。
食管贲门癌支撑架操作相关并发症
金属自膨式食道贲门支撑架操作相关并发症主要由穿孔、吸入性肺炎,发热、出血及严重的疼痛,这些发生在5~15%的病人。轻微并发症包括胸骨后疼痛和胃食管反流。后期并发症包括复发性吞咽困难,这是最重要的并发症,被报告发生率在30~45%之间。延迟并发症还包括出血、食道瘘形成,支撑架移位和肿瘤两端生长(overgrowth)和食物块阻塞。通常通过植入第二个支撑架治疗瘘形成,支撑架移位和肿瘤ingrowth和overgrowth。 抗胃食管反流设计
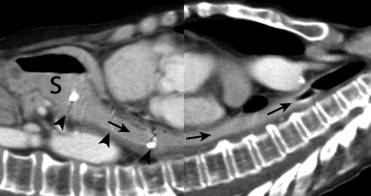
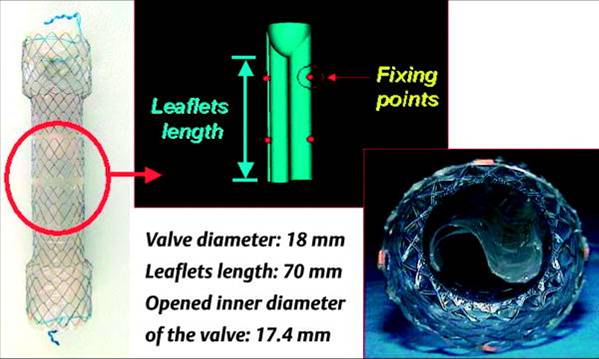
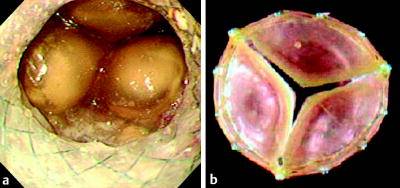
首先一种抗反流设计的支撑架被称为 “Windsock-Type” 瓣膜的支撑架,翻译过来称为“风向袋”
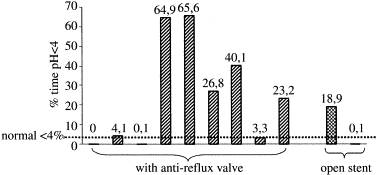
虽然还需要大样本的随机临床试验证实,但目前的试验中通过24小时pH监测和症状统计显示,这种抗返流支撑架除了比非抗返流设计支撑架有效地防止胃食道返流,也比现有的抗返流支撑架有效。 胃食道返流症状评分:不同支撑架的比较
Ambulatory 24 hour esophageal pH monitoring (Kruskal-Wallis test)
此表表明,在返流事件发生次数,最长持续时间,pH<4所占时间%,以及DeMeester评分都明显好于对照组。
克服食道贲门支撑架移位主要依赖支撑架主体两端的喇叭口设计,增加支撑架与食道之间的摩擦力。防止肿瘤通过支撑架网眼内生长主要通过全覆膜支撑架和材料的改进。
 全覆膜设计防止肿瘤通过网眼侵入到支撑架内腔防止支撑架再阻塞,喇叭口设计主要用于防止支撑架移位。但显然这种设计的支撑架遭遇狭窄不严重的病变,有潜在移位的可能。
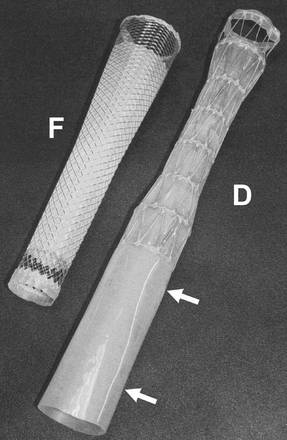
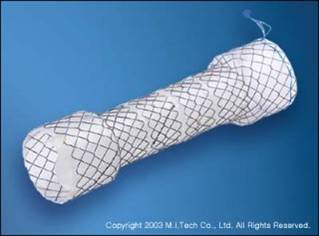 除了适当增加喇叭口的直径,防止支撑架移位。对已经移位的支撑架可以通过支撑架尾端的挂线回收支撑架再重新释放。  Fully covered Niti-S® double Stent(左,Taewoong Medical,Seoul Korea) 和 Fully covered Polyflex™ stent (右,Rusch AG Kernen,Germany ☞ Boston)
全覆膜镍钛-S双支撑架(Fully covered Niti-S® double Stent)为减少支架移位设计,支架的两端膨大为26mm 喇叭口设计,内层为覆膜结构贯穿支架全长,外层中间部分为裸钛镍合金,其网眼可以嵌入食道粘膜内。是目前仅有的植入后短期内肿瘤长入裸支撑架内仍可 以被撤出的支撑架[4]
 Folyflex™ 支撑架 是涤纶单丝编织包裹的硅有机树脂结构装置[5]。该材料证实减少金属支撑架≥6-8个月常见的非肿瘤组织的过度生长[6].
 1. Devesa SS, Blot WJ, Fraumeni JF Jr. Changing patterns in the incidence of esophageal and gastric carcinoma in the United States. Cancer83(10),2049–2053 (1998). 2. Laasch HU, Marriott A, Wilbraham L, Tunnah S, England RE, Martin DF. Effectiveness of open versus antireflux stents for palliation of distal esophageal carcinoma and prevention of symptomatic gastroesophageal reflux. Radiology225(2),359–365 (2002). 3. Shim CS, Jung IS, Cheon YK et al. Management of malignant stricture of the esophagogastric junction with a newly designed self-expanding metal stent with an antireflux mechanism. Endoscopy 37(4),335–339 (2005). 4. Gastrointest. Endosc.63(1),134–140 (2006). 5. Endoscopy 35 (3),207–211 (2003). 6. Gastrointest. Endosc.51(5),556–559 (2000).
|