最初在肝硬化组织内发育成腺瘤样增生(Adenomatous hyperplasia)。下一步早期高分化肝癌(well-differentiated HCC)出现在腺瘤样增生内,并且逐渐替代腺瘤样增生。其后HCC去分化(dedifferentiated),中度分化HCC在早期HCC内发育,形成结节内结节(nodule-in-nodule)型肝癌。最后,结节内结节肝癌持续进展成为进展性早期肝癌(advanced small HCC)。新发结节直接肝细胞癌也是可能的途径。
肝癌发生的多步骤进展示意图
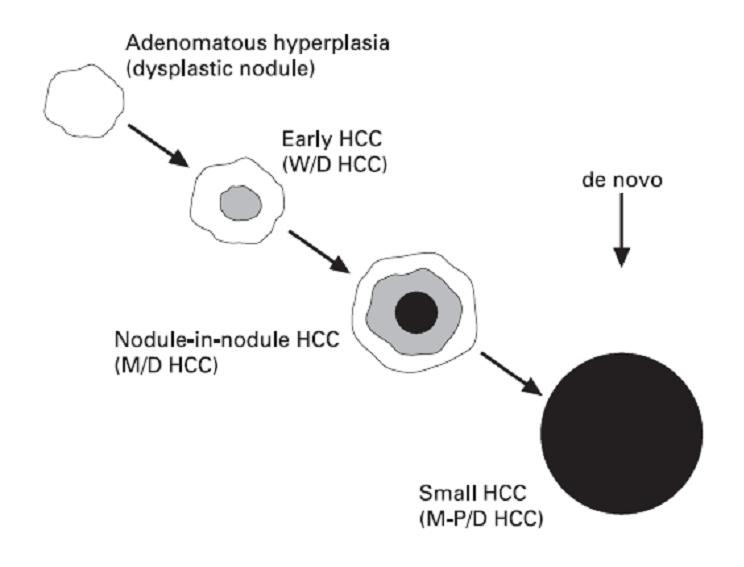
W/D = Well-differentiated; M/D = moderately differentiated; M-P/D = moderately to poorly differentiated
肿瘤病理学发源于19世纪后叶的欧洲。自有肝癌病理分类的100多年以来在此领域内研究的人们就不断寻求把不同的肝癌加以区分。这反映了人们寻求个体化治疗方案选择和评估预后的一种愿望,同时也藉此建立肝癌研究的标准化比较的方案。早年有人将肝癌分为亚临床型与临床型肝癌。所谓亚临床肝癌就肝癌本身而言应无症状、体征,可能出现的临床表现常为肝病所致的。1958年Berman将肝癌分为5型,即:①明显肿瘤型;②急腹症型;③隐匿型;④发热型;⑤转移型。有奥田帮雄等按临床表现分型,日本松本由朗按AFP浓度分型,Primack则按肝功能和临床表现分期。后来病理学进步肝癌就有了就如我们所熟悉的肝癌大体病理分型和细胞类型的分型,许多截然不同的肿瘤可以有相同或相似的镜下形态。即使到了20世纪30年代,电镜的发明使病理医生能够观察到肝细胞的超微结构。尽管病理医师在很多时候能够把它们鉴别开,但仍然离不开它的局限性,也就是直观性,一直停留在以形态学观察为主要手段。根据镜下的观察的肝癌病理分类如下:
肝癌的病理分类: 原发性肝癌属于原发于肝脏上皮的恶性肿瘤。根据WHO的分类,这些肿瘤包括
肝细胞肝癌 hepatocellular carcinoma
胆管上皮癌 Cholangiocarcinoma
胆管囊腺癌 Bile Duct Cystadenocarcinoma
肝细胞和胆管细胞混合癌 Combined Hepatocellular and Cholangiocarcinoma
肝母细胞瘤 Hepatoblastoma
未分化癌 Undifferenciated Carcinoma
(本站主要涉及的是肝细胞肝癌)
肝细胞肝癌的肉眼形态包括肿瘤结节的数量、大小、与周围肝组织的关系,包括有无纤维包膜形成、局部侵润情况、血管内癌栓及卫星结节等,这些也是肝细胞肝癌分型的主要依据。肝细胞肝癌的大体分型尚无统一标准,目前有三种分型:
(1)Eggel分型
(2)日本分型
(3)中国分型
肝细胞肝癌的组织学类型及病理学分级
(1)分化型肝癌
(2)低分化型肝癌
(3)未分化型肝癌
特殊类型的肝癌包括
(1)小肝癌
(2)纤维板层样肝癌
肝细胞肝癌的Edmondson分级:除了镜下表现,对癌细胞本身也有分级,即所谓的Edmondson分级:
|
Ⅰ级
|
癌细胞似正常肝细胞,胞浆明显嗜伊红色,有时见胆汁小滴。核浆比例接近正常,核圆规则,核仁明显,分裂相少,细胞排列成索梁状,索间血窦清晰,衬以单层内皮细胞
|
|
Ⅱ级
|
癌细胞略异形,胞浆中颗粒明显,胞核较大,核浆比例增大, 核染色深浅不一,核仁明显,分裂相多,常见腺泡状排列
|
|
Ⅲ级
|
癌细胞异形明显,胞浆嗜苏木素,胆汁小滴少。胞核大而不规则,出现瘤巨细胞胞核染色质粗且不均匀,核仁多而明显。分裂相多,细胞排列不规则
|
|
Ⅳ级
|
癌细胞形态变异大,有较多的梭形细胞,胞浆少,胞核大,核仁不规则,细胞排列紊乱松散,无一定结构
|
直到20世纪末期,随着细胞和分子生物学知识的迅速进展.这些知识被开始运用于肿瘤病理学.这就产生了分子肿瘤病理学。其诞生可以被认为是病理学发展史上的又一座里程碑,病理医生能对许多运用电镜和免疫组化无法区分的肿瘤加以鉴别。病理学就此由直观性向以分子生物学指标为依据的方向发展.更具有科学性和可靠性。
但对于直径不足2cm的小结节性病变,由于放射学检查和病理检查都难以辨明其特征,因此这些小结节的诊断仍然具有临床挑战性[11~13]。如何区分不典型增生和早期肿瘤仍然是一个悬而未解的医学难题,即使对于肝脏病理学专家也尚未达成一致意见[13]。CD34和甲胎蛋白(AFP)免疫染色诊断的局限性非常明显[14]。
即使对病理学专家而言,微小结节的病理诊断工作也具有很大的挑战性[16]。组织学标记物有可能全面提高这些肿瘤诊断的标准化程度。已有研究者试图通过全基因组基因芯片或者实时定量逆转录多聚酶链式反应(RT-PCR)寻找早期HCC的标记物,例如热休克蛋白70 (HSP 70),磷脂酰肌醇蛋白聚糖3 (GPG3) [17],端粒酶逆转录酶(TERT),丝氨酸/苏氨酸激酶15 (STK6)和磷脂酶A2 (PLAG12B)等,另有文章对此进行了综述[18]。一项包括13-基因组合的分子学指标也被提出讨论(包括TERT,TOP2A和PDGFRA)[19]。
有研究通过基因芯片分析发现了可用于区别HBV感染患者不典型增生性结节和HCC的120个基因标记[20]。在肿瘤标本中进行的蛋白质组学研究至今尚未发现任何有意义的HCC标记物[21]。
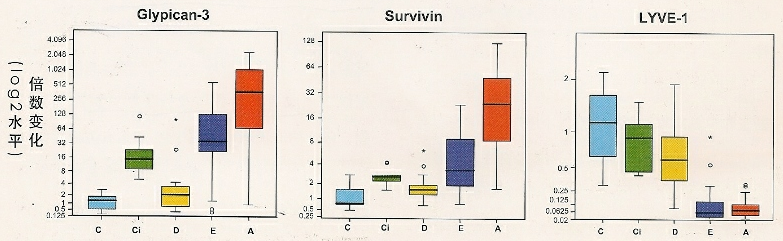
近期,有研究者提出使用3-基因组合(Glypican3,即磷脂酰肌醇蛋白聚糖-3; LYVE 1 [lymphatic vessel endothelial hyaluronan receptor-1] 即淋巴管内皮细胞透明质酸受体1; survivin 即凋亡抑制因子存活素) 作为HCC早期诊断的分子学诊断标准,通过对>70个标本的分析验证显示出85%-95%的准确性[22](图2) 。75个样本的分析也表明磷脂酰肌醇蛋白聚糖-3的免疫染色法对HCC具有很高的预测价值[22](图3)。因此,目前已有针对较小早期HCC的精确诊断方法,而通过基因芯片分析发现的新型标记物的适用性尚需要进一步证实[23]。
3个基因组合(GIγpican-3, L YVEl 和 survivin) 在分子学水平上诊断HCC的准确性。该图显示了肝癌发生过程中所有阶段上述3个最佳基因的表达谱。变化结果以倍数形式表示。柱形图分别代表基因的中位表达情况(25-75百分位点)。图示:对照(C,n=10),肝硬化(Ci,n=10),不典型增生结节(D,n=17),早期HCC (E,n=20),晚期HCC (A,n=20)。
肝癌的临床和分子学分期
现代肝癌分期的目的在于建立疾病预后系统并为最佳候选病例提供适宜的治疗方法。此外还有助于研究者交换信息和使用相似标准设计临床试验。和绝大多数癌症一样,肝癌也有自己相应的临床分期系统。而且这种分期或称为分组的方案有多种:
1. Child-Pugh,Categoric
2. Child-Pugh,Nominal
3. Okuda
4. Cancer of the Liver Italian Program ,意大利肝癌协作组
5. Barcelona Clinic Liver Cancer 巴塞罗那临床肝癌分组
6. Model for End-Stage liver Disease 终末期肝病模型
7. Chinese University Prognostic Index (香港)中文大学预后评分
8. Japanese Integrated Staging
9. Tumor/Node/Metastasis
10. Group d'Etude de Traitement du Carcinoma Hepatocellulaire
11. Liver Cancer Study Group of Japan (JCSGJ 日本肝癌研究组)
12. Tokyo staging system 东京分期系统
13. AJCC(美国癌症联合委员会(AJCC)分期标准)
14. WHO(World Health Organzation, 世界卫生组织)
15. AASLD 美国肝病研究学会
16. ACS 美国外科学院
17. NCCN 美国国家综合癌症网
18. BSG 英国胃肠病学会
19. UICC 国际抗癌联盟
20. CS (China Staging)中国分期
但以上分期仅有极少数设计分子学资料。如乳腺癌,Her2/nu状态可被用于区分有不同治疗结局和疗效的患者亚组[24]。同样非小细胞肺癌中的EGFR突变状态也被用于识别络氨酸激酶抑制剂治疗有效的患者亚组[25]。目前HCC相关临床分期中叶缺乏相关分子学资料。HCC的分子学分期仍处于初步阶段,尚待进一步研究。分子生物学数据可以进一步鉴别出手术切除或者肝移植的最适患者,有助于指导个体化治疗。以下简要分析各种分组方案。
肝癌巴塞罗那分期系统
巴塞罗那临床肝癌分期系统(BCLC)已经成为HCC临床治疗的标准分期系统[4,26]。这一分期系统的正确性已经获得外界证实[27],并取得了AASLD和EASL的认可[5,6]。本站将较为详细阐述将肿瘤分期与治疗策略联系起来的分期系统。不仅如此该方案还推出与治疗策略相关的的预后。表1总结了目前部分临床观察所获得的生存优势或者其他获益与美国国立癌症研究所循证医学标准的关系[28]。该表还将这些循证医学证据与BCLC分期系统结合起来,这已应用于近期对于多激酶抑制剂索拉非尼的研发中,最终结果显示该药物可延长晚期肿瘤患者的生存时间[29]。与乳腺癌和淋巴瘤不同的是,尚未发现与HCC临床转归明确相关的生物学/遗传标记物,因此表中均采用临床变量进行了分析。
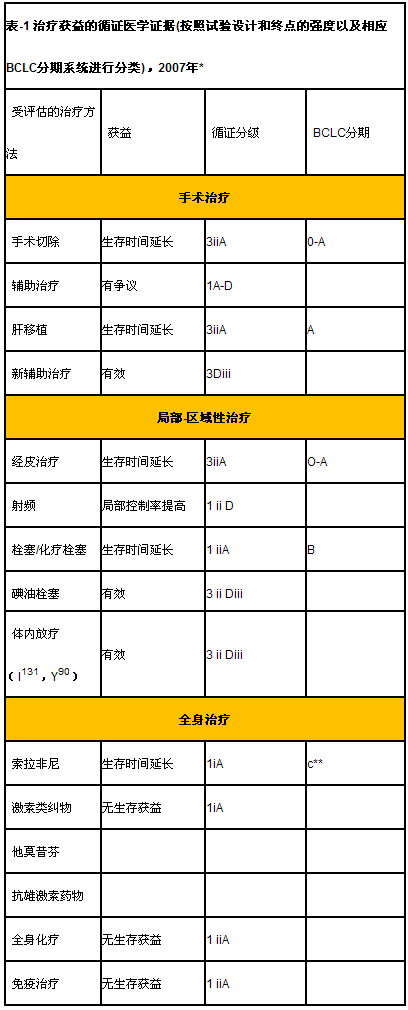 研究设计:随机对照试验,芸萃分析=1(双盲1i,开放1ii);非随机对照试验=2。病例系列研究=3(群体性研究3i,非群体、连续性研究3ii,非群体、非连续性研究3iii)
研究设计:随机对照试验,芸萃分析=1(双盲1i,开放1ii);非随机对照试验=2。病例系列研究=3(群体性研究3i,非群体、连续性研究3ii,非群体、非连续性研究3iii)
终点:生存(A),疾病特异性死亡率(B),生活质量(C),间接替代指标(D),无疾病生存时间(Di),无进展生存时间(Dii),有效(Diii)
*循证分级遵循 NCI: www.cancer.gov[28]; **纳入RCT的患者80%为BCLC-C期,20%为BCLC-B期[29]
据称是目前将肿瘤分期治疗方案和预期生存相结合的唯一分期系统:巴塞罗那临床肝癌分组方案(BCLC),该临床分层系统将肝功能引入分层主要考虑到肝功能失代偿者的自然死亡率高,可能影响对治疗疗效的准确判定。
|
巴塞罗那临床肝癌分组方案
|
|
分期0
Child;
PST0
|
分期A-C
Okuda1-2;
Child A-B;
PS 0-2
|
分期D
Okuda3
Child C
PS >2
|
|
极早期0
单发<2cm原位癌
|
早期A
单发或多发肿瘤<3cm
数量≤3
PST 0
|
中期B
多发结节
PST 0
|
晚期C
门脉浸润
N1, M1
PST1-2
|
终末期D
|
|
单发
|
|
门脉压
胆红素
|
|
正常
|
升高→
|
伴发疾病
|
|
手术切除
|
|
无
|
有
|
|
肝移植
|
PEI/RF
|
化疗栓塞
|
新药
|
|
治愈性治疗(30%)
5年生存率50%~70%
|
随机对照试验30%
3年生存率 20%~40%
|
对症支持治疗30%
1年生存率10%
|
早期肝癌:研究发现早期HCC患者在手术切除、肝脏移植或者经皮消融治疗后5年生存率可达50%-70%[4]。上述结果是基于候选患者在肿瘤状态和肝功能方面采用严格的限制标准得出的。肿瘤状态的评价取决于主要病灶的大小和多中心性(直径≤2cm的单一病灶,直径为2~5cm的单一病灶,直径均≤3cm的3个病灶),这三个不同肿瘤状态的临床结局存在明显差异。对于肿瘤直径≤2cm的患者,近期的病例和临床资料将其定义为极早期HCC[13]。与病理上的原位癌分期相对应。
极早期HCC是指分化良好、含有正常胆道和门脉血供的肿瘤,其结节边界不明显,未侵犯任何其他结构。在日本,这部分患者的生存结局极佳,手术切除或经皮治疗后5年生存分别为89%和71%。此外,其复发率也较低,3年复发率仅为8%[4]。肿瘤相对较大的HCC患者复发率较高,而且遗憾的是,尽管有少数随机对照实验(RCT)取得了一些正面的结果,但目前完全性手术切除/局部消融后尚可接受的标准辅助治疗方法[30]。这些有待进一步研究探索。
BCLC分期中,肝功能相关参数对不适于肝移植的患者的治疗具有重要意义。无临床相关的门静脉高压和胆红素正常是单个肿瘤患者手术治疗后生存时间的主要预测指标30,31]。同样,肝功能Chlid-Pugh A级是经皮消融治疗患者的最强预后指标,尽管肿瘤大小和疗效也至关重要[32]。由于肝移植有可能同时治愈肝癌和原发肝脏疾病,其预后因素已经明确与HCC的某些变量密切相关(即直径≤5cm的单一肿瘤或者直径均≤3cm的3个病灶),也就是所谓的Milan标准[33]。
中晚期肝癌:无法通过手术切除的HCC病例的预后一般不佳,中位生存时间小于1年。25项随机对照试验结果的异质性(2年生存率8%-50%) [34]分析表明,根据BCLC分期系统,这部分无法通过手术切除肿瘤的患者至少可分成三种不同亚组:早期,晚期和终末期[4]。未接受治疗的中期患者(多结节无症状肿瘤,无侵袭性特点)的自然中位生存时间为16月。根据随机对照试验及荟萃分析的结果,TACE可将这部份患者的中位生存时间延长至20个月,从而被认为是这部分患者的标准治疗方法[34]。未接受治疗的晚期患者(症状性肿瘤患者或者ECOG评分1~2分或有血管侵润/肝外转移)的自然中位生存时间为6个月。在这组患者中临床结局随患者的Child-Pugh分级而有所不同。
2006年时尚无任何药物获得FDA批准用于一线治疗晚期HCC患者。但是,随着索拉非尼(一种多激酶抑制剂)经临床试验证实可以为晚期HCC患者带来生存时间获益,这一境况就发生了改变[29]。这一随机对照试验的结果是HCC治疗史上的一项重大突破。
终末期HCC:该分组患者以Okuda III期或者ECOG功能状态评分3-4分为特征,表明患者具有严重的肿瘤相关功能障碍。这部分患者的自然中位生存时间为3~4月。同样 Child-Pugh C级,并且超出肝移植适应症的患者预后极差[26]。
|
肿瘤分期
|
|
PST
|
肿瘤
|
Okuda分期
|
肝脏功能
|
|
Stage A(早期)
|
A 1
|
0
|
单一肿瘤
|
I
|
没有门脉高压,正常胆红素
|
|
A 2
|
0
|
单一肿瘤
|
I
|
门脉高压,正常胆红素
|
|
A 3
|
0
|
单一肿瘤
|
I
|
门脉高压,不正常胆红素
|
|
A 4
|
0
|
3个小于3cm
|
I-II
|
Child-pugh A-B
|
|
Stage B(中期)
|
0
|
大,多个结节
|
I-II
|
Child-pugh A-B
|
|
Stage C(晚期)
|
1-2
|
血管侵入或肝外转移
|
I-II
|
Child-pugh A-B
|
|
Stage D(末期)
|
3-4
|
任何情况
|
|
Child-pugh C
|
除了BCLC系统分期,本站简要介绍其它肝癌的分组方案。
AASLD(美国肝病研究学会):
采用的是巴塞罗那临床肝癌(BCLC)分期与治疗策略,比较全面地考虑了肿瘤、肝功能和全身情况,并且具有循证医学高级别证据的支持,目前全球范围比较公认而广泛采用。肝癌分期除用于预后的预测之外,可运用于治疗方法的选择,2005年AASLD的肝癌临床治疗指南,除肿瘤侵犯及肝脏存留机能外再加上行为能力状况,依据BCLC(Barcelona Clinic Liver Cancer)的分期,将肝癌分成超早期(veryearly),早期(early),中间期(intermediate),晚期(advance)及终末期(terminal)五期,分别建议选择不同治疗方法,前两期建议选择肝脏移植、肝叶切除、射频消融(RFA, radiofrequency ablation )等治愈性疗法、中期选择经导管动脉栓塞、后期可做临床试验、末期则只需保守治疗。概括性地勾勒出治疗的原则。根据BCLC分期可以明确研究的群体,不同分期HCC患者自然病程及预后非常不同。
2002年美国癌症联合委员会(AJCC)分期标准
|
分期
|
T
|
说明
|
|
I 期
|
T1
|
孤立病灶,无血管侵犯
|
|
II 期
|
T2
|
孤立病灶伴血管侵犯;或多个病灶直径<5 cm
|
|
III 期
|
IIIa
|
T3
|
多个病灶直径>5 cm或肿瘤侵犯或肿瘤侵犯门静脉或肝静脉的主要分支
|
|
IIIb
|
T4
|
单个或多个病灶,伴胆囊外邻近器官直接侵犯或穿破脏层腹膜
|
|
IIIc
|
N1
|
有局部淋巴结转移
|
|
IV 期
|
M1
|
远处转移
|
|
纤维化分级
|
F 0
|
纤维化评分 0-4(从没有到中度纤维化)
|
|
F 1
|
纤维化评分 5-6(严重纤维化或肝硬化)
|
美国癌症联合学会(AJCC)提出的新TNM分期系统仅在内部得到验证,并且是基于对手术患者的病例系列研究[37]。所有病例均需要病理学资料,因此该分期系统在临床广泛应用上具有一定的局限性。
Okuda(奥田邦雄)分级系统
|
指标
|
|
|
|
肝脏被肿瘤取代比率
|
>50%
|
<50%
|
|
腹水
|
有
|
无
|
|
白蛋白
|
<3g∕dl
|
>3g∕dl
|
|
胆红素
|
>3mg∕dl
|
<3mg∕dl
|
|
分期
|
|
|
I 期
|
四项中没有一项
|
|
II 期
|
四项中出现1-2项
|
|
III 期
|
四项中出现3-4项
|
Okuda(1985)是最早提出同时考虑肿瘤侵犯及肝功能储备的肝癌分期,他的分期考虑肿瘤体积大於肝脏的50%、腹水、白蛋白(albumin)<3g/L、胆红素(bilirubin)>3mg/dl等四个预后不良的因子,四项皆不符合为stage1、符合一或两项为stage2、符合三或四项皆有的为stage3。
意大利肝肿瘤计划(CLIP)分期系统[36]
|
|
0
|
1
|
2
|
|
Child-Pugh
|
A
|
B
|
C
|
|
肿瘤形态
|
单一且≤肝脏50%
|
多发且≤肝脏50%
|
巨块型>肝脏50%
|
|
甲胎蛋白
|
<400
|
≥400
|
-
|
|
门静脉栓塞
|
无
|
有
|
-
|
1998年意大利人将Okuda修正为CLIP(Cancer of the Liver Italian Program)score,将肝癌小于50%者再细分为多发或单发、加入大血管侵犯(macro vascular invasion)及AFP>400ng/ml,前两者在超声波普及后就很容易诊断,而AFP则与肿瘤的分化或行为有相关。 但按照肝脏受累超过/低于50%来划分肿瘤负荷,这就决定了这项评分系统无法用于识别早期患者。另外,它也缺乏癌症相关症状的评价,而后者是癌症患者预后评价的关键内容。
香港中文大学诊断标准(CUPI)[35]
|
|
|
分值
|
|
TNM分期
|
第一、二期
|
-3
|
|
第三期
|
-1
|
|
第四期
|
0
|
|
无症状的
|
|
-1
|
|
腹水
|
|
3
|
|
甲胎蛋白 ≥500ng/ML
|
|
2
|
|
总胆红素
|
<34
|
0
|
|
34-51
|
3
|
|
>51
|
4
|
|
碱性磷酸酶≥200
|
|
3
|
|
危险群分组
|
CUPI分值
|
|
低危险群
|
≤1
|
|
中危险群
|
2-7
|
|
高危险群
|
>8
|
日本复合分期系统
新的日本复合分期系统(Japanese integrated score,JIS) [38]是典型整合了两种旧的分类系统:即由TNM与Child两者加总计分的肝癌分期。JIS将繁琐的TNM分期简化为只考虑单一肿瘤、肿瘤最大径小于两厘米,及无血管侵犯三个变项的TNM(LCSJG, Liver Cancer Study Group Japan),三项皆符合为T1、两项为T2、一项为T3、皆不符合则为T4。获得国际癌症联盟(UICC)认可的TNM分期系统(主要在日本应用)和日本版的Child-Pugh分级。近期在>4500例患者中进行的研究证实JIS评分的正确性优于CLIP评分[38]。
1. JIS评分的定义
|
|
评分
|
|
0
|
1
|
2
|
3
|
|
Child-pugh分级
|
A
|
B
|
C
|
|
|
TNM分级
|
I
|
II
|
III
|
IV
|
2.日本肝癌研究组的TNM分期解释(第4版)
|
T
|
I.单个 II. <2 cm III. 无血管侵犯
|
|
T1
|
符合3个条件
|
|
T2
|
符合2个条件
|
|
T3
|
符合1个条件
|
|
T4
|
无符合
|
|
Stage I
|
T1 N0 M0
|
|
Stage II
|
T2 N0 M0
|
|
Stage III
|
T3 N0 M0
|
|
Stage IV-A
|
T4 N0 M0, or any T N1 M0
|
|
Stage IV-B
|
任何 T N0-1 M1
|
3.肝损伤: TNM分期中的T是指肿瘤、N指肝门淋巴结、M指远处转移。T又依肿瘤是否大于2cm、有无血管浸润及是否在一叶等细分为T1~T4,然后再将不同的T、N、M组合成Ⅰ、Ⅱ、ⅢA、ⅢB、ⅣA、ⅣB六期。T1N0M0的患者属于第一期,也就是早期患者,T2N0M0 的患者为第二期,T1N1M0、T2N1M0、T3N1M0的患者均为第三期,第四期又分为两种,没有发生远处转移的患者,也就是T4M0型属于4A期,而只要有远端转移,即T4M1,则为4B期。
|
指标/肝损伤
|
A
|
B
|
C
|
|
腹水
|
无
|
可控的
|
不可控的
|
|
血胆红素(mg/dL)
|
<2.0
|
2.0~3.0
|
>3.0
|
|
血清白蛋白(g/dL)
|
>3.5
|
3.0~3.5
|
<3.0
|
|
ICG R15 (%)
|
<15
|
15~40
|
>40
|
|
PT (%)
|
>80
|
50~80
|
<50
|
NCCN(美国国立综合癌症网络):TNM 分期
TNM分期中的T是指肿瘤、N指肝门淋巴结、M指远处转移。T又依肿瘤是否大于2cm、有无血管浸润及是否在一叶等细分为T1~T4,然后再将不同的T、N、M组合成Ⅰ、Ⅱ、ⅢA、ⅢB、ⅣA、ⅣB六期。T1N0M0的患者属于第一期,也就是早期患者,T2N0M0 的患者为第二期,T1N1M0、T2N1M0、T3N1M0的患者均为第三期,第四期又分为两种,没有发生远处转移的患者,也就是T4M0型属于4A期,而只要有远端转移,即T4M1,则为4B期。
TNM分期十分细腻,尤其T的分期中T1~T3的分期取决于是否有癌周小血管的浸润,故实际上是一个建筑在病理检查基础上的分期。由于肝癌能作手术切除的病例不多,取得病理检查的机会少,故TNM分期在实际应用上颇多困难。尤其TNM分期中未考虑到合并肝硬化的情况,而肝硬化的肝功能情况更是制约治疗方案选择与估计预后的重要因素。
以上NCCN(美国国立综合癌症网络)采用的TNM分期方式在国际上最为规范,但被认可程度却较低,原因在于:①对于HCC的治疗和预后至关重要的血管侵犯,在治疗前(特别是手术前)难以准确判断;②治疗HCC非常强调肝功能代偿,而TNM分期并没有说明患者肝功能状况;③各版TNM分期的变化较大,难以比较和评价。
终末期肝病模型(model for end-stage liver disease,MELD):
终末期肝病模型(model for end-stage liver disease,MELD)是主要应用血清胆红素、凝血酶原时间国际标准化比值和血清肌酐指标来评价终末期肝病的系统(主要是评估肝硬化疾病的严重程度)。最初,2000年Malinchoc等[1]首先应用MELD来预测终末期肝病行经颈静脉肝内门-体分流术后患者的死亡率,并证实 MELD可以预测终末期肝病的死亡率及术后的生存时间。其后在预测终末期肝病死亡率及肝移植中的应用也渐趋成熟,应用范围也开始扩大到重型肝炎、肝癌中。
它利用病人的血清胆红素值,血清肌酐,以及国际标准化比值的凝血酶原时间(INR)预测生存。这评分也使用美国器官共享网络(United Network for Organ Sharing,UNOS)和欧洲脏器移植基金会(Eurotransplant)。的优先分配的肝移植。这是计算公式如下:
其计算公式为: R=0.378ln[胆红素(mg/dl)]+1.12ln(INR)+0.95ln[肌酐(mg/dl)]+0.64(病因:胆汁性或酒精性0,其他1)。
Kamath等[2]将公式改良为 R=3.8ln[胆红素(mg/dl)]+11.2ln(INR)+9.6ln [肌酐(mg/dl)]+6.4(病因:胆汁性或酒精性0,其他1)。
于浩,马慧曾在中华医学研究杂志撰文《MELD评分系统的应用及不足》,对该分期系统进行了阐述。
1. Malinchoc M, Kamath PS, Gordon FD, et al. A model to predict poor survival in patients under going transjugular intrahepatic portosystemic shunts.Hepatology,2000, 31(4) : 864-871.
2. Kamath PS, Wiesner RH, Malinchoc M, Kremers W, Therneau TM, Kosberg CL, D'Amico G, Dickson ER, Kim WR (2001). "A model to predict survival in patients with end-stage liver disease". Hepatology 33 (2): 464–70.
中国分期 China Staging
我国1977年全国肝癌防治研究协作会议通过了一个将肝癌分为3型和3期的方案。我国1977年分型与分期标准为:
|
单纯型
|
临床和化验无明显肝硬化表现。
|
|
硬化型
|
有明显肝硬化的临床表现和化验表现
|
|
炎症型
|
病情发展快,伴有持续性癌性高热或SGPT持续升高1倍以上。
|
|
Ⅰ期
|
无明确肝癌症状和体症。
|
|
Ⅱ期
|
超过Ⅰ期标准而无Ⅲ证据。
|
|
Ⅲ期
|
有明确恶病质、黄疸、腹水或远处转移之一
|
Ⅱ期的跨度过大、又未能表述与门静脉癌栓,肝门及腹腔淋巴结转移等分期要素,与国际抗癌联盟所发布的TNM分期相去过远[1]。上述标准经10余年实践,提示这种分型分期对指导治疗方案的选择以及估计预后没有价值早已被临床淘汰。1998年及1999年杨秉辉等在中国抗癌协会肝癌专业委员会召开的大连和成都会议上皆曾分别提出过肝癌临床分期的建议[2].供大家讨论。在此基础上,2001年9月在广州召开的第八届全国肝癌学术会议上正式通过了“原发性肝癌的临床诊断与分期标准”,如下表:
|
分期
|
说明
|
|
I 期
|
Ia
|
单个肿瘤最大直径≤3cm,无癌栓、腹腔淋巴结及远处转移;肝功能分级Child A
|
|
Ib
|
单个或两个肿瘤最大直径之和≤5cm,在半肝,无癌栓、腹腔淋巴结及远处转移;肝功能分级Child A
|
|
II 期
|
IIa
|
单个或两个肿瘤最大直径之和≤10cm,在半肝或两个肿瘤最大直径之和≤5cm,在左、右两半肝,无癌栓、腹腔淋巴结及远处转移;肝功能分级Child A
|
|
IIb
|
单个或两个肿瘤最大直径之和>10cm,在半肝或两个肿瘤最大直径之和>5cm,在左、右两半肝,或多个肿瘤无癌栓、腹腔淋巴结及远处转移;肝功能分级Child A。肿瘤情况不论,有门静脉分支、肝静脉或胆管癌栓和(或)肝功能分级Child B。
|
|
III 期
|
IIIa
|
肿瘤情况不论,有门静脉主干或下腔静脉癌栓、腹腔淋巴结或远处转移之一;肝功能分级Child A或B
|
|
IIIb
|
肿瘤情况不论,癌栓、转移情况不论;肝功能分级Child C
|
1. 汤剖猷主编,新编常见恶性肿瘤诊治规范,原发性肝癌分册。北京医科大学中国协和医科大学联合出版社,北京:1999:87
2. 杨秉辉,任正刚,汤钊猷,关于原发性肝癌临床分期的研究和建议,中华肝胆外科杂志,1999;5:67
介入治疗与肝癌分期
虽然研究表明,在所选定的晚期肝细胞癌患者(BCLC分期,B期)经化疗栓塞术(TACE)治疗后可以获得生存受益。然而,尽管广泛使用肝动脉化疗栓塞术治疗不可切除性肝癌,但在涉及病人该项治疗的各个方面普遍缺乏标准化,包括病人的选择,疾病分期,栓塞技术,随访标准的建立以及再治疗的选择,甚至于可接受的标准辅助治疗方法。当今,介入放射医生在计划对患者进行栓塞治疗时,所面临的非标准化问题之一是肝癌分期系统的应用。规范分期系统将优化病人的选择,减少不必要的操作和检查,以便更有效的进行比较研究,以及给病人及其家属提供更准确的生存预测。目前还没有专为TACE设计的肝癌临床分期,尽管BCLC分组方案中认为B期适合TACE治疗,经验者会发现,尽管B期,治疗效果有好坏之分,C期尽管未被BCLC分期列入TACE范围,仍然在某些病例中可以获得较好的疗效。或许终有一天通过大样本的研究找出适合TACE本身的临床分期。
事实上,肿瘤的分期包括有临床分期、病理分期、再治疗分期以及尸检分期。
所谓临床分期是指在开始治疗前,收集病人所有的临床检查资料,其中包括实验室检查(如肝功能储备等),活检与介入性诊断技术、影像学获得的有关肿瘤范围及病理学资料,从而对肿瘤进行分期。许多癌症使用TNM(tumor-node-metastasis)的分期方式來描述肿瘤的侵犯程度。肝细胞癌(肝癌)病患常合并肝炎及肝硬化,除肝癌本身之外,肝衰竭也是导致死亡主要原因,因此肝癌的分期系統,除须包括肿瘤侵犯程度以外还加入了肝功能储备的检查。肝癌可切除率不高,病理报告取得不易,临床分期较为实用,临床与病理分期最大差异在宏观或是微观于血管侵犯。因2cm以下的肿瘤预后特別好而有血管侵犯的预后特別差,分期时这两组必需细分出來。肝脏储备功能最常采用的是包括白蛋白(albumin)、胆红素(bilirubin)、凝血酶原时间(prothrombin time)、腹水(ascites)、肝性脑病(encephalopathy)等五項检查,并用Child-Pugh's分类來表示。
而病理分期则是通过收集治疗性手术切除的全部肿瘤标本获得有关肿瘤范围及病理学资料,对肿瘤进行分期。再治疗分期是在首次治疗产生明显的疗效后,如果病人须再次接受治疗时,有必要对肿瘤进行重新分期。
尸检分期则根据尸体解剖获得的有关肿瘤范围及病理学资料,对肿瘤进行分期。
和其它肿瘤分期目的和意义一样,肝癌的分期的目的首先是根据每例病人的具体病情,制定个性化的治疗方案。由于目前对实体瘤的分期主要是根据肿瘤大小,及波及的解剖范围,因此,肿瘤分期为制定正确的治疗方案提供依据。如对有广泛肿瘤转移或肝内病变较大的患者不再合适作肝癌根治性手术,或即使勉强切除也不能达到预期的临床效果,即使达到预期的临床效果,由于外科手术风险使其面临其它治疗在安全方面竞争性排挤。同样分期较晚的肝癌患者也不可能使用局部治疗达到治愈目的。其次,肝癌分期的意义是根据分期诊断结果,评估病人可能的预后,但必须明确指出,肝癌的肿瘤分期不是决定病人预后的唯一指标(病人身体状况、伴发疾病严重程度、肿瘤的组织级别、治疗方式的选择,甚至病毒等因素均可能与病人的预后密切相关),但肿瘤分期在决定病人生存期方面常常是关键的指标。由于使用统一的肿瘤分期系统,有利于全球背景下相互交流与疗效比较(使用相同的或不同的方法治疗相似的病人),有助于对肝癌的进一步的临床或循证医学的研究。同时肿瘤分期也有助于了解各种不同肝肿瘤的生物学特性,转移靶器官的倾向。
有两个或三个肝分期系统之间进行有限的比较结果已经发表,但是,这些比较研究不回答这样一个问题,究竟那种分期系统提供了不可切除肝癌TACE后的最准确的生存预测[4-7]。Grieco等人[4]报告巴塞罗那临床肝癌(BCLC)分期有更好的预后准确性,从而反对Okuda分期系统或CLIP(Cancer of the Liver Italian Program)分期系统用于晚期肝癌肝动脉化疗栓塞治疗预后评估。Brown等人[5]报告说,对不能手术肝癌患者在TACE后Child-Pugh分层系统优于MELD(End-stage Liver Disease)系统预测病人的生存。Testa等人[6]报告Okuda分期系统在病毒性肝炎和TACE治疗不可切除性肝癌患者的生存预测方面劣于CLIP和MELD。有些作者采用不同的分期系统在同一研究中互换(如Okuda和Child-Pugh) ,评估它们在类似分层水平上所提供预后的准确性[7]。其结论是CLIP系统被报告在晚期肝癌患者TACE术后生存的评估优于Okuda系统[8] 。
一般来说,介入放射学医生寻求不可切除性肝癌TACE可能的益处都是通过选择他们认为最精确的分期系统,有时他们的这种特别的选择甚至没有有力的科学支持。排除其他因素的影响,由于缺乏标准化的得到共识的肝癌分期系统,使这种研究不能相互比较。因此,肝分期系统是肝动脉化疗栓塞治疗晚期肝癌最好的预测患者生存方式,并得到充分的强调。为此,有作者试图排名前12位的最常用的肝癌分期系统,晚期肝癌肝动脉化疗栓塞治疗的患者进行交叉研究,根据其对预后的准确性评估确定最佳分期系统[9]。
目前自西方国家引进的的各种分期系统,国内文献都在应用。日本的临床指南,对治疗的态度更为积极,更符合国情。随着国内乙肝疫苗接种的普及,肝癌发病率将逐渐下降。健康体检的普及小肝癌的检出率也会逐年增加,射频消融的广泛使用和分子靶向药物的引进,肝癌患者的预后将会有所改变,相信不久的将来,肝癌分期的方式也会随之改变,或许在将来的某一天肝癌的分期也许是在分子或基因水平上的分层。
肝癌的分子学分期:利用基因表达特性预测结局
目前尚没有与HCC相关的分子学分期系统[39]。全基因组表达谱可能是揭开HCC发病机制和研究其异质性起源的最适宜方法。实际上,HCC的基因表达谱研究已经提示存在不同的患者亚组(可按照病因学,疾病分期,复发和生存时间等不同因素进行分类)(相关内容综述见[40])。
近期,研究者还报告了以特殊信号传导通路激活状态为基础的分子学分期系统[41]。这些研究展示了基因表达谱研究在阐明HCC的分子学发病机制和改善HCC患者的预后预测方面的重要进展。初步研究表明可以根据分子生物学对肿瘤进行分期。肿瘤及其微环境的生物特性已经显示出区分癌症患者亚组不同生存结局的能力,但是这些数据的外在真实性还需要进一步证实。
将肿瘤的分子生物学特征和临床实践相结合将有助于手术切除和肝移植患者的选择。
单纯根据基因标记(gene signatures)来预测生存时间存在一定的局限性,因为造成患者死亡的原因除了肿瘤进展还有肝衰竭。因此,如何精确选择队列和/或使用癌症相关死亡作为研究终点,从而将上述偏倚降低至最小程度是需要优先考虑的问题。一个可以在HBV患者中区分HCC预后良好或不佳的基因标记最近得以报道[42]。 406个基因标记的分析揭示了这两个不同HCC亚组患者之间分子通路机制的生物学差异。通过测量细胞增殖、细胞凋亡、泛素化和组蛋白修饰方面的差异是区分这两个不同生存时间亚组的最佳定量方法。
最近,该研究组还报道了另外一种预后极差的HCC患者亚组,表现出可能源自祖细胞的肝母细胞瘤样基因标记特征[43]。另外一项研究分析了40名患者的67份原发和转移性HCC样本的基因表达图谱。通过应用监督学习算法(即以事先为计算机提供的己知标本临床分类信息为参考),作者成功发现了153个基因的分子标记,可用于转移性HCC患者的分期以及识别与患者生存时间相关的基因[44]。即使选择最适宜接受手术切除/局部消融治疗的患者,治疗后3年肿瘤复发率仍然可达50%,包括既往未发现的肿瘤转移灶和新发肿瘤[30]。病理性参数包括血管浸润、组织学分化不良和卫星病灶等均可预示转移[30]。目前尚缺乏可预示侵袭性行为特征的明确生物学指标。有两项研究应用基因表达谱分析以探索与术后肿瘤复发相关的基因标记。其中在日本进行的一项研究通过高密度寡核背酸基因芯片(-6000基因)分析发现了12个基因标记,其报道的训练集和验证集(training set and validation set)的准确率超过90%(总样本量为60名患者) [45]。另一项研究采用以PCR为基础的基因阵列平台对100名HCC患者的3072个基因进行分析,结果发现可作为肿瘤复发的独立预测指标的20个基因标记[46]。
人们为预期肝癌的预后,建立了很多分期系统。但是专家们在这点上并没有共识。 为了寻找最适合的分期系统开始在各个系统之间进行比较。Sirivatanauksorn等人[9]99例肝癌外科手术切除病人以整体生存率(overall survival rate)和无病生存期(disease free rate)为主要目的,比较6个常用的系统(TNM,Okuda,CLIP,BCLC,CUPI,JIS),同时评价Child-Pugh分类。结果显示单变量分析除了Okuda,所有分期系统显示了显著意义。多变量分析中TNM和Child-Pugh被证实对整体生存率有较好的预期能力。而无病生存期的多变量分析显示,TNM,CLIP,BCLC和JIS有显著意义,而TNM在他们的研究中是最好的。
1. Llovet JM, Real MI, Montana X, et al. Arterial embolization or chemoembolization versus symptomatic treatment in patients with unresectable hepatocellular carcinoma: a randomized controlled trial. Lancet 2002; 359:1734–1739.
2. Camma C, Schepis F, Orlando A, et al. Transarterial chemoembolization for unresectable hepatocellular carcinoma: meta-analysis of randomized controlled trials. Radiology 2002; 224:47–54.
3. Lo CM, Ngan H, Tso WK, et al. Randomized control trial of transarterial lipiodol chemoembolization for unresectable hepatocellular carcinoma. Hepatology 2002; 35:1164–1171.
4. Grieco A, Pompili M, Caminiti G, et al. Prognostic factors for survival in patients with early-intermediate hepatocellular carcinoma undergoing non-surgical treatment: comparison of Okuda, CLIP and BCLC staging systems in a single Italian centre. Gut 2005; 54:411–418.
5. Brown DB, Fundakowski CE, Lisker-Melman M, et al. Comparison of MELD and Child-Pugh scores to predict survival after chemoembolization for hepatocellular carcinoma. J Vasc Interv Radiol 2004; 15:1209–1218. 6. Testa R, Testa E, Botta F, et al. Trans-catheter arterial chemoembolization in patients with viral cirrhosis: role of combined staging systems, Cancer Liver Italian Program (CLIP) and Model for End-stage Liver Disease (MELD) in predicting outcome after treatment. Aliment Pharmacol Ther 2003; 17:1563–1569.
7. Yuen MF, Chan AO, Wong BC, et al. Transarterial chemoembolization for inoperable, early stage hepatocellular carcinoma in patients with Child-Pugh grade A and B: results of a comparative study in 96 Chinese patients. Am J Gastroenterol 2003; 98:1181–1185.
8. Biselli M, Andreone P, Gramenzi A, et al. Transcatheter arterial embolization therapy for patients with hepatocellular carcinoma: s case-controlled study. Clin Gastroenterol Hepatol 2005; 3:918–925.
9. Sirivatanauksorn Y, Tovikkai C. Comparison of staging systems of hepatocellular carcinoma. HPB Surg. 2011;2011:818217. Epub 2011 Jun 27.
|