肝癌的实验室检查在肝癌诊断中面临两个角色。肝癌的早期诊断的筛查或肝癌的筛查和肝癌的诊断。肝癌的实验室检查中最重要的是肝癌的血清学检查。现代肝癌血清学标志物如下:
HCC的早期诊断和筛查的目的是在高危人群中普遍进行肿瘤标记物的检查以发现早期病变,提高治疗疗效。目前对于肝硬化患者和其他特殊危险人群,推荐每6月进行超声筛查以发现早期HCC[5,6]。迄今为止,只有一项随机研究证实早期筛查可明显提高治愈性治疗的比例,该研究受试人群为中国HBV感染人群[7]。欧洲队列研究和成本获益分析进一步证实了筛查措施的益处[3,8]。 发达国家早期可治愈肝癌诊断趋势 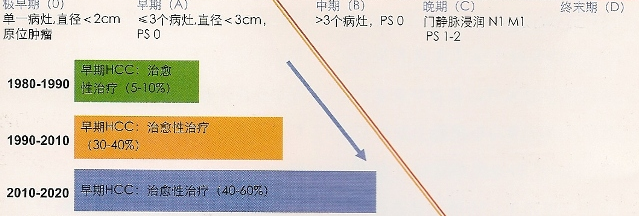 肝硬化患者中开展的肝癌筛查计划是发达国家的HCC发生了转变。欧洲计划从90'S年代早期可治愈肝癌的诊断率5%~10%,提高到2020年的40%~60%。 根据欧洲和美国的HCC诊疗指南,正确定义癌前病变或者早期HCC结节具有重要意义[5,6]。不典型增生病灶应该定期进行影像学随访,因为这些病变有三分之一将最终发展成恶性肿瘤[4]。相应而言,早期肿瘤应该接受有效的治愈治疗,如手术切除,移植和经皮消融治疗,尽管费用昂贵[4]。目前迫切需要找到更好的办法来明确这些病变的特征。否则,将会消弱根据筛查结果所采用的召回政策的效益比。
美国的一个多中心的研究结果表明,作为早期肝癌的血清标志物,AFP水平有最佳接受者操作特性曲线(Receiver Operating Characteristic Curve)下面积,其次是脱—γ—羧基凝血酶原(Des-γ-carboxy-prothrombin,DCP)* 和AFP-L3%**。研究人员提示,AFP水平为10.9ng/ml(其中敏感度66%和特异性82%)是为早期肝癌检测的最佳选择[4]。然而,人群中,AFP水平敏感性低,肝癌的验前概率低,而且,临界值的研究表明在这涉及到诊断,而不是监测。
附件 * 去γ 羧基凝血酶原 (DCP)是肝细胞癌 (HCC)的一种标志物 ,对HCC的诊断特异性超过甲胎蛋白 (AFP)达 95 %以上 ,但其敏感性低于AFP。DCP不仅可用于HCC的诊断 ,也可用于对HCC的复发、转移及预后判断。随着研究的不断深入 ,DCP将会在HCC的早期发现、早期诊断以及预后判断中发挥更大作用。 ** AFP-L3组份是岩藻糖基化的AFP,这种分子对肝癌细胞具有非常高的特异性,AFP-L3%≥10 应高度怀疑存在HCC。 AFP与超声检查相结合的使用可能大大增加肝癌监测的费用,特别是那些假阳性结果的病例。由于AFP低敏感性,一些专家建议,对肝癌不应该使用本指标水平的监测,除非没有高质量的超声设备,但是应用AFP水平测量是便宜,许多医生考虑将这种测量作为肝癌监测的附加方式。 3. Sangiovanni A, Del Ninno E, Fasani P, De Fazio C, Ronchi G, Romeo R, et al. Increased survival of cirrhotic patients with a hepatocellular carcinoma detected during surveillance. Gastro- enterology 2004; 126: 1005- 1014. 4. Llovet JM, Burroughs A, Bruix J. Hepatocellular carcinoma. Lancet 2003;362: 1907-1917 5. Bruix J, Sherman M. Management of hepatocellular carcinoma. Hepatology 2005;42: 1208-1236 6. Bruix J, Sherman M,Llovet JM, Beaugrand M, Lencioni R, Burroughs AK, et al. Clinical management on hepatocellular carcinoma. Conclusions of the Barcelona-2000 EASL confer- ence. J Hepatol 2001 ;35:421-430. 7. Zhang BH, Yang BH, Tang ZY. Randomized controlled trial of screening for hepatocellular carcinoma. J Cancer Res Clin Oncol 2004; 130:417-422. 8. Bolondi L, Sofia S, Siringo S, Gaiani S, Casali A, Zironi G, et al. Surveillance programme of cirrhotic patients for early diagnosis and treatment of hepatocellular carcinoma: a cost effectiveness analysis. Gut 2001 ;48:251-259. 9. Trinchet J, Beaugrand M from GRETCH. A randomized trial comparing 3-month vs. 6-month screening for HCC by ultraso- nography in cirrhosis. Book of Abstract- InternationalLiver Cancer Association(lLCA), 2007. 10. McMahon BJ, Bulkow L, Harpster A, Snowball M, Lanier A, Sacco F, et al. Screening for hepatocellular carcinoma in Alaska natives infected with chronic hepatitis B: a 16-year population- based study. Hepatology 2000;32:842-846 11. Ikai I, Arii S, Kojiro M, Ichida T, Makuuchi M, Matsuyama Y, et al. Reevaluation of prognostic factors for survival after liver resection in patients with hepatocellular carcinoma in a Japanese nationwide survey. Cancer 2004; 101 :796-802. 12. Bolondi L, Gaiani S, Celli N, Golfieri R, Grigioni WF, Leoni S, et al. Characterization of small nodules in cirrhosis by assessment of vascularity: the problem of hypovascular hepatocellular carcinoma. Hepatology 2005;42:27-34. 13. Kojiro M. Focus on dysplastic nodules and early hepatocellular carcinoma: an Eastern point of view. Liver Transpl 2004; 1 0:S3-S8. 14. Park YN, Yang CP, Fernandez GJ, Cubukcu O, Thung SN, Theise NO. Neoangiogenesis and sinusoidal "capillarization" in dysplastic nodules of the liver. Am J Surg Pathol 1998;22:656-662. 15. Forner A, Vilana R, Ayuso C, Bianchi L, Sole M, Ayuso JR, et al. Diagnosis of hepatic nodules <20 mm in cirrhosis. Prospective validation of the AASLD guidelines for Hepatocel- lular Carcinoma (HCC). Q1 Hepatology, in press.
|

