一、历史
危及生命的盆腔大出血原因包括创伤、肿瘤、妇产科疾病和医源性。1894年H.A.kelly 首先进行了髂内动脉结扎【51】。结扎切断盆腔供血这一观点一直持续到60年代【49】。结扎髂内动脉的结果直接导致了盆腔动脉压力下降。但问题是术后临床失败,病人经常还处于不稳定状态和血肿压力下降【50】。
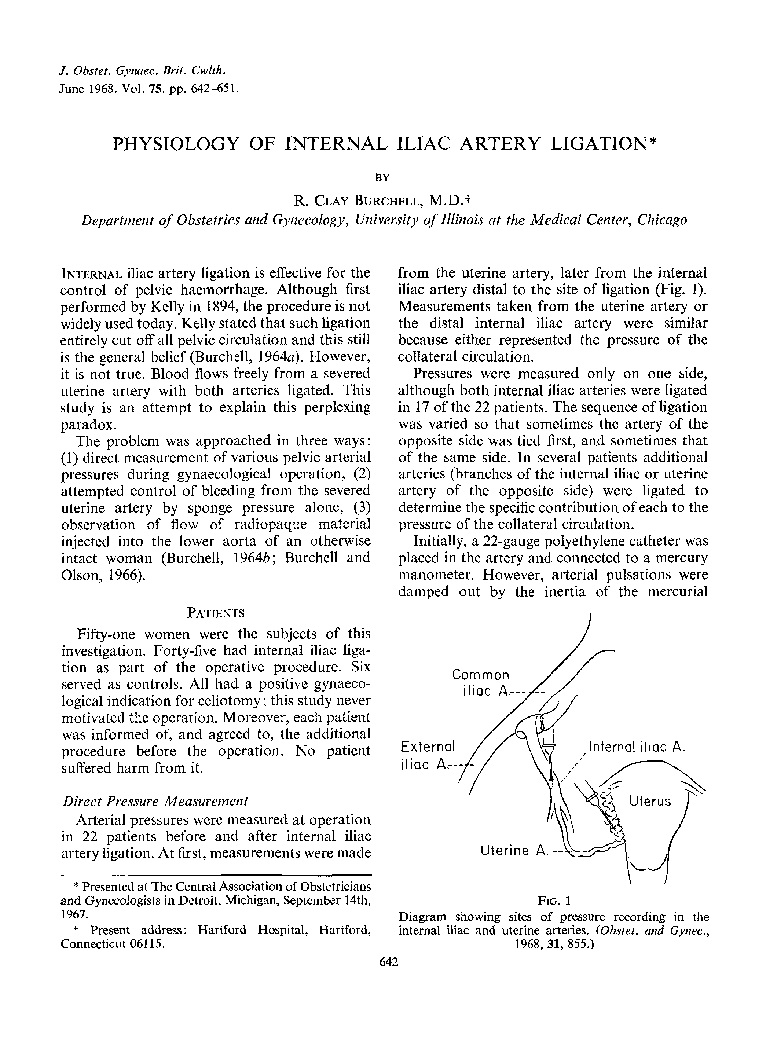 |
|
切断盆腔供血使盆腔压力下降以治疗盆腔出血,这一观点持续到60年代【49】 |
Burchell1 1968- exp ligation of int iliac artery
|
结扎侧 |
脉压(Pulse Pressure) |
平均压(Mean Pressure) |
血流(Blood Flow) |
|
同侧 |
77% ↓ |
22% ↓ |
49% ↓ |
|
对侧 |
14% ↓ |
10% ↓ |
无意义 |
|
双侧 |
85% ↓ |
24% ↓ |
48% ↓ |
历史上双侧髂内动脉结扎这一手术的成功率一般不是很高,Clark 等人报告为42%【52】,Joshi 等人报告的成功率为60%【53】。临床期待更好的解决方法。
选择性动脉栓塞技术首先起源于发现胃肠道出血的血管造影术【1】,进而发展成为进行出血部位的供血动脉的栓塞【2】。再以后这项技术被广泛应用于各种不能控制的大出血的栓塞治疗。经导管动脉栓塞成功地应用于盆腔出血始于60年代,Miller 等人应用于盆腔恶性肿瘤出血的成功率为70%-90%【54】,Ring等人用于创伤出血的成功率为80%-90%【55】。 第一例用于产科的病例发表于1979【3,4】。
二、
和如何选择理想的产后出血病人一样,产后大出血栓塞技术,包括子宫动脉树最合适的栓塞位置也仍然待阐述。目前的文献尚没有标准的适应症和栓塞技术可供选择。但通常发生产后大出血时,在穷尽了各种办法之后才考虑子宫动脉栓塞。这些办法包括:
(1)静脉子宫收缩剂(intravenous uterotonic agents)
(2)积极的子宫按摩(aggressive uterine massage)
(3)手工胎盘摘除(manual extraction of the placenta)
(4)检查和修复产道撕裂(examination and repair of genital lacerations)
(5)Bakri 球囊植入(Bakri balloon placement)或宫纱填塞
典型的子宫动脉栓塞技术首先采用Seldinger‘s 法进行股总动脉穿刺,在透视下将Pigtail导管置于主动脉分叉上方后行双侧盆腔动脉造影(这一步有时可以省略)、再置换5F Roberts 子宫动脉导管(其它导管包括Glide Cobra和 Cobra C2 导管)进行双侧选择性髂内动脉造影或髂内动脉前分支造影用于观察子宫动脉开口位置或其它部位出血。
Roberts子宫动脉导管可以完成髂内动脉造影后继续进行选择性子宫动脉血管造影以分辨来自子宫动脉的出血病灶。一旦发现出血病灶尽可能将微导管选择进入出血的供血动脉,并仔细的将栓塞材料通过导管注入子宫动脉,直到血管造影确定被栓塞的动脉血流停滞。之后再进行被栓塞动脉上一级动脉血管造影,再次除外其它动脉供血的可能性。因为在主要出血动脉供血被栓塞后,其它供应出血的动脉偶然会被变得明显。在一侧子宫动脉栓塞后再以相同的方式进行对侧的血管造影,因为可能存在对侧代偿供血的可能性(cross-filling)。如果出血并没有停滞或血管异常并没有消失,存在其它动脉供血如卵巢动脉[5],腹壁上动脉,骶正中动脉都应该被检查,发现异常立即栓塞。治疗在绝大多数的情况下获得成功。
尽管各种不同的栓塞剂都见诸于文献,如明胶海绵,弹簧栓子,生物胶,可脱球囊,PVA颗粒,但在多数情况下,医源性(获得性动静脉畸形、假性动脉瘤、子宫动脉分支直接破裂)子宫血管异常、子宫乏力等导致的产后大出血可以安全有效的通过可吸收明胶海绵碎片获得成功治疗。明胶海绵胶浆或碎片在这一治疗领域内的应用从一开始到现在都没有被质疑过。
目前,Gelfoam 小块或匀浆是最常用栓塞用材料【43】(除非发现假性动脉瘤)。从其第一例应用一直沿用至今较少发生变化。这种材料在2到4周内有效,这段时间足够防止更多的出血,并允许后期侧支循环缓慢形成。甚至在双侧子宫动脉都闭锁时,其他动脉来源的侧支网络都可以供应子宫内分支。尤其是发自腹主动脉前外侧的卵巢动脉可能在双侧子宫动脉突然闭锁的情况下提供血供以维持子宫的供血。
颗粒栓塞材料,例如Gelfoam 粉末,PVA和液体栓塞剂由于可能发生缺血并发症而不推荐用于PPH。这些栓塞材料可能导致更远端的闭塞,使侧支循环网络不能到达子宫肌层而造成缺血。但T. M. Hong等建议长效的PVA和短效的明胶海绵联合应用。为了防止子宫坏死,若使用接近微导管可以容忍的上限直径的PVA,范围在250~355mm。在盐水稀释后,仅仅注射50~100mgPVA,直到粘膜染色,但保持子宫动脉和其分支开放,没有血流停滞。撤除微导管后再经4F导管注射明胶海绵碎片,阻塞子宫动脉开口,可以得到安全和有效的栓塞。
尽管血管造影对鉴别动脉出血是敏感的,在具体出血点不清楚的情况下经皮栓塞也可以是有效的。Paris等最先报道了再出血血管不可见的情况下进行栓塞控制了PPH。这个观点被此后的研究所证实,说明血管造影和经皮方法相对手术治疗的优越性。
产后大出血的病人或怀孕产妇,子宫动脉可以显著的迂曲,超选择导管术有时会变得很困难,即便使用4F导管。而超选择导管是防止栓塞剂返流到非靶器官的重要的技术步骤。因此,可以使用共轴微导管技术将导管送到子宫动脉末端。共轴导管的使用可以有两个优点:第一,可以减少子宫动脉痉挛,而这在使用4F直径以上导管会经常发生;第二,可以进行末梢栓塞,避免非靶器官的意外栓塞。此外,当明确活动性出血点时,微导管可以通过子宫动脉分支接近活动性出血点,可以使用微弹簧栓子进行栓塞,更有效的避免侧支循环供血造成再出血[6]。
子宫肌瘤进行子宫动脉栓塞已经被广泛接受。子宫动脉栓塞并发症,虽然罕见,但是仍然在文献中有广泛的报告,包括由于子宫内膜萎缩导致的持久性闭经[7]、子宫坏死[8]、致死性败血症[9]、外阴和阴道坏死导致的膀胱瘘[10,11]。这些并发症的发生常由于使用PVA或明胶海绵粉,在操作结束时双侧子宫动脉完全栓塞,血流停滞或缺乏。为了避免缺血的并发症,Pelage[12]等建议,子宫动脉栓塞的终点应该包括(1)与子宫肌瘤相关的多血管病变消失;(2)子宫动脉末梢血流减少;(3)子宫动脉主干血流开放,包括宫颈阴道支。写此一段的目的是希望,在产后大出血栓塞时应用子宫肌瘤栓塞的经验。
对于不同原因导致的产后出血其技术也稍有不同:包括原发产后出血,继发产后出血,经产道产后出血,剖腹产后出血,伴发病理的产后出血,早期产后出血和晚期产后出血。(产后出血目前分类比较乱)
早期产后出血(原发性产后出血)
产后早期大出血是指出生24小时内经产道出血大于500ml的情况,又称为原发性产后出血。最开始应迅速进行临床评价,补充血容量必要时输血。请产科医生对病人进行双合诊并仔细检查产道是否有裂伤。接下来进行裂伤缝合、子宫按摩、阴道填塞以及给予宫缩剂。
在以前,当持续出血或者出血量很大时,需要急诊子宫切除术。其他非子宫切除的外科治疗包括子宫动脉结扎和髂内动脉结扎,这适用于希望保留生育功能的妇女。但是髂内动脉结扎术在技术上仍然不太成熟,成功率仅为42%,可能是由于髂内动脉结扎后远端子宫血流再通,特别是在这种产后供血丰富的子宫。如果血管结扎控制出血失败,再进行子宫切除术时比直接子宫切除的手术并发症发生率更高。
Brown等在1979年首先报道了子宫动脉栓塞术在难治性产后出血的应用;1980年Pais等进行了重复性研究工作。有趣的是,现在的栓塞技术与当时的首次报道并没有大的改变。股动脉的直接穿刺后插入眼镜蛇形导管或者反曲线导管(例如Roberts子宫动脉导管)至髂内动脉的前支,行选择性动脉造影。当找到出血血管后,进行选择性置管,注入有明胶海绵块的混悬浆直至血管内的前进血流中止。选择明胶海绵是因为它只会引起暂时性的血管闭塞,2-4周后血流可以自行再通。
确切的出血血管通常能够被选择性动脉造影发现,文献报道的出血的探测率为33%-100%。一些作者报道子宫动脉是最常见的产后出血的出血动脉,而另一些作者报道阴道动脉是最常见的出血动脉。如果不能找到确切的出血动脉,这时经验性用明胶海绵颗粒或者混悬浆栓塞髂内动脉的前支。在一篇文章中报道,在子宫切除术后仍然出血的病例,其产后出血的出血动脉是卵巢动脉。因此,该作者建议进行更加全面的血管造影评价以及后续的栓塞。从技术观点来说,在腹腔和盆腔进行动脉造影来找到子宫变异或者侧支供血血管时需要小心谨慎。
在很早期关于产后出血(PPH的)报道中就提及对于产道广泛侧支循环的出血并且需要选择性栓塞出血血管的情况,单独使用线圈栓塞治疗PPH是不被推荐的。在Minck等早期的报道中,线圈栓塞术的失败率是很高的,虽然刚开始将线圈置入髂内动脉中时好像中止了出血,但是再次出血难免并且需要重复血管造影。侧支循环,例如来自股深动脉的内旋动脉和来自腹壁下动脉的分支,重建了远端的血供而使出血继续。只有在用明胶海绵选择性栓塞这些侧支时出血才能被最终止住。在接下来的时间里,通过对大量关于用栓塞术治疗产科出血的报道的总结,发现颗粒栓塞(最常用的是明胶海绵)是现今最优良的技术。
接下来需要考虑的是对髂内动脉和/或子宫动脉进行单侧还是双侧栓塞。这两种方法都有大量的报道。虽然在一些病人中,选择性单侧动脉栓塞可以达到很好的止血效果,但是在很多病例中子宫和产道都有来自对侧髂内动脉的丰富血供,使病人持续出血,因此而导致病人最终不得不行子宫切除术的报道有很多。这说明在单侧动脉栓塞后需要更彻底的动脉造影去寻找是否还有其他的出血血管。由于在比较PPH单侧栓塞和双侧栓塞的有效性上没有确定的前瞻性研究,因此最终的选择一般都由操作医师决定。
用于产科出血栓塞治疗的血管造影在技术上并没有太大的难度。不过仍然有偶发技术问题或者临床突发情况发生的报道。例如,、子宫动脉痉挛可以是由选择性置管引起的。但是,使用血管扩张药可以顺利地更多次的置管以及最终的栓塞。栓塞颗粒的反流可见于有严重血流动力学障碍的病人。一篇文献中报道,髂内动脉中的少量的前向血流正好遇到了远端血管的痉挛,使得明胶海绵反流,最终不得不用丁基-2-氰基丙烯酸酯胶粒栓塞才控制住出血。但是这种胶粒并不适合作为治疗PPH的栓塞剂。其他一些为控制PPH的血管造影技术也曾经被报道过。选择性置管后直接向出血血管中注入血管加压素也可控制出血,但是没有前瞻性队列研究来评价使用血管加压素控制PPH的有效性。
晚期产后出血(继发性产后出血)
晚期PPH是指出生后24小时发生的产后大出血。其血管造影及栓塞技术与早期PPH是相同的。继发性PPH最主要的原因是软产道裂伤以及伴或不伴内膜炎的胎盘残留。如果在裂伤一期修复或者刮宫术后仍然持续出血,在手术结扎或者子宫切除术之前,可以选择栓塞术。最开始使用单侧股动脉穿刺途径,然后使用眼镜蛇形导管或Robert 导管选择对侧髂内和子宫动脉进行造影。再选择性置管同侧的髂内和子宫动脉。大部分作者都首先使用明胶海绵颗粒进行栓塞。Pelage等在大部分病例中选择性置管以及栓塞的是子宫动脉;而Feinberg等报道用明胶海绵和线圈栓塞的是髂内动脉。
异位妊娠和妊娠滋养细胞疾病的栓塞治疗
用超声检查和测β-HCG水平来对临床可疑的异位妊娠确立诊断后,早期予以药物或者手术治疗,可以避免大出血并发症的发生。但是即使这样,有时仍然需要进一步的治疗来控制出血。现今已报道了相当多组利用动脉栓塞术控制出血而获得成功的腹腔异位妊娠患者。另外还有报道说对于宫颈异位妊娠的患者,术前进行动脉栓塞,有助于减小术中出血[44,45]。
现在最常用的方法是在手术切除异位妊娠之前,对异位妊娠进行栓塞。利用标准的动脉造影技术,找到异位妊娠的供血血管,然后选择性明胶海绵栓塞供血血管。Badawy等综述了1988年—1997年间的11篇文献中总共21个利用动脉栓塞治疗宫颈和腹腔异位妊娠的病例,显示控制出血的成功率为100%。有时在手术切除腹腔异位妊娠之后还会有出血,在这些病例中,可以进行选择性栓塞胎盘残余物。腹腔异位妊娠栓塞治疗很少出现并发症,不过仍然可能有肠梗死、脓肿形成以及肠穿孔等极少见的情况发生。
妊娠滋养细胞疾病也可以引起出血,机理是侵袭性的滋养细胞组织的生长造成大量动静脉血管网。现在已经有了用栓塞术治疗侵袭性滋养细胞组织合并的严重出血后,对滋养细胞疾病用传统的化学治疗的报道,这种治疗可以完全杀死滋养细胞。
胎盘异常:侵入性、植入性、穿透性胎盘的栓塞治疗
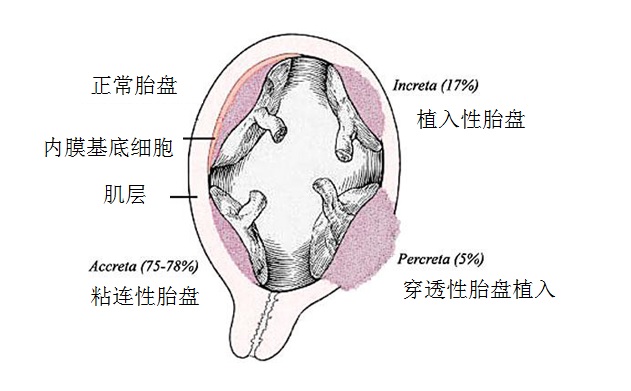
胎盘异常在上临床上对产科医生是一个巨大挑战。有些胎盘异常往往在分娩前很难被发现和诊断,一般当分娩后胎盘不能娩出或者持续出血时,才会引起医生注意。在产科监护中,胎盘异常是最常见的子宫切除术的原因。穿透性胎盘(percreta)中绒毛生长穿透子宫肌层到达子宫浆膜表面,这种胎盘异常是最危险的,因为可能导致子宫破裂和大出血。Miller 等人【48】对胎盘前置和侵入性胎盘的病例进行了一个全面综述,在一组62名侵入性胎盘患者中,定量分析了剖宫产子宫切除术中失血量,41名患者估计失血超过2000mL,9名超过5000mL,4名超过10000mL,2名超过20000mL。
临床上剖宫产是大多数情况下的选择,剖宫产后,不同的作者对胎盘滞留处理阐述了不同的选择,包括氨甲碟呤,宫颈扩张和刮宫,宫腔镜环状切除,子宫切除,也包括子宫动脉栓塞或球囊阻塞髂内动脉预防手术出血。
分娩前或分娩后子宫动脉栓塞治疗也是一个选择。术前选择经腋动脉穿刺途径置管,而经股动脉穿刺途径会对分娩时的无菌和手术处理造成困难。在置管过程中要进行胎儿监护。这样当分娩后发生出血并且需要栓塞时,导管已经放置在需要的位置了。如果术前没有进行动脉置管,而分娩后发生出血,这时可经股动脉穿刺置管。Mitty 等对有出血高危因素(侵入性胎盘和腹腔妊娠)的患者中进行产前预防性动脉造影进行了报道,预防性动脉造影后进行栓塞可以控制这些病人的出血,而这在传统方法中很难实现,并且其保留生育力的优点也得到推崇。在穿透性胎盘并且侵袭到膀胱的病例中进行栓塞术,然后可在12天后将胎盘切除,并且在一段恢复期后膀胱功能可以恢复正常。
另两组研究建议对术前置管的方法进行修改,Dubois等和Weeks等,即使用闭塞球囊暂时性闭塞髂内动脉前支的血流(Weeks及其同事使用的是经股动脉穿刺途径【46】,而Dubois等用的是经腋动脉穿刺途径,后者在产前置管中被推荐),该方法主要技术是术前在髂内动脉内置入闭塞球囊导管。在整个分娩过程中球囊保持紧缩状态,导管和套管都用肝素化盐水冲管。手术分娩结束后,病人还在手术室里时就立即将球囊充气扩张。这种方法让医生有足够的时间进行下一步的手术以更好地控制出血,或者选择栓塞术控制出血。Dubois等在最终行子宫切除术之前,通过向闭塞导管端孔注射明胶海绵颗粒以栓塞髂内动脉前支,或者3 French(1mm)微导管可从闭塞球囊导管的端孔插入,然后选择子宫动脉注入无菌明胶海绵以栓塞。大部分作者报道这种方法只有少量出血,而且临床效果很好【47】。但是有些作者质疑产前预防性置入球囊的价值,在一个小型的前瞻性队列研究中,他们使用了相似的球囊闭塞技术,研究结果却是其在预防产后出血上没有得到益处。因此,该项技术是否有效还有待验证。
La Folie T【13】等人在评价6例异常胎盘选择性动脉栓塞的成功率时,认为甚至以前进行过子宫动脉结扎的患者也是可行的。但其并发症可能比正常胎盘的PPH的更多。Descargues G【14】等人认为尽管胎盘异常产后大出血,子宫动脉栓塞的成功率低。但是,动脉栓塞可以获得一个安全的等待期,可以手动移出,甚至自发的移出。当产前诊断胎盘异常时,产后大出血胎盘未移出可以考虑进行子宫动脉栓塞,以减少输血和保留生育能力。
Anna-Maria Belli等人在GEST 2012(布拉格)上认为IR可以帮助胎盘异常的病人的技术包括
(1)双侧髂总动脉阻塞球囊在产后被充盈,或 +子宫动脉栓塞,或+子宫切除
(2)双侧髂内动脉阻塞球囊,产后被充盈,或子宫动脉栓塞,或子宫切除
(3)主动脉阻塞球囊,产后被充盈膨胀,或子宫动脉栓塞,或子宫切除
(4)事先将导管置好,产后立即用于预防性子宫动脉栓塞
预防性介入治疗技术中-阻塞性球囊 vs PTA 导管
|
阻塞性球囊导管 |
PTA球囊导管 |
顺应性球囊
不肯能损伤动脉壁
没有不透光标记
容易破裂
一种大小 |
非顺应性球囊
可能导致内膜损伤
有不透光标记
很少可能破裂
5-6F鞘
有多种直径大小可选 |
动静脉畸形的栓塞治疗
AVM导致产后出血是产后出血的少见原因,分为先天性和获得性两种。先天性AVM可以导致子宫出血但是不属于产科出血的范畴,因为其不是妊娠和分娩导致的。获得性AVM常见原因是分娩过程中的器械损伤,例如胎盘残留时的刮宫术或者剖宫产。获得性AVM还是侵袭性妊娠滋养细胞疾病的并发症。
子宫动静脉畸形破裂的主要症状是突然性、间歇性并且阴道出血量大,难以通过内科治疗加以控制,经常需要输血支持生命体征。应警惕这种不常见的病变存在,避免不适宜的操作如子宫刮吸术。在排除更加常见导致子宫出血的原因后,通常诊断需要通过动脉造影或超声检查确立,有时宫腔镜检查发现搏动性包块也可确立诊断。
动脉造影除了可以确定出血的位置也可以指导进一步栓塞治疗,作为急诊开腹前的一项选择,尽管患者有时面临相对的生命体征不稳定。
虽然病因不同,但其治疗的方法是相似的。可用颗粒栓塞剂(例如明胶海绵或者PVA)对AVM进行栓塞直至动脉畸形的供血动脉的血流完全阻断。多组研究对利用选择性动脉栓塞术成功治疗AVM进行了报道。期望的是行选择性置管供血血管,但是当选择性栓塞不太可能时,可以考虑栓塞髂内动脉及其分支。在一个对动脉栓塞治疗AVM的更加全面的综述中,Badawy 等报道了其控制出血的成功率为94%。生育力的保留是栓塞治疗AVM相对于手术治疗(例如子宫切除术)AVM的一个最大的优点,除此之外栓塞治疗前的动脉造影更易发现出血的位置,也避免手术动脉结扎导致侧支循环容易形成,促使出血很快复发。
产前证实子宫动静脉畸形是否需要进行预防性子宫动脉栓塞,不得而知。但有人报告因产前发生宫腔息肉进行手术发生大出血进行子宫动脉栓塞后顺利分娩。Nasu K 等人报告[15]一例27岁女性无症状子宫AVM孕妇足月分娩健康婴儿,尽管产后出血1600ml,经保守治疗后出院。产后三个月才进行了子宫动脉栓塞术。作者们认为孕妇子宫AVM需要个性化处理。D. Timmerman 等人则认为多普勒超声诊断子宫AVM患者2/3患者可以保守治疗,PSV(peak systolic velocity )值可以区别高危患者和低危患者【16】。
产后出血预防性栓塞
关于在保守治疗无效的情况下,动脉栓塞被证实是非常有效的,本站已经在多个地方加以阐述。Mitty et al【17】还描述了对于有高度出血危险性的9例患者进行预防性栓塞的价值,特别是前置胎盘、胎盘植入和腹腔妊娠产妇。栓塞在剖腹产前进行。子宫在栓塞操作期间被铅防护围裙保护以减少放射线影响。所有9例病人在随后的剖腹产时出血很少。
子宫动脉假性动脉瘤的栓塞
子宫动脉假性动脉瘤是剖腹产后或阴道产后导致迟发性产后大出血不常见的原因[18~20]。当子宫动脉撕裂或损伤的时候形成子宫动脉假性动脉瘤。外溢的血流通过破裂的血管进入组织,由于血液周围组织包裹和抵抗中,最终在子宫组织内形成一个腔,并引起迟发性产后大出血。相对于具有动脉三层(内膜,肌层,浆膜)血管壁的真性动脉瘤来说,假性动脉瘤的壁紧紧是由血栓或纤维组成的。虽然超声有助于动脉瘤的评估[21],但子宫动脉造影对于假性动脉瘤的诊断和后续的栓塞治疗是必需的。
通过计算机检索数据库可以发现许多作者对产后假性动脉瘤实施成功的栓塞【18~22】。子宫动脉假性动脉瘤大多数由一侧动脉供血,栓塞一侧动脉是逻辑上的思维定式。但也有作者[19,20]预防性地栓塞两侧动脉。Brian C Cooper 等人[22]报告一例迟发性产后大出血病人,经左侧子宫动脉造影证实位于中线子宫肌层或腔内的假性动脉瘤,成功栓塞后,对侧子宫动脉造影未发现动脉瘤显影和新的出血病灶。在栓塞后1天,移出宫腔填塞物后,再次发生大出血。重复血管造影证实右侧子宫动脉出血到假性动脉瘤内,需要再次栓塞。所以尽管是单侧动脉供血的假性动脉瘤,当一侧动脉栓塞后,由于血流的再分布、转流或组织缺氧产生新的血管。其导致最初的动脉成功栓塞后发生由侧支动脉供血的再出血。Burchell【23】也证实双侧髂内动脉结扎比单侧结扎可以更有效的降低搏动压。单侧栓塞被证实对宫颈怀孕的治疗效果不好【24】。
假性动脉瘤产后大出血失败的另外一个原因是当丰富的绒毛滞留在动脉瘤内,动脉栓塞后来自盆腔动脉的侧支循环迅速恢复,使动脉瘤再通【25,26】。Jung Hyeok Kwon等【27】也报告了类似病例。因此特别强调密切关注栓塞后血清ß-HCG实验的情况,如果血清ß-HCG升高,甲氨蝶呤(又称氨甲蝶呤,氨甲叶酸,一种抗肿瘤药)治疗,或栓塞后立即进行子宫刮宫术,可以减少假性动脉瘤的复发。这些建议也可以应用于子宫动静脉畸形的病例。
当然,不充分的栓塞导致栓塞失败是不言而喻的。特别是来自子宫外动脉供血的假性动脉瘤如阴部内动脉、卵巢动脉、腹壁下动脉、或子宫动脉的侧支循环【19,25,28】。小心翼翼地寻找其它的供血动脉是十分必要的。
宫缩乏力
产后大出血最常见的原因是宫缩乏力,其占产后大出血子宫动脉栓塞治疗的64%~72%【29,30】。如果可能子宫动脉栓塞应尽可能针对造影剂外溢的区域;但是这些区域在血管造影图像上并不是都可以看见的【29】。造影剂外溢正常情况下以1~2ml/分流速逸出血管外才能被血管造影图像识别[31]。文献上血管造影发现产后大出血活动性出血从33%~89%不等[32~34]。没有发现造影剂外溢一样进行子宫动脉栓塞并不影响其成功率,这已经被文献报告30,35]。子宫乏力的子宫动脉栓塞考虑使用可吸收的明胶海绵碎片,其生物降解时间是30~45天。
与产后产道损伤相关(Delivery-related Injuries of the Genital Tract)
子宫动脉栓塞也适合与生产相关的产道损伤,如产道撕裂和血肿从而避免开腹手术[36,37]。
子宫切除术后再出血
尽管外科手术有较高的风险,许多年来产后大出血的最后手段就是子宫切除。但是,子宫切除也有失败是时候[38]。子宫外出血或子宫切除时动脉未能充分结扎可能是主要原因【39】。这些特殊的情况下,子宫动脉栓塞仍然可以获得成功,已经被很多的作者证实[40~42]。
栓塞成功的定义:
技术成功:成功将双侧子宫动脉栓塞至血流停滞。所发现的非子宫动脉活跃出血(造影剂外溢)成功栓塞至血流停滞,所发现的假性动脉瘤应用弹簧栓子进行栓塞。
临床成功:栓塞后避免子宫切除术。
Embolization in the Treatment of PPHTechnique
-
Emergency cases
-
Arterial puncture: Rt CFA or bilateral CFA
-
•+/-Initial balloon occlusion of CIA or IIA, depends on initial clinical status
-
Embolic agent selection: gelfoam, large particles >700um, coils
1. Baum S, Nusbaum M, Clearfield HR, et al. Angiography in the diagnosis of gastrointestinal bleeding. Arch Intern Med. 1967; 119:16–24.
2. Rosch J, Dotter CT, Brown MJ. Selective arterial embolization. A new method for control of acute gastrointestinal bleeding. Radiology. 1972; 102:303–306.
3. Heaston DK, Mineau DE, Brown BJ, et al. Transcatheter arterial embolization for control of persistent massive puerperal hemorrhage after bilateral surgical hypogastric artery ligation. AJR Am J Roentgenol. 1979; 133:152–154.
4. Brown BJ, Heaston DK, Poulson AM, et al. Uncontrollable postpartum bleeding: A new approach to hemostasis through angiographic arterial embolization. Obstet Gynecol. 1979; 54:361–365.
5. Oei PL, Chua S, Tan L, Ratnam SS, Arulkumaran S. Arterial embolization for bleeding following hysterectomy for intractable postpartum hemorrhage. Int J Gynaecol Obstet. 1998 Jul;62(1):83-6.
6. M.W. Sproule, A.M. Bendomir, K.A. Grant and A.W. Reid, Embolization of massive bleeding following hysterectomy, despite internal iliac artery ligation. Br J Obstet Gynaecol 101 (1994), pp. 908–909.
7. G. Tropeano, K. Litwicka, C. Di Stasi, D. Romano and S. Mancuso, Permanent amenorrhea associated with endometrial atrophy after uterine artery embolization for symptomatic uterine fibroids. Fertil Steril 79 (2003), pp. 132–135.
8. C.D. Godfrey and E.A. Zbella, Uterine necrosis after uterine artery embolization for leimyoma. Obstet Gynecol 98 (2001), pp. 950–952.
9. A. Vashisht, J. Studd, A. Carey and P. Burn, Fatal septicemia after fibroid embolization. Lancet (1999), pp. 307–308.
10. T.J. Yeagley, J. Goldberg, T.A. Klein and J. Bonn, Labial necrosis after uterine artery embolization for leiomyoma. Obstet Gynecol 100 (2002), pp. 881–882.
11. A.H. El-Shalakany, M.H. El-Din, G.A. Wafa, M.E. Azzam and A. El-Dorry, Massive vault necrosis with bladder fistula after uterine artery embolization. Int J Obstet Gynecol 110 (2003), pp. 215–216.
12. J.P. Pelage, O. Le Dref, M. Kardache and R. Rymer, Polyvinyl alcohol particle size for uterine artery embolization; response to correspondence. Radiology 218 (2001), pp. 605–606.
13. La Folie T, Vidal V, Mehanna M, Capelle M, Jaquier A, Moulin G, Bartoli JM. Results of endovascular treatment in cases of abnormal placentation with post-partum hemorrhage. J Obstet Gynaecol Res. 2007 Oct;33(5):624-30.
14. Descargues G, Douvrin F, Degré S, Lemoine JP, Marpeau L, Clavier E. Abnormal placentation and selective embolization of the uterine arteries. Eur J Obstet Gynecol Reprod Biol. 2001 Nov;99(1):47-52.
15. Nasu K, Yamaguchi M, Yoshimatsu J, Miyakawa I.Pregnancy complicated by asymptomatic uterine arteriovenous malformation: a case report.J Reprod Med. 2007 Apr;52(4):335-7.
16. D. Timmerman, J. Wauters, S. Van Calenbergh, D. Van Schoubroeck, G. Maleux, T. Van Den Bosch, B. Spitz Color Doppler imaging is a valuable tool for the diagnosis and management of uterine vascular malformations. Ultrasound in Obstetrics and Gynecology Volume 21, Issue 6, 2003.Pages: 570-577
17. Mitty H, Sterling K, Alvarez M, Gendler R. Obstetric haemorrhage. Prophylactic and emergency arterial catheterisation and embolotherapy. Radiology 1993; 188: 183 – 7.
18. Descargues G, Douvrin F, Gravier A, Lemoine JP, Marpeau L, Clavier E. False aneurysm of the uterine pedicle: an uncommon cause of post-partum haemorrhage after cesarean section treated with selective arterial embolization. Eur J Obstet Gynecol Reprod Biol 2001;97:26–29.
19. Pelage JP, Soyer P, Repiquet D, et al. Secondary post-partum hemorrhage: treatment with selective arterial embolization. Radiology 1999;212:385–389.
20. Ho SP, Ong CL, Tan BS. A case of uterine artery pseudoaneurysms. Singapore Med J 2002;43(4):202–204.
21. Wiebe ER, Switzer P. Arteriovenous malformations of the uterus associated with medical abortion. Int J Gynecol Obstet 2000;71:155–158.
22. Brian C Cooper, Michelle Hocking-Brown, Joel I Sorosky and Wendy F Hansen. Pseudoaneurysm of the Uterine Artery Requiring Bilateral Uterine Artery Embolization. Journal of Perinatology (2004) 24, 560–562.
23. Burchell RC. Internal iliac artery ligation: hemodynamics. Obstet Gynecol 1964;24:737–739.
24. Simon PH, Donner C, Delcour C, Kirkpatrick C, Rodesch F. Selective artery embolization in the treatment of cervical pregnancy: two case reports. Eur J Obstet Gynecol Reprod Biol 1991;40:159–161.
25. Pelage JP, Dref OL, Mateo J, et al. Life-threatening primary postpartum hemorrhage: treatment with emergency selective arterial embolization. Radiology 1998; 208:359-362.
26. Greenwood LH, Glickman MG, Schwartz PE, Morse SS, Denny DF. Obstetric and nonmalignant gynecologic bleeding: treatment with angiographic embolization. Radiology 1987; 164:155-159.
27. Jung Hyeok Kwon, MD and Gi Sung Kim, MD. Obstetric Iatrogenic Arterial Injuries of the Uterus: Diagnosis with US and Treatment with Transcatheter Arterial Embolization. Radiographics. 2002;22:35-46.
28. Bromley PJ, Clark T, Weir IH, Zwirewich CV. Radiologic diagnosis and management of uterine artery pseudoaneurysm: case report. Can Assoc Radiol J 1997; 48:119-122.
29. E.Soncini, A.Pelicelli, P.Larini, C.Marcato, D. Monaco and A. Grignaffini. Uterine artery embolization in the treatment and prevention of postpartum hemorrhage. Uterine artery embolization in the treatment and prevention of postpartum hemorrhage. International Journal of Gynecology & Obstetrics Volume 96, Issue 3, March 2007, Pages 181-185
30. J.P. Pelage, O. Le Dref, D. Jacob, P. Soyer, D. Herbreteau and R. Rymer, Selective arterial embolization of the uterine arteries in the management of intractable post-partum hemorrhage, Acta Obstet Gynecol Scand 78 (1999), pp. 698–703.
31. S.A. AbdRabbo, Stepwise uterine devascularization: a novel technique for management of uncontrolled postpartum hemorrhage with preservation of the uterus, Am J Obstet Gynecol 171 (1994), pp. 694–700.
32. J. Salvat, M.H. Schmidt, M. Guilbert and A. Martino, Vascular ligation for severe obstetrical hemorrhage: review of the literature, J Gynecol Obstet Biol Reprod 31 (2002), pp. 629–639. View Record in Scopus | Cited By in Scopus (11)
33. L.H. Greenwood, M.G. Glickman, P.E. Schwartz, S.S. Morse and D.F. Denny, Obstetric and nonmalignant gynecologic bleeding: treatment with angiographic embolization, Radiology 164 (1987), pp. 155–159.
34. Y. Yamashita, M. Takahashi, M. Ito and H. Okamura, Transcatheter arterial embolization in the management of postpartum hemorrhage due to genital tract injury, Obstet Gynecol 77 (1991), pp. 160–163.
35. T.M. Hong, H.S. Tseng, R.C. Lee, J.H. Wang and C.Y. Chang, Uterine artery embolization: an effective treatment for intractable obstetric haemorrhage, Clin Radiol 59 (2004), pp. 96–101.
36. J.F. Deux, M. Bazot, A.F. Le Blanche, M. Tassart, A. Khalil and N. Berkane et al., Is selective embolization of uterine arteries a safe alternative to hysterectomy in patients with postpartum hemorrhage?, Am J Roentgenol 177 (2001), pp. 145–149.
37. Y. Yamashita, M. Takahashi, M. Ito and H. Okamura, Transcatheter arterial embolization in the management of postpartum hemorrhage due to genital tract injury, Obstet Gynecol 77 (1991), pp. 160–163.
38. C.M. Zelop, B.L. Harlow, F.D. Frigoletto Jr., L.E. Safon and D.H. Saltzman, Emergency peripartum hysterectomy, Am J Obstet Gynecol 168 (1993), pp. 1443–1448.
39. M.W. Sproule, A.M. Bendomir, K.A. Grant and A.W. Reid, Embolisation of massive bleeding following hysterectomy, despite internal iliac artery ligation, Br J Obstet Gynaecol 101 (1994), pp. 908–909.
40. P.L. Oei, S. Chua, L. Tan, S.S. Ratnam and S. Arulkumaran, Arterial embolization for bleeding following hysterectomy for intractable postpartum hemorrhage, Int J Gynecol Obstet 62 (1998), pp. 83–86.
41. K. Ojala, J. Perala, J. Kariniemi, P. Ranta, T. Raudaskoski and A. Tekay, Arterial embolization and prophylactic catheterization for the treatment for severe obstetric hemorrhage, Acta Obstet Gynecol Scand 84 (2005), pp. 1075–1080.
42. E. Soncini, A.Pelicelli, P.Larini, C.Marcato, D.Monaco and A.Grignaffini. Uterine artery embolization in the treatment and prevention of postpartum hemorrhage. International Journal of Gynecology & Obstetrics Volume 96, Issue 3, March 2007, Pages 181-185
43. G. Porcu, V. Roger and A. Jacquier et al., Uterus and bladder necrosis after uterine artery embolization for postpartum hemorrhage, BJOG 112 (2005), pp. 122–123.
44. Y. Nakao, M. Yokoyama and T. Iwasaka, Uterine artery embolization followed by dilation and curettage for cervical pregnancy, Obstet Gynecol 111 (2008), pp. 505–507.
45. J.J. Trambert, M.H. Einstein, E. Banks, A. Frost and G.L. Goldberg, Uterine artery embolization in the management of vaginal bleeding from cervical pregnancy: a case series, J Reprod Med 50 (2005), pp. 844–850.
46. S.M. Weeks, T.H. Stroud, J. Sandhu, M.A. Mauro and P.F. Jaques, Temporary balloon occlusion of the internal iliac arteries for control of hemorrhage during cesarean hysterectomy in a patient with placenta previa and placenta increta, J Vasc Interv Radiol 11 (2000), pp. 622–624.
47. C.H. Tan, K.H. Tay and K. Sheah et al., Perioperative endovascular internal iliac artery occlusion balloon placement in management of placenta accreta, AJR Am J Roentgenol 189 (2007), pp. 1158–1163.
48. Miller DA, Chollet JA, Goodwin TM. Clinical risk factors for placenta previa-placenta accreta. Am J Obstet Gynecol. 1997 Jul;177(1):210-4.
49. Burchell, R. J ObsGynBr Cmnwlth Physiology of internal iliac artery ligation 1968; Jun 75(6): 642-648
50. Lang EK.Transcatheter embolization of pelvic vessels for control of intractable hemorrhage. Radiology. 1981 Aug;140(2):331-9.
51. H A Kelly Ligation of both Internal Iliac Arteries for Hæmorrhage in Hysterectomy for Carcinoma Uteri Journal: Annals of Surgery - ANN SURG , vol. 20, 5:53–54.1894
52. Clark SL, Phelan JP, Yeh SY, Bruce SR, Paul RH. Hypogastric artery ligation for obstetric hemorrhage. Obstet Gynecol. 1985 Sep;66(3):353-6.
53. Joshi VM, Otiv SR, Majumder R, Nikam YA, Shrivastava M. Internal iliac artery ligation for arresting postpartum haemorrhage. BJOG. 2007 Mar;114(3):356-61. Epub 2007 Jan 22.
54. Miller FJ Jr, Mortel R, Mann WJ, Jahshan AE.Selective arterial embolization for control of hemorrhage in pelvic malignancy: femoral and brachial catheter approaches. AJR Am J Roentgenol. 1976 May;126(5):1028-32.
55. Ring EJ, Athanasoulis C, Waltman AC, Margolies MN, Baum S. Arteriographic management of hemorrhage following pelvic fracture. Radiology. 1973 Oct;109(1):65-70.
| 


