全世界范围内产后出血(Postpartum hemorrhage,PPH) 是怀孕相关死亡的首要原因之一。
有7种方法干预产后出血,包括宫缩剂、止血剂、子宫按摩或宫腔填塞、血管结扎、子宫切除、子宫捆扎和介入栓塞的方法。
但最好的治疗都归结于预防,预防治疗也是最好的干预。但大多数PPH情况是可以通过产科医生积极努力得到预防的。包括在宫缩剂的配合下积极处理第三产程,等待胎盘的时候控制牵引脐带以及子宫按摩等。产科医生、护士、助产士和其它参与者应该充分了解PPH的危险因素,在此类并发症处理策略和防止措施进行充分的培训。但仍有一定比例的产妇,应用这些技术的情况下发生产后大出血。
PPH的处理是一个多学科协作的参与过程,包括积极的血液和液体输注维持血容量,宫腔球囊填塞(Bakri balloon ),挤压缝合。(compression sutures)和动脉结扎。
药物治疗
产后大出血的主要原因主要是有1个或多个因素构成:宫缩乏力;胎盘、羊膜或血凝块滞留;生殖道损伤;或凝血功能障碍;防止产后大出血依赖于“积极的干预(active management),在第三产程给予预防性促宫缩药物(最常用麦角新碱和催产素)、早期脐带钳夹、脐带控制性牵引。这些方法已经显示可以减少产后出血和产后大出血、产后贫血、输血、第三产程延长和产后出血和其它药物的使用[1]。
尽管采用积极干预的方法是产后出血减少,仍然有1%~5%的分娩并发出血量大于1000毫升的产后大出血[2]。治疗的措施主要决定于病因,像宫缩乏力这种最为常见的病因,药物治疗通常会包括催产素10单位静脉缓慢注射,麦角新碱0.5mg静脉缓慢注射,甲基麦角新碱0.2mg肌肉注射,稀释催产素静脉输注,15-methyl PGF2[alpha]肌肉注射或子宫肌层注射,20mg前列腺素E2经直肠或阴道或米索前列醇1000ug经直肠注射[3,4]。但是没有很好证据当这些治疗失败后,我们还可以做什么。
宫纱填塞和子宫球囊填塞
2006年美国妇产科医师学会在其发表的的临床公告中提示子宫填塞是减少宫缩乏力导致产后出血的有效措施,另外子宫动脉结扎或B-Lynch suture 可以用于避免子宫切除。生命体征稳定和持续出血的病人可以使用于动脉栓塞,特别是失血速度不过度的患者。此外,如果需要对子宫收缩乏力的患者进行子宫切除,首先应试图采用其它治疗方法[5]。
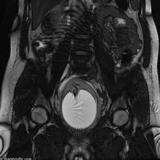
球囊压迫子宫MRI成像
上图是一张有关宫内球囊填塞治疗产后大出血的MRI图示。和子宫压迫缝合一样,子宫腔内的球囊填塞比较过去盆腔血管结扎和子宫切除,正在变成越来越有价值的选择[9,10,11]。Dabelea V 等人对药物治疗无效的23例产后大出血患者实施宫腔内球囊填塞治疗。如果球囊位置合适,这种方法控制大出血90%的病例(18/20)。在他的病例中尽管导管成功的释放,仍有2例需要进行子宫切除。由于宫缩乏力的患者出血此种方法成功率100%(11/11)。胎盘滞留出血的成功率为80%(4/5)。三例技术失败。结果表明球囊宫腔内填塞是安全的,有效的,特别是宫缩乏力引起的产后大出血[6]。最常见使用的球囊导管是Sengstaken–Blakemore 压迫食道静脉曲张出血的导管。除了止血效果,它还允许产科医生有时间决定哪个病人需要外科手术。这中方法的其它优点包括在低度麻醉下实施,即使是经验不足的医生也可以快速容易的进行,无痛苦撤除和快速发现失败的情形。
子宫阴道宫纱填塞在60年代前是经常使用的方法,以后使用的频率下降主要因为担心感染和隐匿性出血[7]。虽然零星的报告显示了其成功率。这种方法主要应用于宫缩乏力,胎盘前置和胎盘植入。而宫缩乏力对药物治疗无效的患者是最常见适应症[8]。子宫阴道宫纱填塞也为病人稳定为外科手术治疗争取时间。在某些情况下子宫阴道宫纱填塞本身获得止血成功,从而避免外科手术。
子宫阴道宫纱填塞最重要的优点是可以简单快速的进行而不需要特殊的设备。密实一致地填塞宫腔所有的角落还必需延伸到阴道口,以便维护宫腔静脉窦填塞效果和防止隐匿出血。其它治疗还包括双手按摩、压迫子宫等。
PPH的一线治疗包括保守的方法,例如裂伤修复、子宫填塞、纠正凝血功能以及使用宫缩剂。当这些治疗失败后,医务工作者往往尝试结扎子宫的供血动脉或者子宫切除术,这也意味着患者生育功能的丧失。
髂内动脉结扎
髂内动脉结扎曾经作为控制盆腔出血的方法被推广使用。这种治疗方法起源于1964年,Burchell建议使用结扎降低动脉压,将盆腔动脉循环转换到静脉系统并通过血凝块形成创造更有利于止血的环境。Burchell报道了在13名女性病人中行双侧髂内动脉结扎可以降低盆腔血流49%,而结扎处远端的血压降低85%。这种技术的成功率非常不一致,从40%到100%。一种解释低成功率的假说认为结扎后髂内动脉远端的血流迅速恢复,这可以用血管造影来证实[12,13]。
另外,髂内动脉结扎在控制由于子宫弛缓造成的出血方面效果较差。Clark[12]等于1985年研究了19名由于子宫弛缓、胎盘植入和撕裂而产科出血的病人。使用髂内动脉结扎的成功率为40%,而对于所有其它原因的PPH的病人为50%。与之相似的是1990年,Chattopadhyay等报道在子宫弛缓的病人中髂内动脉结扎的成功率为50%,而其它原因的是73%。没有理论能够解释这两组作者的发现。
Clark等和Chattopadhyay 等认为髂内动脉结扎在成功的情况下较急诊子宫切除术具有更少的失血、手术时间和手术并发症。Clark等称髂内动脉结扎仅在42%的病例中成功;而其他58%的病人需要子宫切除术。对于动脉结扎后再进行子宫切除术的病人,失血、手术时间和手术中并发症,比不经过先前结扎而直接进行子宫切除术的情况都应有所增加。作者强调由于动脉结扎而增加的失血和手术时间并不全都在动脉结扎中浪费。对很多女性来说这是第一次妊娠,对于她们动脉结扎是子宫切除术前的必要尝试。因为增加的失血和手术时间可能使病人有机会保留生育能力(即,万一髂内动脉结扎成功的话。然而,在急诊情况下不直接进行子宫切除术而是进行髂内动脉结扎的尝试的做法是有争议的。
髂内动脉结扎有很多明显的缺点[14~17]。它比子宫动脉栓塞承受着更大的技术挑战和风险。首先它需要开腹,承担由此引发的各种外科手术并发症。而且此手术由于包括进入腹膜后间隙而成为一项技术难度较大的手术。对于髂部血管和子宫关系的正确认识是极其重要的。复杂的关系可能会使术后并发组织水肿和血肿。另外,髂内动脉结扎排除了其它控制出血的措施,例如子宫动脉栓塞。换句话说,如果髂内动脉结扎失败,虽然有报告可以再行子宫动脉栓塞,但很多病人就不得不行子宫切除术,因此将失去生育能力。最后,正如以前提到的,髂内动脉结扎在治疗子宫弛缓方面作用很有限,而这时PPH的最常见的原因。另外并发症发生率大约为13%,高于其他控制出血的方法。并发症可能包括伤口感染,输尿管损伤,下肢麻木,和死亡。由于这些原因,髂内动脉结扎已经不常被使用。
子宫动脉结扎
双侧子宫动脉结扎曾被作为一种可以保留生育功能的控制出血的方法来研究。这在逻辑上是髂内动脉结扎的下一步,前提是子宫血供大约90%都来自于子宫动脉。在这个手术中,子宫动脉升支通过剖腹手术结扎。此手术首先在1952年被文献报道,据记载成功率为80%到90%,并且并发症相对较少。
1955年,O’Leary报道了265个有剖腹产后出血的病人进行了子宫动脉和静脉升支结扎。数据是在1962到1992年间收集的。报道的成功率有95%,仅有两种轻微并发症。直接比较此研究和更近的系列研究由于两种外科手术研究的条件虽时间变化发生了改变而在一定程度上受到了限制。特别是,在O’Leary的研究中,124例1972年以前进行的手术中有24例的目的是教育住院医和为所有工作人员增加进行此手术的经验。另外很多控制出血的现代药理学方法在1960和1970年代都没被使用。因此,很多在1960年被认为可以进行手术的病人在今天可能太严重而不符合进行手术的标准。
尽管有这些差异,O’Leary的研究在AbdRabbo[18]的更晚的实验中得到了证实。他报道了103个进行子宫动脉结扎的病人。这种方案称为子宫动脉连续结扎,然后进行对侧子宫动脉结扎。随后,如果病人病情不稳定可以进行低位子宫动脉和低位卵巢动脉结扎。尽管单独进行单侧或双侧子宫动脉结扎仅有83%成功,整体方案在控制出血方面有100%的成功率。另外,没有发生严重并发症。可以作为子宫动脉手术和子宫切除术以外的一种选择,特别是在没有介入栓塞的血管造影设备的小医院。
此技术相比髂内动脉结扎有了很多进步:(i)由于不需要分离后腹膜,它在技术上更容易操作;(ii)子宫动脉结扎的闭锁更持久,因此降低了侧支的影响和再出血的可能性;(iii)对其它盆前结构的损伤降低。
尽管如此,子宫动脉结扎也是一项费时和困难的手术,因此经验丰富的产科医生以及生命体征稳定的患者是此项手术的首要条件。当动脉结扎治疗失败时,子宫切除通常是必要的。
子宫缝合术(uterine compression sutures)
Uterine compression sutures,直接翻译应译成子宫压迫缝合术,又有英文称为B lynch缝合或改良式B lynch缝合。如果患者稳定可以采用双手按压子宫可以成功的使子宫止血,再进行子宫子宫压迫缝合术是有效的。对早前B-Lynch 缝合技术的各种改良的方法有很多的报告[19~21]。这种技术容易实施和保留生育功能是其主要的优点[22]。明显的缺点是需要开腹和可能发生的手术并发症。在安全性和有效性的方面经验有限[23]。
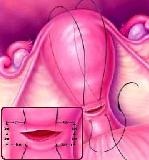 子宫加压缝合示意图
子宫加压缝合示意图
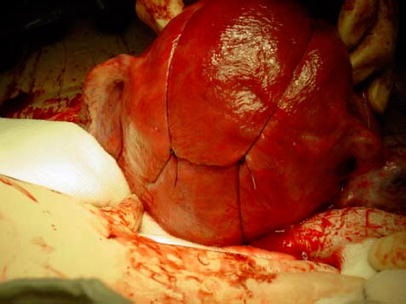 子宫加压缝合
子宫加压缝合
以上所谓的保留子宫的治疗在2007年发表的一项涉及300多篇文献的荟萃分析指出其效果是有限的,而且子宫缝合和动脉结扎需要开腹手术,危险相对高和住院时间长,甚至也不能成功地控制产后出血,子宫切除仍然是最后的选择[28]。
子宫全切或次全切除术(Cesarean Hysterectomy)
Clark et[24] 分析70例PPH急诊性子宫切除术,60例为剖腹产后,10例为阴道产后。子宫切除的适应症:宫缩乏力(43%),胎盘滞留(30%)[29],子宫破裂(13%),低横切口延长(10%),防止子宫粘连和出血的子宫肌瘤(4%)。宫缩乏力进行子宫切除和羊膜炎、剖腹产、催产素、硫酸镁、和胎儿过重相关。由于怀孕后子宫和其支持组织在血管和解剖的变化,子宫切除术有相对手术风险和并发症[25]。特别是导致病人失去再生育的能力[26]。从20世纪后半期急症子宫切除术适应症的变化可以看出,胎盘的异常越来越多地成为主要的适应症。
进行中的剖宫产
产后大出血必需遵循多学科处理的原则,以便首先评估最初病情的严重性,维持生命体征的稳定,确定出血原因。球囊填塞治疗产后大出血的成功率84.0%;动脉栓塞成功率90.7%;加压缝合的成功率91.7%;子宫动脉或髂内动脉结扎84.6% 不同措施之间成功率没有统计学差异[27]。
在过去的三十多年中,出现了血管栓塞治疗PPH的方法。如今对于PPH的病人,使用血管造影进行评价和栓塞的方法已经建立,并且被证明是安全有效的。除了其成功率高以外,血管栓塞的最大优点是有可能病人能够保留生育力。
子宫动脉栓塞技术可以改善PPH的预后。减少PPH的发生率和死亡率是介入放射科医生和产科医生的重要目标。 各种原因导致的产科出血的血管栓塞应用的基本原理和介入技术是相同的。但是根据临床情况的不同所使用的方法也不尽相同。因此,PPH、胎盘异位、异位妊娠、AVM和妊娠滋养细胞疾病的治疗只有一些技术上的共性,在临床治疗策略中需要区别对待。
对于产后出血高危患者,特别是如何处理胎盘异常(placenta abnormalities)病人,目前还没有一个理想的方法。有关争论的方法包括:
(1)剖宫产子宫切除(Cesarean Hysterectomy)[29]
(2)保守治疗,胎盘留置原位[30]
(3)子宫动脉栓塞
(4)球囊辅助阻塞:该方法文献资料有限,多是病例报告,或小样本的研究。没有随机实验的报告或临床试验。而且技术方法不同,没有标准的方法。
1. Prendiville WJ, Elbourne D, McDonald S. Active versus expectant management in the third stage of labour. Cochrane Database Syst Rev 2000:CD000007.
2. Mousa HA, Walkinshaw S. Major postpartum haemorrhage. Curr Opin Obstet Gynecol 2001;13:595–603.
3. The management of postpartum haemorrhage. In: Scottish Obstetric Guidelines and Audit Project. Aberdeen, Scotland: SPCERH, 1998.
4. American College of Obstetricians and Gynecologists. ACOG Practice Bulletin: Clinical Management Guidelines for Obstetrician-
Gynecologists Number 76, October 2006: postpartum hemorrhage. Obstet Gynecol 2006;108:1039–1047.
5. American College of Obstetricians and Gynecologists. ACOG Practice Bulletin: Clinical Management Guidelines for Obstetrician-Gynecologists Number 76, October 2006: postpartum hemorrhage. Obstet Gynecol 2006;108:1039–1047.
6. Dabelea V, Schultze PM, McDuffie RS Jr. Intrauterine balloon tamponade in the management of postpartum hemorrhage. Am J Perinatol. 2007 Jun;24(6):359-64.
7. Pritchard JA, MacDonald PC, Gant NF. , editors. Williams' obstetrics. 17th ed. Norwalk, CT: Appleton-Century-Crofts; 1985. Abnormalities of the third stage of labor; pp. 707–718.
8. Hsu S, Rodgers B, Lele A, Yeh J. Use of packing in obstetric hemorrhage of uterine origin. J Reprod Med. 2003;48:69–71.
9. Ramanathan G, Arulkumaran S. Postpartum hemorrhage. J Obstet Gynaecol Can. 2006 Nov;28(11):967-73.
10. Katesmark M, Brown R, Raju KS. Successful use of a Sengstaken-Blakemore tube to control massive postpartum hemorrhage. Br J Obstet Gynaecol. 1994;101:259–260.
11. Seror J, Allouche C, Elhaik S. Use of Sengstaken-Blakemore tube in massive postpartum hemorrhage: a series of 17 cases. Acta Obstet Gynecol Scand. 2005 Jul;84(7):660-4.
12. Clark SL, Phelan JP, Yeh SY, et al. Hypogastric artery ligation for obstetric hemorrhage. Obstet Gynecol 1985;66:353-6
13. Evans S, McShane P. The efficacy of internal iliac artery ligation in obstetric hemorrhage. Surg Gynecol Obstet 1985;160:250-3
14. S.L. Clarks, Hypogastric artery ligation for obstetric hemorrhage. Obstet Gynecol 66 (1985), pp. 353–355
15. B.N. Das and A.K. Biswwas, Ligation of internal iliac arteries in pelvic hemorrhage. J Obstet Gynecol Res 24 (1998), pp. 251–254
16. J. Salvat, M.H. Schmidt, M. Guilbert and A. Martino, Vascular ligation for severe obstetric hemorrhage: review of the literature. J Gynecol Obstet Biol Reprod 31 (2002), pp. 629–639
17. C.D. Collins and J.E. Jackson, Pelvic arterial embolization following hysterectomy and bilateral internal iliac artery ligation for intractable primary post partum haemorrhage. Clin Radiol 50 (1995), pp. 710–714
18. S.A. AbdRabbo, Stepwise uterine devascularization: a novel technique for management of uncontrolled postpartum haemorrhage with preservation of the uterus. Am J Obstet Gynecol 171 (1994), pp. 694–700.
19. Cho JH, Jun HS, Lee CN. Hemostatic suturing technique for uterine bleeding during cesarean delivery. Obstet Gynecol 2000;96:129–131.
20. Nelson GS, Birch C. Compression sutures for uterine atony and hemorrhage following cesarean delivery. Int J Gynecol Obstet 2006;92:248–250.
21. Pereira A, Nunes F, Pedroso S, et al. Compressive uterine sutures to treat postpartum bleeding secondary to uterine atony. Obstet Gynecol 2005;106:569–572.
22. Dildy GA 3rd. Postpartum hemorrhage: new management options. Clin Obstet Gynecol 2002;45:330-344.
23. 6. B-Lynch C, Coker A, Lawal AH, et al. The B-Lynch surgical technique for the control of massive postpartum haemorrhage: an alternative to hysterectomy? Five cases reported. Br J Obstet Gynaecol 1997;104:372-5.
24. Clark SL, Yeh SY, Phelan JP, et al. Emergency hysterectomy for obstetric hemorrhage. Obstet Gynecol. 1984; 64:376–380.
25. Zelop CM, Harlow BL, Frigoletto FD Jr, et al. Emergency peripartum hysterectomy. Am J Obstet Gynecol 1993;168:1443-8.
26. Yamashita Y, Harada M, Yamamoto H, et al. Transcatheter arterial embolization of obstetric and gynaecological bleeding: efficacy and clinical outcome. Br J Radiol 1994;67:530-4.
27. Doumouchtsis, Stergios K. MD, PhD et al.Systematic Review of Conservative Management of Postpartum Hemorrhage: What to Do When Medical Treatment Fails. Obstetrial Gynecological Survey. Volume 62(8), August 2007, pp 540-547
28. S.K. Doumouchtsis, A.T. Papageorghiou and S. Arulkumaran, Systematic review of conservative management of postpartum hemorrhage: what to do when medical treatment fails, Obstet Gynecol Surv 62 (2007), pp. 540–547.
29. Oyelese Y et al. Obstet Gynecol 2006;107:927-41
30. Kayem G et al. Obstet Gynecol 2004;104(3):531-6
| 



