选择性支气管动脉造影
在选择性支气管动脉造影之前可以考虑进行主动脉造影。特别是如果事先没有进行支气管动脉的CTA检查,可在选择性插管前先行降主动脉造影可提供路径图。
降主动脉造影,左前斜位(猪尾巴导管)证实支气管动脉开口位于主动脉弓下缘
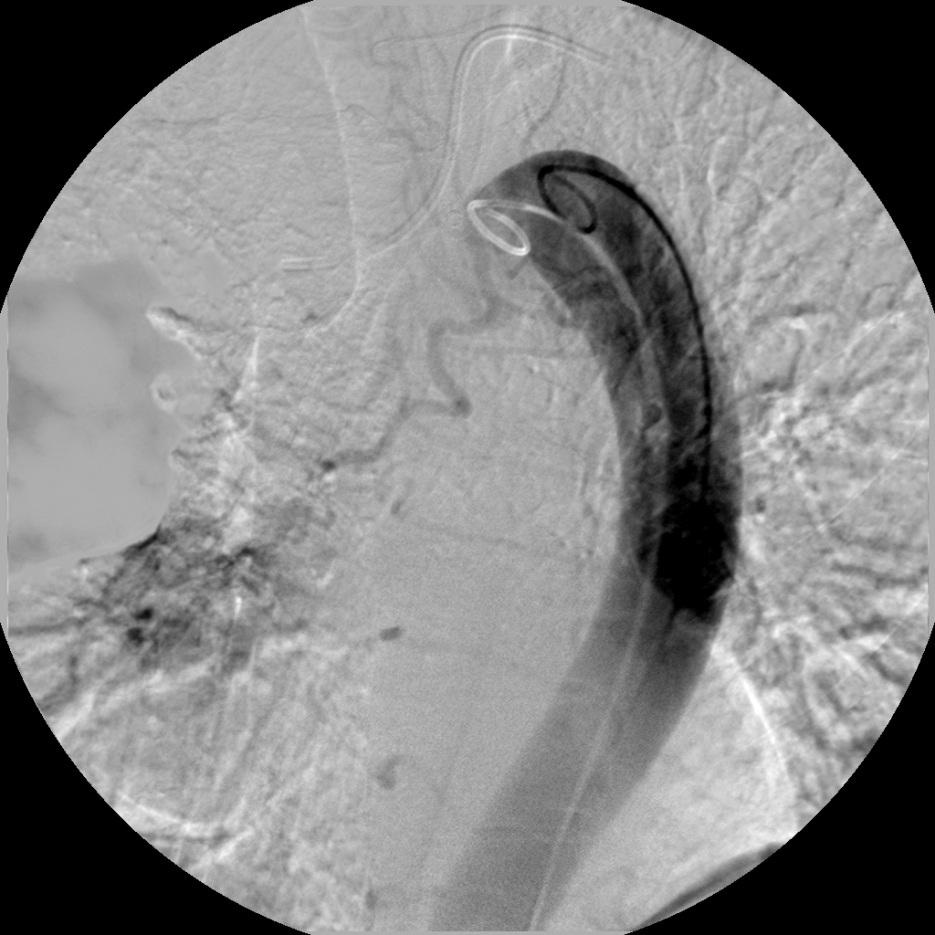 |
|
造影剂总量30ml,15ml/秒注射 |
血管造影前的胸部放射线和支气管镜检查能帮助对出血部位进行定位。然而,大块咯血的患者并不都能接受支气管镜检查。所以通常选择性支气管动脉造影成为大咯血诊断和定位的主要手段。但多排CT的进展使支气管动脉大咯血的定位诊断成为最新的选择。建议条件许可的情况下,在进行选择性支气管动脉造影之前进行支气管动脉的CTA,可以提高选择性支气管动脉的效率减少盲目性。
支气管动脉栓塞术应该在条件良好的血管造影室,由经验丰富的,熟悉栓塞技术的介入放射科医生进行。栓塞操作期间,数字减影设备应具有快速采集和良好对比度以及快速影像回放功能。支气管动脉造影通常使用5F导管进行BAE,虽然最常使用Cobra导管,其适合多数情况下支气管动脉解剖变化,但如牧羊钩形(Shepherd’s hook)、猎人头(Headhunter)Mikaelsson或Yashiro(侧面螺旋形导管),Simmons, Sidewinder和 Sos-Omni 导管在特殊的情况下也被使用。共轴微导管用于超选择情况,特别是常规导管不能达到安全的导管位置时。这一点非常重要,特别是支气管分支来自肋间支气管干(ICBT)时,需要避免肋间支阻塞,有时候这一动脉发出脊髓前动脉【1,2】。
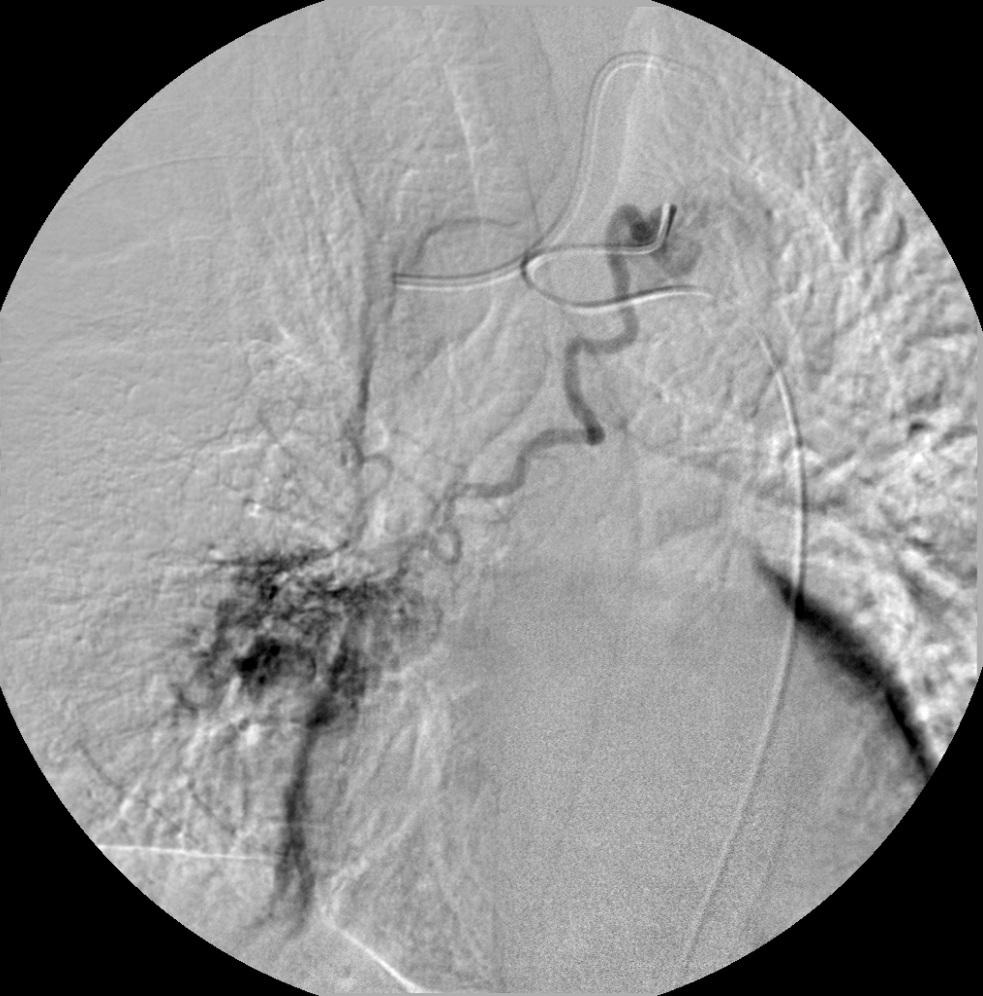 |
|
血管造影发现:1. 增粗和迂曲的支气管动脉 2. 多血管和新生血管区域 |
通常情况下选择性支气管动脉造影发现:
1. 支气管动脉增粗和迂曲
2. 多血管和新生血管区域
3. 分流的血液进入到肺动脉或静脉
4. 支气管动脉瘤
5. 造影剂外溢
支气管动脉的起源变异很大。它们从主动脉弓发出的位置可在从第三到第八胸椎的水平变化,大约一半血管在T6对面,三分之一在T5对面。通常支气管动脉在左主支气管水平发出。
82.7%病例支气管动脉的解剖表明:
1型,左边发出两根,右边一根(40.6%);
2型,左右各一根(21.3%);
3型,左右各两根(20.7%)。
肋间支气管干几乎固定的给右上叶供血。该血管是需要被栓塞的最为重要的支气管动脉,因为它较大且与肋间动脉和根动脉相连。支气管动脉的异常起源主要指起源于主动脉弓、乳内动脉、锁骨下动脉、无名动脉、心包膈动脉和腹腔干。
对具有慢性炎性疾病和胸膜受累的患者,如进展性结核和曲霉菌球,肋间动脉穿过胸膜的侧支循环,锁骨下动脉和腋动脉的分支都可能成为咯血的来源。导管尖端固定不好或导管的锲入可能引起远端意外的栓塞或脊髓缺血。脊髓背部中央区(T3-T7水平)通常接受一根根动脉的供血,该动脉与T4或T5神经根伴行,但是脊髓前部在此范围内供血可能不连续。所以,此区域内的侧支循环较少,这使得该区的脊髓最容易受到缺血损伤。通常髓动脉起源于肋间动脉;然而,有5%的患者髓动脉可能起源于右肋间支气管干或支气管动脉。造影时可能看不到起源于右肋间支气管干的脊前动脉,可能是由于其管径较小或主要流向低阻的支气管肺分流。如果血管造影时看到了脊动脉,导管应该进入其起源的远端以避免脊髓缺血。
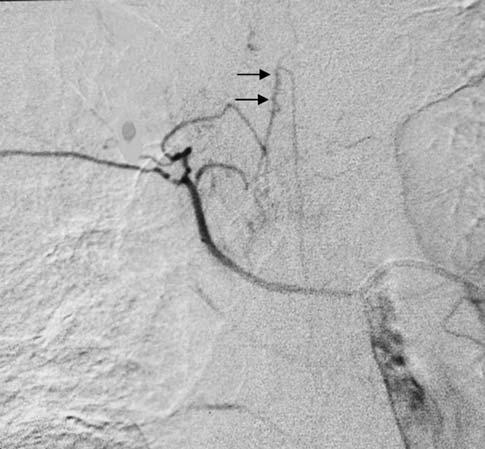 |
|
Identification of anterior medullary artery。common origin with intercostal arteries;hairpin loop
|
Chun et al. CardiovascIntervent Radiol33 (2010)
在血管造影和栓塞进行前应进行简单的神经系统查体。在整个操作过程中也常重复查体以了解病人的神经系统状态,尤其是下肢的感觉和肌力的改变。一些作者建议在栓塞过程中使用体感诱发电位以了解脊髓缺血性改变。但该方法太过麻烦,也不是操作常规,故基本上不必要。
如果事先没有进行支气管动脉的CTA检查,可在选择性插管前先行降主动脉造影可提供路径图。若为首次咯血,受累的支气管动脉常常增粗,插管常较顺利。在此情况下,可不先进行常规的胸主动脉造影,可先直接行支气管动脉的亚选择性插管。但若此时支气管动脉插管不成功,可替换为猪尾巴管行降主动脉造影,以证实支气管解剖和其它来自体循环的侧支。大多数异常的,粗大的支气管动脉可以在行降主动脉造影时看见【1-3】。
动脉造影通常经股动脉穿刺,偶也需经腋动脉或上臂动脉定位或栓塞锁骨下动脉的分支。一般习惯使用5或6French的血管鞘。如病人肥胖或髂动脉迂曲,常使用更长的可延伸至主动脉的血管鞘。亚选择性插管可用一系列不同的选择性导管弯。开始时用反弯导管,如Mikaelsson,Simmons I或牧羊钩。反弯导管的尖部常会部分位于横着的主动脉弓内,使导管倾斜,对更近端起源的支气管动脉插管较困难。在这种情况下,使用前视导管如眼镜蛇,H1H或RC形往往可成功或者一开始就使用眼镜蛇导管,作者长期使用眼镜蛇III型导管,屡试屡爽。通常开始时使用5.0或5.5French的导管,而将更大的6.5-7.0French的导管留用于特别迂曲的脉管系统,因该情况下需要更好的操纵性。
从T5-T6水平开始寻找支气管动脉。充气的左主支气管可方便地在荧光屏上定位支气管动脉通常的起源处。在寻找右支气管或右肋间支气管干时,导管尖开始应指向侧壁或前侧壁。左支气管动脉插管时应指向左侧或左前侧方向,老年患者由于主动脉旋转的原因,左主支气管动脉更倾向于开口在主动脉前壁。应避免导管过粗完全堵塞支气管动脉,尤其是右肋间支气管干,因为若有脊髓动脉分支存在时会造成脊髓缺血,必要时使用微导管系统,或者一旦发现支气管动脉开口,直接使用共轴导管方式,进入微导管。
Superselective catheterization with coaxial microcatheters for safe catheter position
栓塞前必须行选择性血管造影。可以用手推注射非离子造影剂。注射的速率和容量取决于支气管动脉的大小,并且与影像采集一致。支气管动脉有特征性的分支沿主支气管干到达肺门,这点很容易和肋间动脉相鉴别,后者开始时向头部走行,随即沿肋骨下缘走行。支气管动脉注射时可诱发咳嗽,而单纯肋间动脉注射时会很疼但不会引起咳嗽。所有注射时应使用非离子造影剂,这样可减轻咳嗽反应和减少横断性脊髓炎的风险。
若存在不能超越的脊髓动脉开口,一般就是栓塞禁忌症。因为微导管释放栓塞材料需要超过脊髓动脉开口。
presence of spinal arteries: contraindication to embolizationmicrocatheter; delivery of embolic agent beyond the origin of spinal artery
行亚选择性注射时可用标准数字减影血管造影。注射的剂量和速率必须足够显示可能存在的任一脊髓动脉分支。脊髓动脉有特征性的头向走行伴椎管内中线处的发夹弯结构,可资鉴别。若在前后位对中线分支有疑问,可采取斜位以明确该分支是否进入椎管。气管和食管的分支也来支气管动脉,在前后位上可能显示位于中线处,但不会形成特征的发夹环结构。在慢性炎症的情况下, 通常可靠的咯血血管造影征象是高流速和增粗迂曲的支气管动脉。其它征象包括多血管或/和新生血管、支气管动脉-肺动脉(B-P分流)或支气管动脉-肺静脉分流或支气管动脉瘤。造影剂外溢至支气管很少见,其发生率在3.6%~10.7%之间【4,5】。重要的是在大多数情况下大咯血来源于支气管动脉循环,但出血也可以来源于非支气管动脉和肺动脉循环【2】。
血管造影发现:
1. 增粗和迂曲的支气管动脉(hypertrophic& tortuousbronchial arteries )
2. 多血管和新生血管区域(areas of hypervascularity& neovascularity)
3. 血液分流到肺动脉和肺静脉(shunting of blood into pulmonary artery or vein)
4. 支气管动脉瘤(bronchial arteryaneurysm)
5. 造影剂外溢(extravasationofcontrastmedium ,uncommon)
正常的支气管动脉也能成为出血的来源。当未发现异常支气管动脉时,须行主动脉弓造影和选择性锁骨下动脉造影以寻找异位的支气管动脉或/及非支气管系统动脉血供。对于以前行过支气管动脉栓塞尤其是弹簧圈阻断但反复咯血的患者,寻找非支气管系统动脉血供是非常重要的。导致反复咯血的血管可能有以前未栓塞的支气管动脉(异常型或正常型),再通的支气管动脉,或非支气管系统侧枝血管。若存在肺下叶疾病,还应行腹主动脉和膈下动脉造影。若未发现系统动脉(支气管动脉或非支气管动脉)血供,应行选择性肺动脉造影已明确肺动脉来源,如假性动脉瘤或动静脉瘘。
如果没有其它禁忌征,仅仅观察到支气管动脉的肥大,是否足以成为进行栓塞术的证据,答案是肯定的。
两种来源于支气管动脉系统的其它出血原因包括支气管动静脉畸形和Rasmussen动脉瘤,是两种很不常见支气管动脉系统出血原因。Rasmussen氏动脉瘤由外周肺动脉在结核性空洞内形成的假性动脉瘤,可以成为出血的来源,尤其对支气管动脉和支气管-体循环侧支动脉栓塞止血失败的患者。
选择性支气管动脉栓塞
支气管动脉栓塞的目的是通过阻塞来自体循环的动脉血流,减少肺部疾患病变血管的灌注压。重要的是栓塞的部位尽可能接近异常支气管动脉和肺动脉吻合位置,以防止来自于非支气管体循环动脉侧支形成导致咯血复发。
从这一点讲,仅仅在支气管动脉开口栓塞钢丝弹簧栓子是应该尽量避免的。对于以前使用弹簧栓子栓塞支气管动脉主干的病人,再出血时需特别注意侧支循环开放。临床颇具挑战性的情况是出血部位的确定究竟有多大的可靠性。
应尽可能地栓塞任何供应出血部位的异常的支气管动脉。主要供血血管在所有病例中都应栓塞。重要的是应认识到为达到临床上的良好疗效并非需要栓塞所有看上去异常的血管。但若主要供血血管未处理,将来复发的出血更可能发生或发生更早。发出脊髓动脉血供的支气管动脉的栓塞仍存争议,其施行取决于操作者的经验和栓塞的风险-获益比(即病人的临床状况)。
Boushy等人对狗行支气管动脉内栓塞后发现用小微粒(29-100um)时造成后肢麻痹,而用较大颗粒(200um)时则只有一过性无力。这提示大于200-250um的颗粒难以进入供应脊髓的血管,故可用于栓塞。当然,导管位置在脊髓动脉发出部位的远端更好,这用现代的共轴导管系统(微导管)常可以实现。偶尔,当栓塞开始后血管床阻力不断增加,较小的近端分支变得较清楚时,有部分远端栓塞后才发现脊髓动脉分支。一些作者建议在支气管动脉栓塞前使用巴比妥作诱发试验以寻找隐性脊髓动脉。当向有脊髓血供的血管床注射短效的巴比妥,异戊巴比妥时可暂时产生脊髓缺血的症状。也可使用利多卡因,方法类似。注射以上两种物质之一后,需反复的体格检查评价下肢的肌力。若无神经系统的改变,则可更放心地说明没有重要的到脊髓的动脉血供。该操作相关的横贯性脊髓炎更多的是由于离子造影剂的使用造成的。故应常规使用非离子造影剂。
经导管栓塞要求稳定的导管位置。使用反袢导管时,从腹股沟穿刺部位向后轻轻撤出导管时其尖端常可进得更深。由于栓塞所使用的特殊材料需要活跃的血流将其推进到血管床的远端,故应避免导管嵌压造成的血流阻断。在导管完全嵌顿支气管动脉的情况下强力注射栓子可能造成远端支气管动脉破裂,尽管并不是每次都会造成出血。
用于栓塞的标准插管采用5.0French的的导管。当采用这些导管不能达到稳定的导管位置时,应行共轴微导管插管。许多共轴微导管系统,此类微导管可方便地从先前诊断导管推出,并操作至更远端的支气管动脉。常规的共轴插管可能需要双重加压的冲洗系统(腹股沟鞘与外层导管之间及外层导管与内层导管之间)。对于困难的或需时较长的病例,在内层导管和微导管间还需一冲洗系统。微导管必须在支气管动脉起源处远端至少1-2cm以上,以保证其在任何前根髓动脉分支的远端,因在最初的血管造影时有些分支可能未发现。若存在肋间支气管干,微导管应在肋间动脉或任何供应脊髓前动脉的血管起源处的远端。Tanaka等人证实了使用微导管行超选择性插管的价值。他们发现超选择插管技术相对于选择性插管技术出血的控制得到改善。本站也倾向于通过微导管使用更小的颗粒栓塞(但直径大于300um)。这也可能对结果的改善有帮助。
应尽可能行远端栓塞。如单独行永久的近端栓塞,将会产生各异的远端的侧枝血管,而将来进入主支气管动脉的途径将会丢失。最常用于支气管动脉栓塞的材料包括明胶海绵和聚乙烯醇颗粒。应避免使用如乙醇等液体或细小颗粒(明胶海绵碎片),因为其会产生毛细血管床高度的远端阻塞,可能会导致组织梗死。尽管氰基丙烯酸酯组织胶(histoacryl:n-丁酯-2-氰丙烯酸盐和bucrylate:异丁基-2-氰丙烯酸盐)已有成功使用的例子【6】,但因其太过麻烦,需要操作人员很丰富的经验,故不推荐。另外,氰基丙烯酸酯还会导致血管的永久的阻塞,妨碍将来用该血管行再次栓塞。
明胶海绵容易获得,吸收缓慢,可单独用作填絮,鱼雷,或作为填充剂的组成部分。可用0.5-2.0mm3的颗粒行最初的远端阻断,然后用3-4mm3的填絮或鱼雷作更近端的阻塞。可用1-3mL的注射器将明胶海绵填絮与稀释的造影剂混合。因为明胶海绵漂浮在对比剂盐水溶液中,故注射器尖应指向上。明胶海绵理论上的缺点是其可被吸收,可能会导致更快的血管再通和出血复发[35,66]。明胶海绵填充剂混合物由明胶海绵刨片、50%葡萄糖、碘苯酯、ε-氨基己酸组成,使用这种混合物可产生更持久的阻塞。该混合物可经标准导管或共轴导管由3mL或1mL的注射器滴入少量(0.25-0.5mL)。
栓塞材料
|
作者 |
病例数 |
栓塞材料 |
立即止血 |
长期复发 |
|
Kalva et al, 2009
|
50 |
PVA,Gelfoam |
75% |
50% |
|
Sung et al, 1992
|
106 |
Gelfoam
Ivalon |
85.2%
87.6% |
|
|
Kim et al, 1988
|
31 |
Various |
83.9% |
|
|
Zubairi et al,2007
|
100 |
PVA,Gelfoam |
75% |
|
|
Kato et al, 2000
|
101 |
PVA,Gelfoam |
94% |
一年后,22.3% |
|
Xiao et al, 2007
|
46 |
Gelfoam |
100% |
|
|
Corr et al,2005
|
70 |
Microspheres |
90% |
|
The smaller the particlesthe greater the likelihood of tissue necrosis
聚乙烯醇(PVA)是最常使用的永久性栓塞材料,可有不同大小的颗粒。应使用大于250um的颗粒以避免组织缺血或神经系统损伤。PVA的不同大小取决于生产者。300-500um和500-700um大小范围内的颗粒与共轴导管兼容,常用在作者的操作实践中。也可使用近期批准的标刻度的微粒,可能在应用中更有效。用5French或更大的导管时,常用3或5ml的注射器滴注颗粒,而使用共轴导管或可注射的导丝时,则常用1ml的注射器。选择好合适的颗粒大小后,将瓶里的物质置于一拔出内芯的20mL注射器内。再将与盐水1:1稀释的造影剂和PVA颗粒置于20注射器中。将注射器内的空气去除,用手指顶住顶部,拔动注射器内芯,用力摇晃后可去除溶液中的气体,颗粒可弥漫分布在20mL注射器里,注射器便成为颗粒的储备处。然后通过柔韧的输液管与三向开关相联,同时联着开关的还有导管和用于注射的注射器。在滴注前。反复地在注射用注射器和20mL储备用注射器间抽吸,以再次混匀颗粒。由于造影剂的存在,栓塞可在直视下进行。任何时候出现造影剂/PVA柱减慢时,应立即用生理盐水和先前的造影剂注射清洗导管内残存的颗粒。该释放系统允许快速、准确、安全的释放PVA颗粒。当正向血流显著减少时,应终止进一步的栓塞。
一些作者提倡在远端用PVA颗粒栓塞后,近端再用明胶海绵颗粒或鱼雷栓塞。这些明胶海绵颗粒应一次性释放直至血流几乎停止。当有较大的动脉-肺静脉分流时,常在开始时使用更大的特殊颗粒以避免体循环栓塞。支气管动脉栓塞术的文献报告中栓塞剂使用均以PVA为主,也有使用 丙烯酸明胶微球(tris-acryl gelatin microspheres)的报告【7】。Antoine K. 等人最近还报告使用Ethylene Vinyl Alcohol Copolymer (EVOH, 乙烯-乙烯醇共聚物)进行支气管动脉栓塞(15例)获得成功【1】。
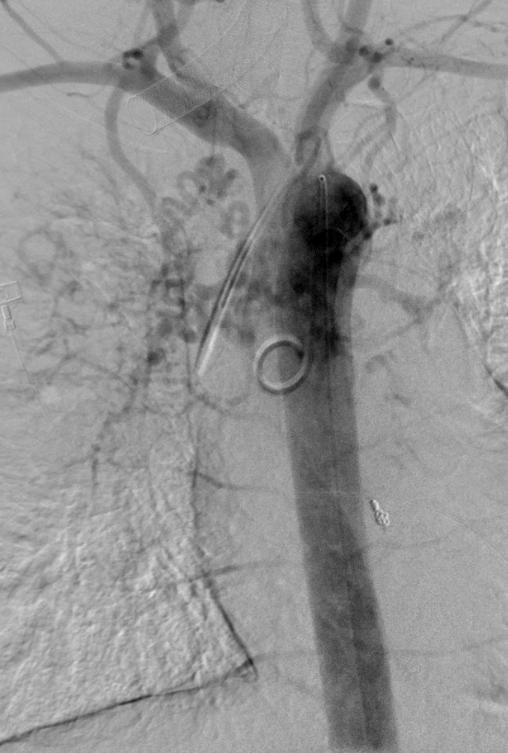 |
 |
 |
|
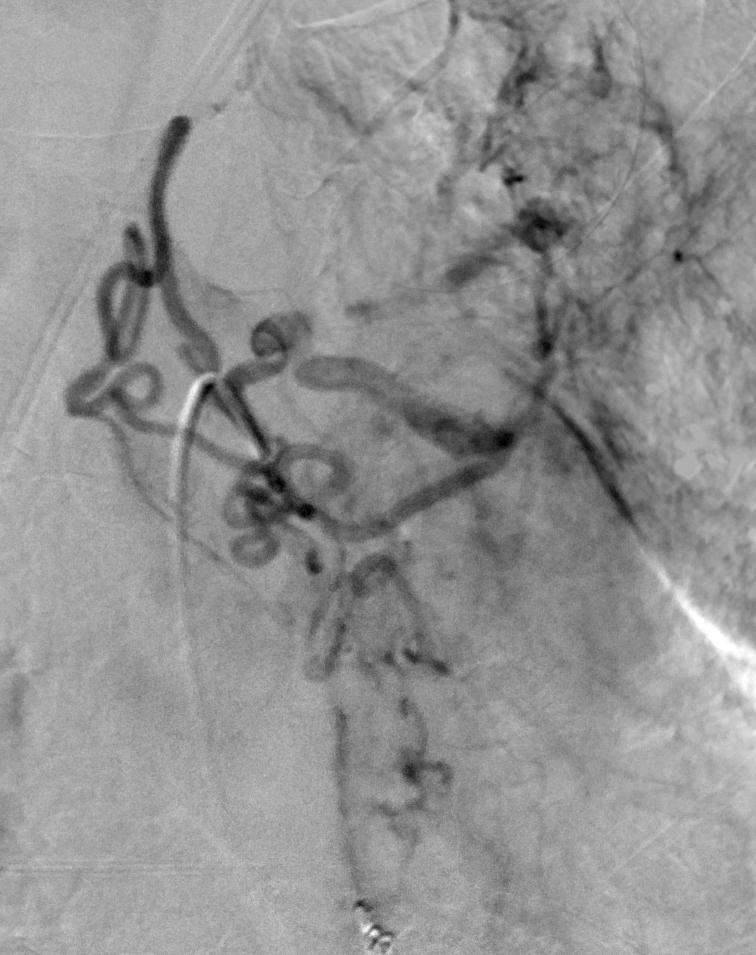
Nonselective angiogram
|
Selective left angiogram
|
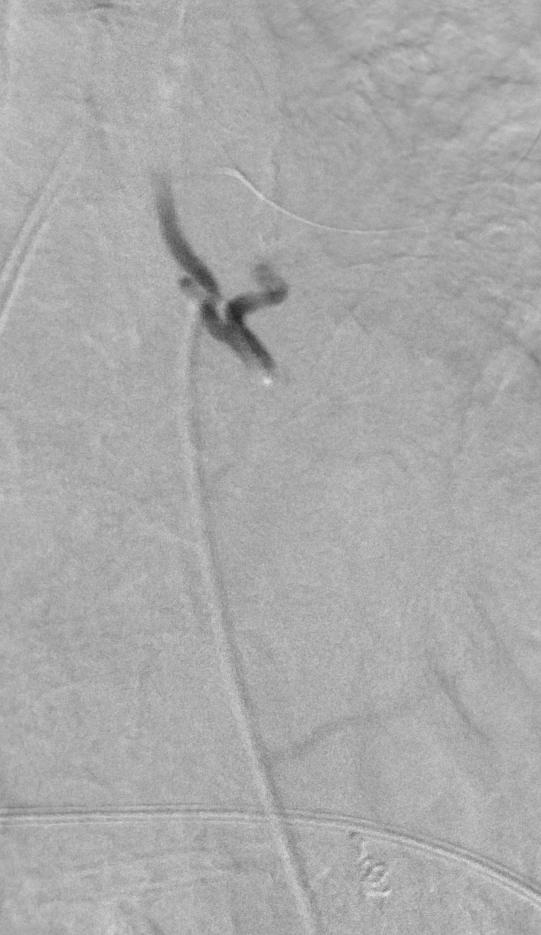
Post PVA |
一种比PVA颗粒直径更为一致的栓塞颗粒,也应用于支气管动脉栓塞。该颗粒具有亲水涂层可以防止在导管腔内凝集而阻塞导管,特别是在使用微导管的时候。Trisacryl gelatin microspheres (TGM)
Particle size: 100 –1200 μm The smaller the particles , the greater the likelihood of tissue necrosis
尽管有许多栓塞剂可以使用,但应避免栓塞剂通过异常的支气管-肺吻合,细小的栓子通过支气管动脉-肺动脉分流有肺梗死或/和支气管梗死的危险。尸检解剖学研究证实支肺组织中气管-肺动脉吻合血管直径为325um【5】,不应该在该血管床中使用能够穿过半径小于325微米血管的液体或微粒,例如乙醇、细颗粒试剂和 bucrylate。
总的来说明胶海绵由于即时可得和容易使用,是最广泛使用的支气管动脉栓塞材料。聚乙烯乙醇(Ivalon)也相对安全,是有效的栓塞剂。用弹簧栓子在近端进行栓塞可能会出现远端侧支血流,因此可能不能控制咯血,而且也影响将来再次出血的栓塞处理。
但有些特殊情况下支气管动脉栓塞术也可考虑使用弹簧栓子。在囊性纤维化的患者中的大咯血有时会遇见巨大的支气管动脉伴高速血流和大的支气管-肺动脉分流,此时可能需要使用弹簧圈栓塞以达到安全和足够的阻断。
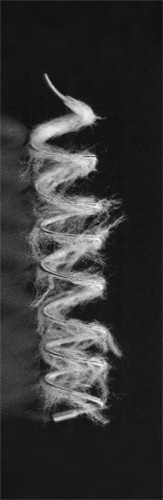
Embolization Coils: Platinum Microcoils
 |
 |
 |
|
|
|
|
弹簧圈应较血管直径大15-20%以避免逆向移动,且导管也应很好地固定。这种弹簧圈近端阻断不应成为常规的临床操作,只用当其它方法失败或禁忌使用或病人的临床状况要求非常迅速的控制出血时才使用。肺动脉假性动脉瘤和肺动静脉畸形大咯血也需要考虑使用弹簧栓子进行肺动脉分支的栓塞。
 |
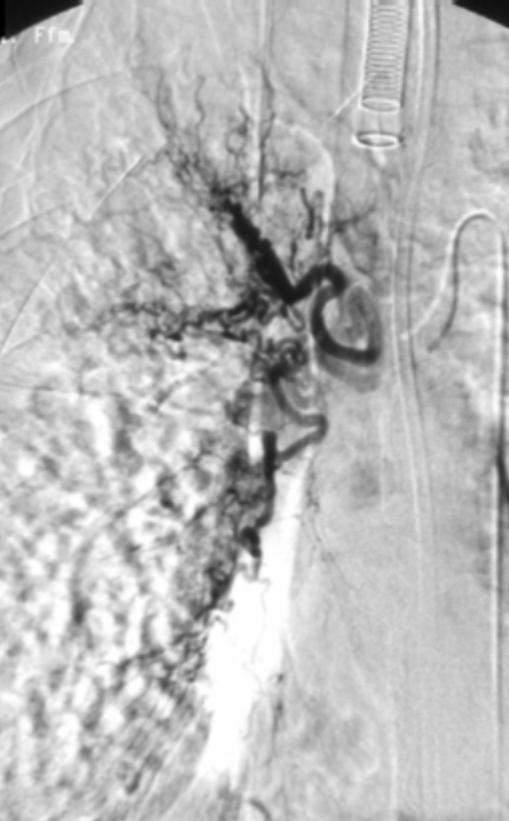 |
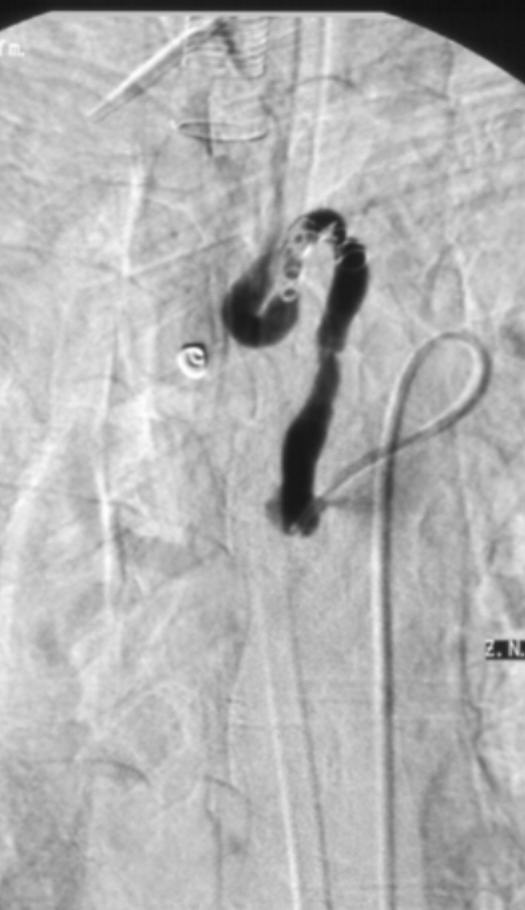 |
|
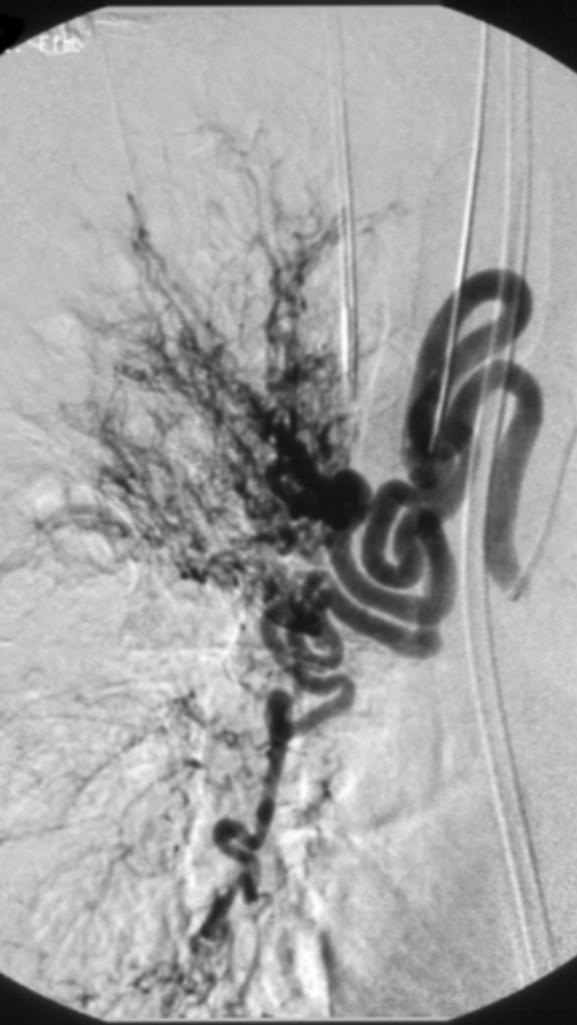
术前,血流量较大 |
PVA栓塞术后 |
弹簧栓子栓塞术后 |
支气管动脉选择性栓塞多数是在出血的间歇期或择期进行。但也可能急诊大咯血的同时进行,这时可以考虑对非出血的支气管在麻醉科的帮助下进行非出血气管的插管或对出血肺叶的支气管进行插管,利用球囊阻塞可以预防由于血液导致的窒息。
任何弹簧栓子的使用都可能影响重复性栓塞。
1. Marshall TJ, Jackson JE (1997) Vascular intervention in the thorax: bronchial artery embolization for haemoptysis. Eur Radiol 7:1221–1227
2. Yoon W, Kim JK, Kim YH et al (2002) Bronchial and nonbronchial systemic artery embolization for life-threatening hemoptysis: a comprehensive review. Radiographics 22:1395–1409
3. Phillips S, Ruttley MS (2000) Bronchial artery embolization: the importance of preliminary thoracic angiography. Clin Radiol 55:317–319
4. Hsiao EI, Kirsch CM, Kagawa FT et al (2001) Utility of fibre-optic bronchoscopy before bronchial artery embolization for massive hemoptysis. AJR 177:861–867
5. Ramakantan R, Bandekar VG, Gandhi MS et al (1996) Massive hemoptysis due to pulmonary tuberculosis: control with bronchial artery embolization. Radiology 200:694
6.Baltacioglu F, Cimsit NC, Bostanci K, et al. (2008) Transarterial microcatheter glue embolization of the bronchial artery for life-threatening hemoptysis: technical and clinical results. Eur J Radiol
7. Corr PD (2005) Bronchial artery embolization for life-threatening hemoptysis using tris-acryl microspheres: short-term result. Cardiovasc Interv Radiol 28:439–441
8. Antoine Khalil, Muriel Fartoukh, Marc Bazot1, Antoine Parrot, Claude Marsault1, and Marie-France Carette. Systemic Arterial Embolization in Patients With Hemoptysis: Initial Experience With Ethylene Vinyl Alcohol Copolymer in 15 Cases. AJR 2010; 194:W104-W110
| 












