支气管动脉的评估
大咯血病人支气管动脉的解剖之所以重要是因为它是最常见到出血来源【6】。它常在T3-T8之间的范围内起自胸主动脉,正常直径是1~2mm,大于2mm直径被认为异常。其供应气管、支气管、迷走神经、后纵隔及食管。支气管动脉的开口和分支的分布范围存在变异。在进行支气管动脉栓塞术之前,介入医生熟悉这些解剖变异是非常重要的。
在1948年,Cauldwell根据150例成人尸解,描述了4种常见的变异:
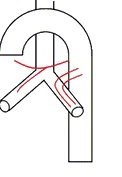
1型:双支左支气管动脉和起源于肋间支气管动脉(intercostobronchial trunk,ICBT)的单支右支气管动脉(40.6%);
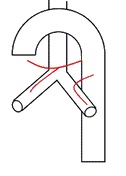
2型:双侧均为单支动脉(21.3%),其中右侧起源于ICBT;
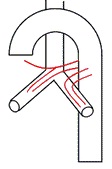
3型—各自来源或不同组合方式来源的双支左支气管动脉和双支右支气管动脉,右侧其中一只起源于ICBT(20.6%);
4型:单支左支气管动脉和双支右支气管动脉,其中右侧一只起源于ICBT(9.7%)【1】。
支气管动脉解剖变异【1】
|
分型 |
% |
描述 |
图示 |
|
I 型 |
40.6% |
双支左支气管动脉和单支右支气管动脉(来自于ICBT) |
|
|
II 型 |
21.3% |
双侧均为单支动脉,右侧来自于ICBT |
|
|
III 型 |
20.6% |
各自来源或不同组合方式来源的双支左支气管动脉和双支右支气管动脉(其中一支来自于ICBT) |
|
|
IV 型 |
9.7% |
单支左支气管动脉和双支右支气管动脉 |
|
Chun et al. Radiological Management of Hemoptysis: A Comprehensive Review of Diagnostic Imaging and Bronchial Arterial Embolization. CardiovascIntervent Radiol 33 (2010)
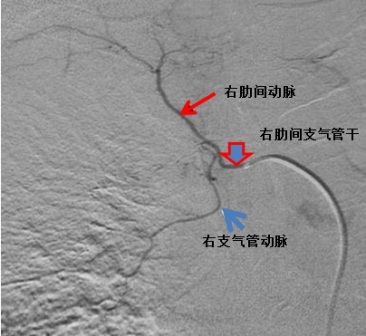
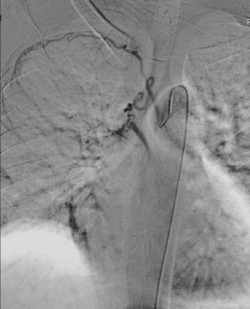
肋间支气管干几乎固定的发出右上叶支气管动脉,占88.7%(下图)。该血管是需要被栓塞的最为重要的支气管动脉,因为它较大且与肋间动脉和根动脉相连。支气管动脉的异常起源主要指起源于主动脉弓、乳内动脉、锁骨下动脉、无名动脉、心包膈动脉和腹腔干。
1985年,Uflacker及同事【2】基于血管造影报告了4种最常见的变异为单右肋间支气管干和单左动脉,单右肋间支气管干和左右支气管动脉共干(25%),单右肋间支气管干和双左支气管动脉(13%),单右肋间支气管干依次发出左右双侧支气管动脉(11%)。在该研究中,43%的患者有常见的支气管干。未见有左肋间支气管动脉,而右支气管动脉则常常与上肋间动脉共干。
 |
 |
|
Digital subtraction angiogram of the right intercostobronchial trunk (anteroposterior projection) showing hypertrophied and tortuous bronchial artery. Embolization was done using PVA- gelfoam slurry |
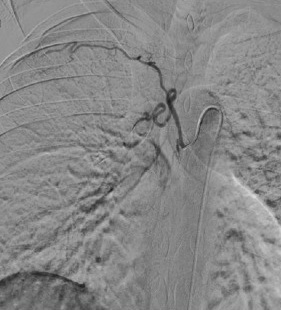
Postembolization angiogram showed no opacification of the distal bronchial artery (image on the right side) |
所有支气管动脉中近80%起自T5-T6水平,超出这一范围的被认为是异常的或异位开口,占16.7%~30%【3,4】。典型的右支气管动脉或肋间支气管动脉干起自降主动脉的右侧壁或前侧壁。左支气管动脉常起自主动脉更靠前壁的位置。
VariationsVariants(16.7 to 30%) :
1. 4-6 支支气管动脉(4-6 bronchial arteries)
2. 肋间动脉(Intercostal arteries)
3. 头臂干(Brachiocephalic trunk)
4. 锁骨下动脉 (Subclavian artery)
5. 甲状颈干(Thyreocervical trunk )
6. 乳内动脉(Internal mammary artery)
7. 膈下动脉(Inferior phrenic artery) (abdominal aorta)
8. 寄生动脉(Parasitic arteries)
所有这些变异可以和非支气管动脉系统的动脉区别开,应为它们沿主支气管走行延伸
 |
|
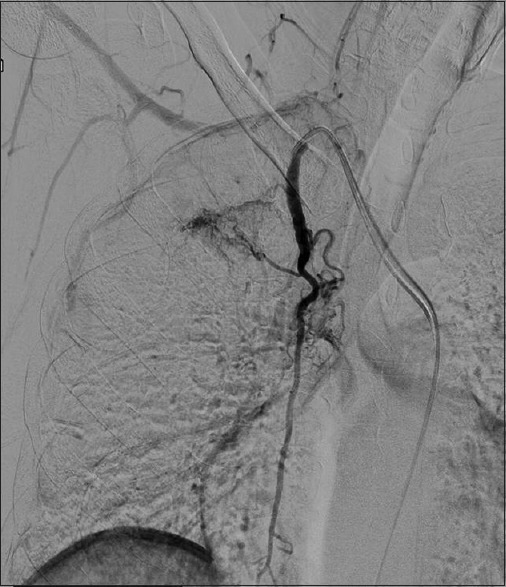
Digital subtraction angiogram of the right internal mammary artery showed hypertrophied second right bronchial artery arising from the internal mammary artery. This bronchial artery was embolized using PVA-gelfoam slurry after selective cannulation |
多达20%的支气管动脉起自主动脉以外的部位,约10%起自主动脉弓的凹面或凸面。支气管动脉的其它变异来源包括锁骨下动脉、甲状颈干、内乳动脉、腹主动脉和膈下动脉【4】。 也包括肋间动脉、头臂动脉、因为这些动脉沿支气管分布走行,所以容易与非支气管的体循环动脉区别,后者动脉可以通过下肺韧带或粘连的胸膜进入肺实质,但它们的走行与支气管不平行【5】。
支气管动脉变异
Cohen报告了在20例囊性纤维化的患者中变异支气管发生率较高(35%)。另外作者还发现这类病人中支气管动脉根性血供的发生率呈10倍增高。作者推测持续的支气管壁炎症导致原本存在的连接支气管循环与纵隔、头、颈和脊动脉的广泛吻合的血管网扩大。
咯血病人的支气管动脉经常会代偿增粗,在轴位CT影像表现在纵膈内和主气道周围增强的小结节或线样结构。异常的支气管动脉最常发现在支气管后河食管后的区域,主支气管和主肺动脉窗【7,8】。支气管动脉扩张>2mm,适合进行栓塞治疗。
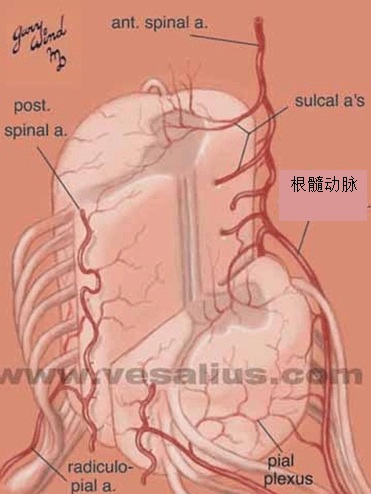
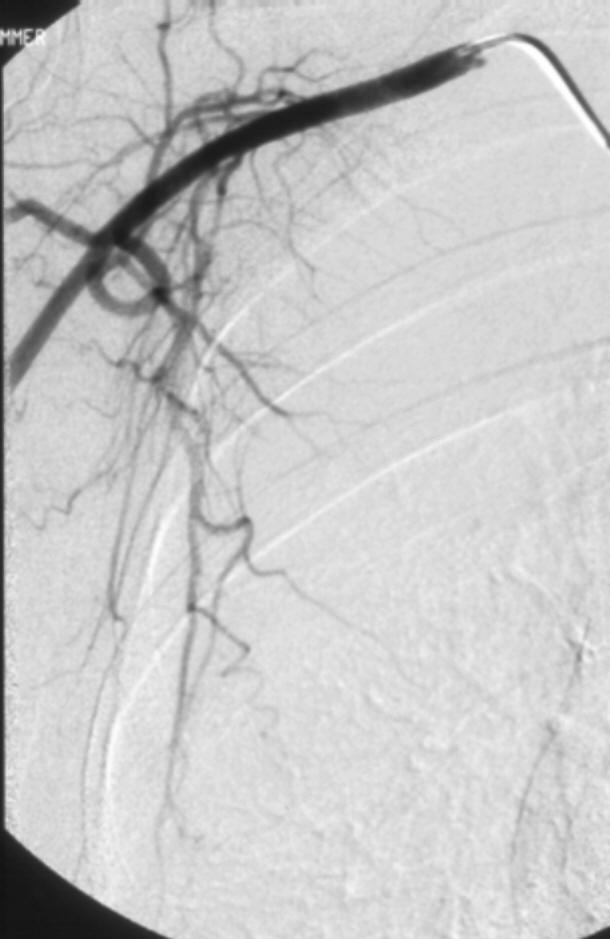
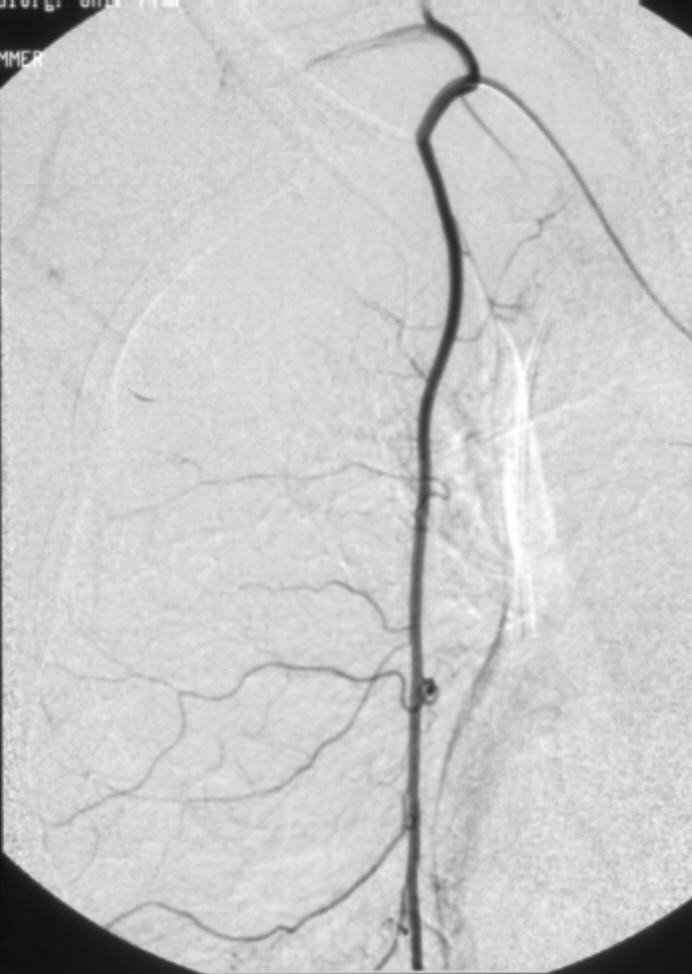
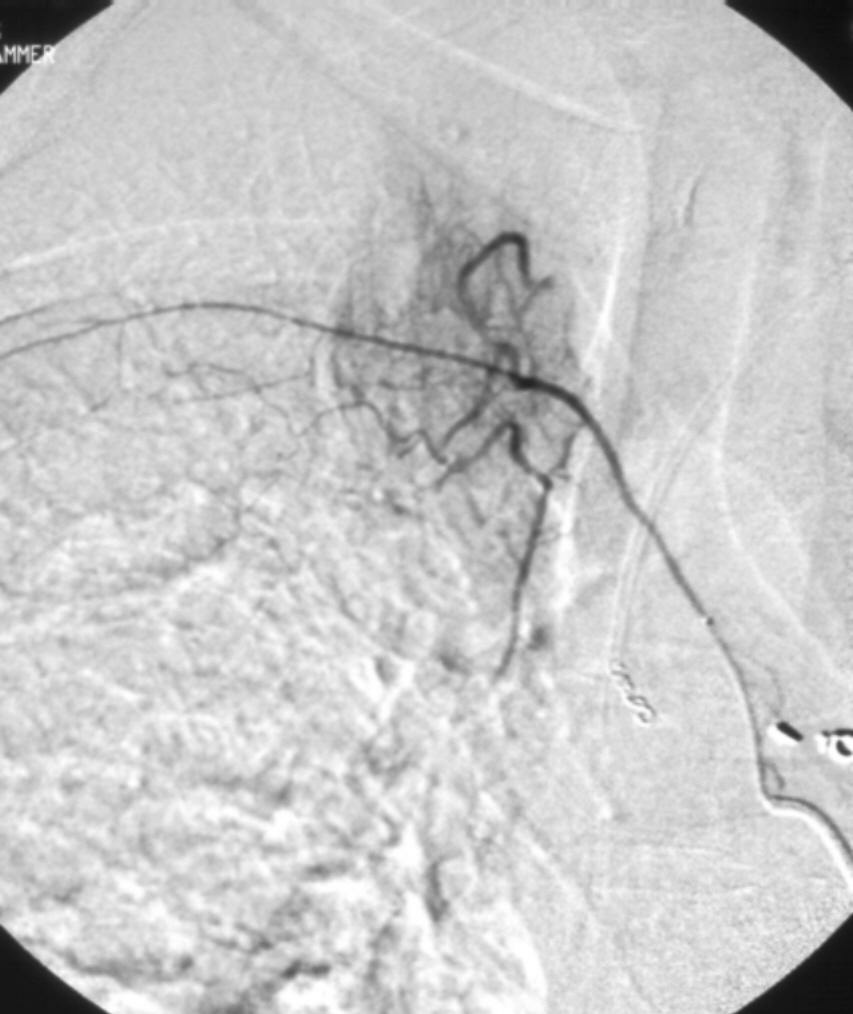
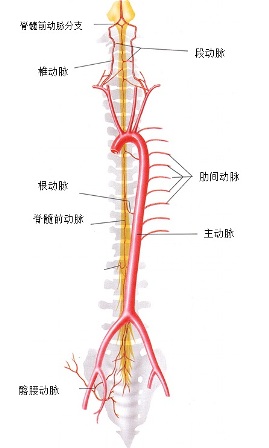
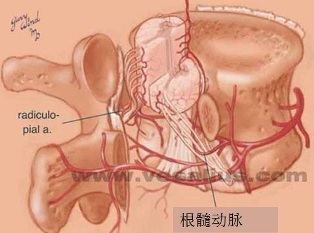
进行支气管动脉血管造影和栓塞时,必须仔细考虑脊髓的血供(下图)。脊髓前动脉走行于脊髓腹正中沟,供应脊髓前部。脊髓前动脉起自椎动脉颅内段的分支,并在全长上接受肋间动脉和腰动脉的前髓分支的血供【9】。可有多达6-8支供应脊髓前动脉的分支,每支的路径均形成特征性的发夹环。最大的前髓分支(Adamkiewicz分支)可起自T5-L5水平盘【10】,但最常见于T8-L1水平。虽然并不常见,约5%的人群中,右肋间支气管动脉供应或与 Adamkiewicz 动脉共干(下图),形成血管造影上特征性的“发卡结构”(hairpin configuration)。由于右上肋间动脉和右支气管动脉可共干并供应到前髓动脉的分支,栓塞时应注意识别避开髓前动脉,特别是“发卡动脉”,以免发生横断性脊髓炎( transverse myelitis )【11,12】。一旦发现脊髓分支,使用微导管越过脊髓动脉再进行栓塞,同时仔细地观察防止栓塞物质反流到脊髓分支【13】。左支气管动脉很少供应脊髓前动脉。脊髓的后部由走行于脊髓后外侧的一对脊髓后动脉供血,其由起自肋间动脉和腰动脉的后根动脉供血,比前根髓动脉要短小得多。
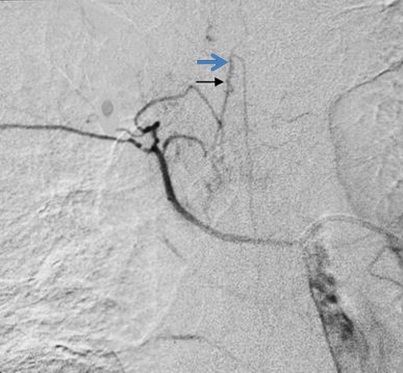 右肋间支气管动脉供应或与 Adamkiewicz 动脉共干
右肋间支气管动脉供应或与 Adamkiewicz 动脉共干
颈胸段脊髓动脉供血:不同节段的脊髓供血来源不同,上段颈髓由椎动脉颅内段分出的脊髓、后动脉供血,下段颈髓由椎动脉颅外段、颈深动脉和颈升动脉等供应;胸、腰段脊髓自上而下由肋间动脉、腰动脉和髂腰动脉供应;骶尾段脊髓由骶外侧动脉供应,偶有骶正中动脉甚至闭孔动脉的分支加入。
和支气管动脉栓塞术相关的脊髓供血主要是胸段和颈段。胸段脊髓有两个来源,即椎动脉和节段性动脉。颈段脊髓供血包括锁骨下动脉分支中的椎动脉、胸廓内动脉、甲状颈干、颈肋干。甲状颈干的颈升动脉、颈肋干的颈深动脉和第一肋间动脉。椎动脉发出脊髓前、后动脉。
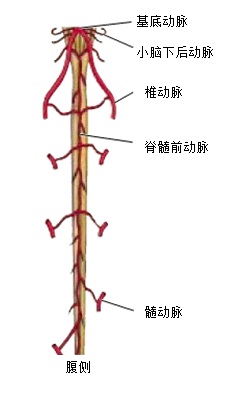
脊髓前动脉,由颅内左右椎动脉各发出一条脊髓前动脉以后,二者向下合成一条动脉干,沿脊髓前正中裂(腹正中沟)下行,沿途全长不断接受来自颈、胸、腰各部节段性动脉分出的前髓动脉,延伸至脊髓圆锥。脊髓前动脉的血流方向是自上而下。
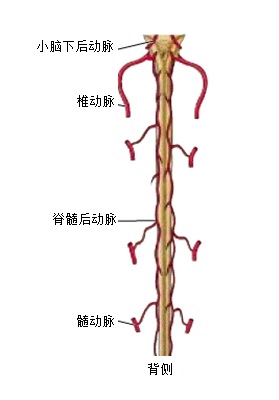
脊髓后动脉,由椎动脉或小脑下后动脉发出左右两条脊髓后动脉,两条脊髓后动脉分别沿脊髓后外侧下行,沿途接受后髓动脉的补充。髓动脉,为颈、胸、腰各部的节段性分支,经相应的椎间孔进入椎管,形成根动脉,其中到达脊髓者称为髓动脉(上图),营养脊髓。髓动脉(medullary artery)又分为前髓动脉(anterior medullary artery )和后髓动脉(posterior medullary artery)。颈胸区(上区)的前髓动脉来源于颈升动脉和椎动脉等分支,中区(中胸区)前髓动脉主要来源于肋间动脉形成的分支。下区的前髓动脉来源于腰动脉、髂腰动脉和骶外侧动脉。
到脊髓下端,脊髓前动脉血流经交通支引流至脊髓后动脉,再返流向上。脊髓前动脉供应脊髓前3/4。脊髓后动脉供应脊髓1/4。
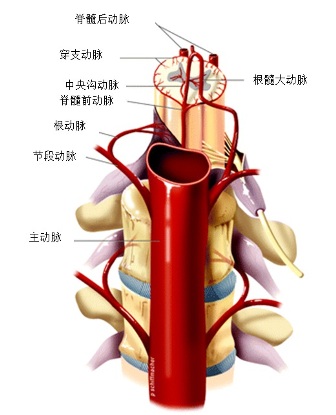
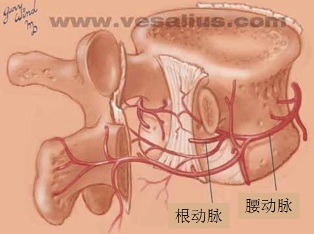
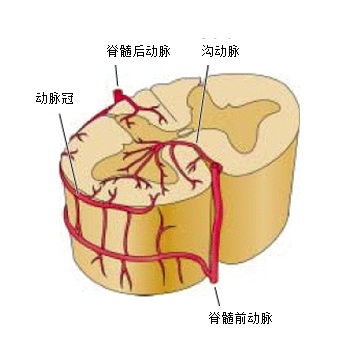
脊髓动脉具有多来源的特点。多节段性动脉(sengmental artery)如肋间动脉的后分支发出脊髓支进入相应的椎间孔,被称为根动脉(radicular artery)。根动脉在椎间孔处分支,根固有动脉,终支营养神经根、硬脊膜、椎体及椎弓等;根软膜动脉,终支加入软膜动脉丛;只有根髓动脉(radiulomedullary artery),根动脉分支中较粗(外径在0.6mm左右)的终支穿过脊膜到达脊髓并在脊髓表面相互吻合。由于形成3条纵行动脉链(脊髓前,后动脉)与这些被称为根动脉的分支形成广泛的吻合,全长有颈节6、胸节10和腰节2脊髓的血液供应具有完全充分的髓动脉供血 。有些脊髓节由于髓动脉之间吻合不够充分,形成血液供应的薄弱区,如胸节4和腰节1,其中以胸节4最易发生缺血性损害。
脊髓前动脉和根动脉示意图
脊髓前动脉和根动脉示意图
非支气管动脉的评估
支气管动脉从支气管沿伸到呼吸性细支气管水平,在此与肺循环吻合。分支供应肺脉管系统的滋养血管以及脏胸膜的膈面和纵隔面、食管的中1/3和淋巴结。大部分静脉经支气管肺血管吻合回流。
Tanaka等总结了行支气管动脉栓塞或化疗栓塞的患者的支气管动脉引流情况。他们发现4静脉引流类型:
(1)1型—直接引流至肺静脉(42%)
(2)2型—直接引流至肺动脉;
(3)3型—以逆向血流直接引流至肺动脉(19%);
(4)4型—直接引流至支气管静脉(4.8%)。
在支气管动脉还与纵隔、脊柱、头、颈部其它结构间有潜在的丰富的吻合。支气管肺动脉吻合在异常的肺中可能较明显,反映了慢性炎症或肺动脉高压。在这些情况下,起自肋间动脉、内乳动脉、膈动脉、甲状颈干及叶动脉分支的系统侧枝血管穿过胸膜提供非支气管血供,可为咯血的来源【6,8,13~15】。在最初的血管造影时忽略这些来自这些非支气管体循环动脉可能导致成功地栓塞支气管动脉后仍然持续咯血。支气管动脉栓塞前进行胸部的CTA可以预测这些血管的存在。增强CT,非支气管动脉的行程与支气管不平行,通常沿胸膜表面走行。作为咯血的来源非支气管动脉的特征包括在邻近肺部病变的胸膜增厚>3mm,在肥厚的胸膜外脂肪中可见增强的迂曲血管结构【16,17】(下图)。
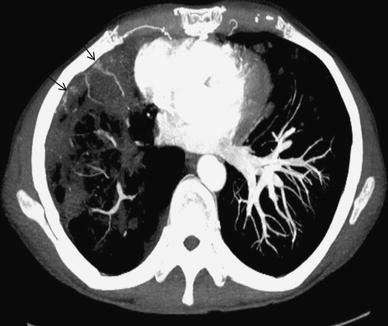
非支气管动脉侧支循环。多排CT显示右前中叶活动性肺结核病人,右内乳动脉沿增厚的胸膜走行。
肺动脉评估
虽然体循环动脉是大咯血主要的出血来源【18】,但来自肺动脉来源的出血占将近5%的病例【19,20】。在支气管动脉或/和非支气管体循环动脉栓塞后病人仍持续咯血,可能为肺动脉来源的出血,特别是慢性肺结核的病人【13,21】。一项306例病人的研究【19】显示如果没有能立即控制咯血,肺动脉来源的出血占93%。这些病人包括有肺脓肿,肺结核,肺肿瘤。Muthuswamy等人【22】描述一例活动性肺结核病人,支气管动脉造影正常,肺动脉造影显示肺动脉和邻近的支气管瘘。由于持续咯血,紧急性行肺切除,切除标本证实肺动脉造影的发现。
最常见来自肺循环大咯血的病因是 Rasmussen’s 动脉瘤,它是由于慢性炎症对周围肺动脉侵蚀导致的假性动脉瘤,如慢性空洞性肺结核。这种病变可以在CT扫描上显示为在结核空洞的壁内浓聚的造影剂增强结节【23】。文献上其发病率在4%~11%之间【20,21,23】。1114例慢性肺结核病人尸检,45例(4%)发现 Rasmussen’s 动脉瘤【23】。其中38例由于动脉瘤破裂死亡。72例咯血病人进行前瞻性研究以决定咯血病人肺动脉来源的发生率,同时为病人进行支气管动脉和肺动脉造影,5例(6.9%)显示肺动脉假性动脉瘤,其中3例为空洞性肺结核,一例合并曲霉菌肿(aspergilloma),此例病人最后进行右肺动脉分支栓塞后没有进一步出血。
2005年的一项研究发现76例中的8例(10.5%)咯血病人进行支气管动脉造影有可见的肺动脉假性动脉瘤【21】。其中5例有肺结核病史,3例为空洞性结核,2例为活动性肺结核。虽然由于支气管-肺动脉分流(bronchial-pulmonary arterial shunt ,BP shunt)以及肺动脉分支完全反流,大多数假性动脉瘤可以很容易通过支气管和非支气管体循环动脉造影发现,但是8例病人中的2例仅在段肺动脉造影中出现。这2例病人最初都进行了支气管动脉栓塞术,但术后持续出血,直到进行肺动脉造影并成功地进行假性动脉瘤栓塞出血才止住。从中的启示,任何成功地进行支气管动脉栓塞术后或支气管动脉正常的病人,发生持续性出血或早期复发性出血都应该进行肺动脉造影,以除外是否有肺动脉假性动脉瘤的可能。
罕见情况下,大咯血可能来自肺动静脉瘘或肺动静脉畸形的破裂。大多数是由于先天性或遗传性毛细血管扩张症【24】。用弹簧栓子或可脱球囊进行滋养肺动脉栓塞被证实有较高的成功率,大多数被治疗的病例疗效持久【25~27】。
血管造影前的胸部放射线和支气管镜检查能帮助对出血部位进行定位。然而,大块咯血的患者并不都能接受支气管镜检查。 所以血管造影通常成为主要的检查和定位手段。但多排CT的出现,是支气管动脉大咯血诊断和定位出现新的选择。
1. Cauldwell EW, Siekert RG, Lininger RE et al (1948) The bronchial arteries: an anatomic study of 150 human cadavers. Surg Gynecol Obstet 86:395–412
2. Uflacker R, Kaemmerer A, Picon PD et al (1985) Bronchial artery embolization in the management of hemoptysis: technical aspects and long-term results. Radiology 157:637–644
3. Cauldwell EW, Siekert RG, Lininger RE et al (1948) The bronchial arteries: an anatomic study of 150 human cadavers. Surg Gynecol Obstet 86:395–412
4. Botenga AS (1968) The role of bronchopulmonary anastomoses in chronic inflammatory processes of the lung. Selective arteriographic investigation. Am J Roentgenol Radium Ther Nucl Med 104:829–837
5. Sancho C, Escalante E, Dominguez J et al (1998) Embolization of bronchial arteries of anomalous origin. CardioVasc Interv Radiol 21:300–304
6. Yoon W, Kim JK, Kim YH et al (2002) Bronchial and nonbronchial systemic artery embolization for life-threatening hemoptysis: a comprehensive review. Radiographics 22:1395–1409
7. Song JW, Im JG, Shim YS et al (1998) Hypertrophied bronchial artery at thin-section CT in patients with bronchiectasis: correlation with CT angiographic findings. Radiology 208:187–191
8. Do KH, Goo JM, Im JG et al (2001) Systemic arterial supply to the lungs in adults: spiral CT findings. Radiographics 21:387–402
9. Stoll JF, Bettmann MA (1988) Bronchial artery embolization to control hemoptysis: a review. CardioVasc Interv Radiol 11:263–269
10. Botenga AS (1968) The role of bronchopulmonary anastomoses in chronic inflammatory processes of the lung. Selective arteriographic investigation. Am J Roentgenol Radium Ther Nucl Med 104:829–837
11. Feigelson HH, Ravin HA (1965) Transverse myelitis following selective bronchial arteriography. Radiology 85:663–665
12. Di Chiro G (1974) Unintentional spinal cord arteriography: a warning. Radiology 112:231–233
13. Marshall TJ, Jackson JE (1997) Vascular intervention in the thorax: bronchial artery embolization for haemoptysis. Eur Radiol 7:1221–1227
14. Katoh O, Kishikawa T, Yamada H et al (1990) Recurrent bleeding after arterial embolization in patients with hemoptysis. Chest 97:541–546
15. Keller FS, Rosch J, Loflin TG et al (1987) Nonbronchial systemic collateral arteries: significance in percutaneous embolotherapy for hemoptysis. Radiology 164:692
16. Yoon W, Kim YH, Kim JK et al (2003) Massive hemoptysis: prediction of nonbronchial systemic arterial supply with chest CT. Radiology 227:232–238
17. Yoon YC, Lee KS, Jeong YJ et al (2005) Hemoptysis: bronchial and nonbronchial systemic arteries at 16-detector row CT. Radiology 234:292–298
18. Remy J, Arnaud A, Fardou H et al (1977) Treatment of hemoptysis by embolization of bronchial arteries. Radiology 122:33–37
19. Rabkin JE, Astafjev VI, Gothman LN et al (1987) Transcatheter embolization in the management of pulmonary hemorrhage. Radiology 163:361–365
20. Remy J, Lemaitre L, Lafitte JJ et al (1984) Massive hemoptysis of pulmonary arterial origin: diagnosis and treatment. AJR 143:963–969
21. Sbano H, Mitchell AW, Ind PW et al (2005) Peripheral pulmonary artery pseudoaneurysms and massive hemoptysis. AJR 184:1253–1259
22. Muthuswamy PP, Akbik F, Franklin C et al (1987) Management of major or massive hemoptysis in active tuberculosis by bronchial artery embolization. Chest 92:77–82
23. Auerbach O (1939) Pathology and pathogenesis of pulmonary artery aneurysm in tuberculous cavity. Am Rev Tuberc 39:99–115
24. Ference BA, Shannon TM, White RI Jr et al (1994) Life-threatening pulmonary hemorrhage with pulmonary arteriovenous malformations and hereditary hemorrhagic telangectasia. Chest 106:1387–1390
25. White RI Jr, Pollak JS, Wirth JA (1996) Pulmonary arteriovenous malformations: diagnosis and transcatheter embolotherapy. J Vasc Interv Radiol 7:787–804
26. Pollak JS, Saluja S, Thabet A et al (2006) Clinical and anatomic outcomes after embolotherapy of pulmonary arteriovenous malformations. J Vasc Interv Radiol 17:35–44
27. Andersen PE (2006) Imaging and interventional radiological treatment of hemoptysis. Acta Radiol 47:780–792
|