|
超声引导下的穿刺并发症会减少
|
|
超声引导下
|
解剖标记引导下盲穿
|
|
颈动脉损伤
|
1.1%
|
10.6%
|
|
血肿
|
0.4%
|
8.4%
|
|
血胸
|
0%
|
1.7%
|
|
气胸
|
0%
|
2.4%
|
HDC长期使用过程中的并发症包括导管血栓,静脉血栓纤维鞘形成以及感染
导管功能不良和血栓
导管功能不良是由于导管腔内血栓、围绕在导管尖的纤维鞘形成,导管扭曲,导管位置不良(开口太过贴近导管壁)导致。主要表现为血流差,高的入路压造成透析不足。低血流至150~250ml/分还可以维持透析,直到病人稳定过渡到间断透析(IHD)导管还可以用。研究显示临时透析导管与颈内静脉入路比较股静脉入路血栓危险性增加[7]。
在每次透析结束的时候或HDC暂时不用的任何时候,向双管腔内注入肝素是非常必要的。肝素浓度1000IU/ML,2500IU/ML以及5000IU/ML都被证实可以有效地防止血栓,但是肝素在危险人群可以导致出血,因此在有出血倾向的患者中最好使用低浓度的肝素。
对于完全没有功能的导管,在每个管腔内注入阿替普酶 (alteplase,recombinant tissue-type plasminogen activator, rtPA)2mg,在绝大多数病例,可以恢复>200ml/min的血流量[8]。如果仍然不能再通,可以考虑经导丝原位置换透析管或在新的位置重新置管。
导管外纤维鞘形成特别是隧道导管对溶栓剂几乎没效,需要机械方法剥离。
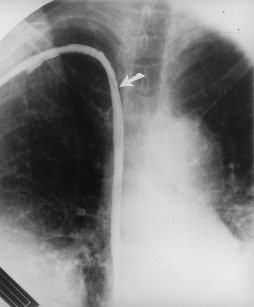
上图为纤维鞘的影像学:将导管撤至静脉入口处(箭头),注射造影剂显示导管形状的纤维鞘的轮廓
按照美国肾脏数据库系统,1999年数据报告,79102新病人在1997年度因终末肾开始进行治疗[23],其中应用撕脱鞘静脉透析导管进行临时血液透析占10~15%[24],血液透析导管为病人提供“无疼”血液透析,但这一方式导致导管感染率增加和耐久性差。平均导管功能时间为6~12个月,一年开放的可能性在3~74%[24~26]。导管功能不良的原因包括位置不良,扭结,纤维鞘形成。所有这些,位置不良和扭结通常在置管后首次透析时被发现。纤维鞘形成发生在保留导管的所有时间范围。由于纤维鞘形成导致的血流受限发生在导管位置不良和扭结之后,占后期由于血流下降导致隧道导管透析失败的大多数。
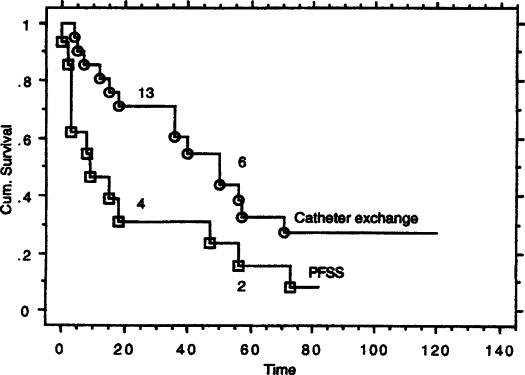
增加血液透析病人的寿命需要保存血管入路的位置。纠正导管功能不良的机械手段包括经皮纤维鞘剥离(PFSS)[25~30];经导丝置换导管(EX)[31,32]是恢复透析导管功能常规方法。因为PFSS[27]和导管置换[31]是恢复透析的基础手段,所以由每一次干预所提供的导管开放时间是非常重要的临床有效标示。所报告的PFSS和EX后导管开放率非常不同。一次PFSS延长导管寿命超过4个月[30],另一项报告指出第五次透析后,导管功能就可回到不可接受的水平。一项随机试验显示经导丝交换功能不良的隧道导管应该作为首选的、标准的方法,而不是PFSS[33](下图)。
导管相关感染:
临时或长期HDC可以发生穿刺部位(或隧道)感染和菌血症/败血症[36]。主要由于导管腔内污染或皮肤细菌通过穿刺部位到血液迁移,但有时由于其它部位的感染通过血源性播散。
预测感染的各种危险因素包括,潜在疾病、尿毒症状态和透析操作本身[34]。在心血管疾病之后,血液透析病人第二位的死因是败血症[35]。
尽管非撕脱鞘、非隧道(nontunneled)透析导管是获得立即进入循环的基本方法,但是菌血症并发症时常会发生,是阻碍此类导管长期应用的主要因素。对于长期卧床病人(bed-bound patients),包括危重病人静脉临时透析导管通常经股静脉进入,或活动的病人可以经颈静脉进入。对于临床医生问题是在发生菌血症危险之前,这种静脉临时透析导管应该保留多少天,不同的入路感染发生的危险性有何不同?NKF-DOQI(National Kidney Foundation-Dialysis Outcomes Quality Initiative )指南基于菌血症累积危险建议静脉临时透析导管股静脉保留不超过5天,在颈静脉和锁骨下静脉不超过21天[1]。但该委员会也承认这个建议是基于主观的判断,对于静脉临时透析导管导致菌血症来说尚没有大样本的前瞻性研究。很多作者进行了前瞻性的研究,菌血症的危险范围在3.9~9.7/1000导管天[3]。Matthew 等人[2]对静脉临时透析导管插入的位置和使用的时间导致菌血症的危险进行了前瞻性分析,结果表明在318例的静脉临时透析导管中,颈静脉入路保留3周后感染率为5.4%,股静脉1周后感染率为10.7% [相对危险3.1 (95% CI 1.8 to 5.2)]。这一研究的缺陷是没有区别不同位置和时间感染细菌的不同。也没有按所给的常规时间拔出导管随机比较。
有兴趣的是出口位置的感染并非菌血症发生的必要条件。将近一半的菌血症发生,没有先前或同时发生的出口位置的感染。这提示管腔内的污染是菌血症发生的主要来源[2,5],未来导管设计可能是减少导管相关菌血症的方向。另外,一旦出口感染的发生,菌血症会快速的发生。出口感染后一天之内,菌血症的发生率为2%。第二天就跳到13%,一周内达到20%[2]。
通常感染的病原菌是葡萄球菌属和革兰氏阴性杆菌,但来自皮肤的其它衍生菌和念珠菌属也可以培养出来。比较隧道HDCs,临时非隧道导管有较高的感染风险(3.8–6.6 episodes/1000 days vs. 1.6–5.5 episodes/1000 days) [9]。导管相关菌血症的危险因素是灌注孔的多少,操作的频率,疾病的严重性,导管保留时间,是否急诊置入和操作者的经验。
让人困惑的数据是导管入路和感染的危险性。非随机对照,前瞻性研究显示比较颈内静脉,股静脉入路的感染发生率增加。但是最近750例的随机对照研究两者之间感染率没有统计学差异 (分别 2.3 vs. 1.5/每1000导管天)。体重指数大于28.4的肥胖病人股静脉感染率相对高,但也没有显著差异[10]。根据现有的数据,还不能说股静脉入路的感染率高。但是,皮肤和导管的精心护理对于无论从哪入路都是预防感染的关键。导管座上聚维酮碘(也称聚烯吡酮磺,Betadine,povidone 外科用药)和抗菌素软膏,导管操作时无菌技术能够减少感染发生率。过多的消毒辅料(纱布)在穿刺周围增加感染的可能,所以纱布敷料最好每天换。
因为导管相关感染与高并发症和高死亡率相关[37],预防是非常重要的。预防指南包括:护士,医生的培训及教育,完整的消毒程序,手卫生和使用超声引导下的穿刺。一般推荐股静脉导管不要超过7天,而颈内静脉导管最好三周后就换。前瞻性研究显示抗菌素导管或抗菌素涂层导管可以减少感染率。但是由于担心过敏反应或发生耐药菌,这一方法并没有广泛地应用[11]。最近一项双盲多中心的291项临床试验显示临时和长期HDCs病人, 30%枸橼酸钠溶液封管与肝素比较可以减少导管相关感染从4%~1%/per 1000 catheter day(p<0.001)[12]。没有严重的副作用在这一研究中被发现。4%枸橼酸钠也成功地应用于一些医院。枸橼酸钠,比肝素便宜,目前在欧洲应用普遍,但美国FDA还没有批准用于封管。
穿刺部位感染的证据应该促使临时导管的拔除,并在不同的位置置换新的导管。隧道导管也应该被拔除,如果出现同样的感染。但出口感染也可以通过局部应用抗菌素治疗。如果出现全身感染的证据,获得血培养的结果后应该立即使用有效的抗菌素,并且因为由细菌形成环绕导管周围的生物被膜,抗菌素是不能渗透过的,需要立即置换导管。为了确保CRRT的持续,或至少减少中断的时间,隧道导管必须通过导丝置换或及时地在不同位置的置换。小样本研究显示,通过导丝置换导管和在新的位置上换新管治愈率是相同的。对于终末肾人群的研究已经证实抗菌素封管联合静脉抗菌素能够治愈将近70%的隧道导管的相关菌血症[13]。但是,这一方法还没有应用于严重病人需要立即(肾替代治疗的情况(Renal Replacement Therapy,RRT)。
任何成功的CRRT和病人的结果很大程度上取决于透析导管的功能。临时双腔导管是首选的,并且需要在超声引导和无菌条件下仔细的放置。 对于放置导管的功能不良以及导管相关感染需要保持警觉。CRRT的真正连续性,导管应该每天至少20小时保证在功能状态。置换或恢复功能不良或感染的导管应该置于优先的位置确保RRT的持续性。
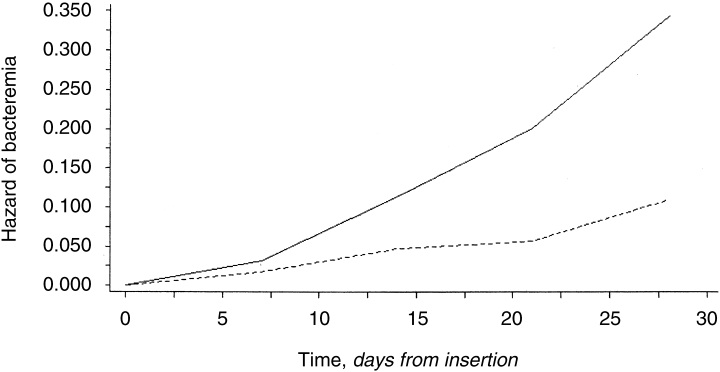
根据插入的位置和保留时间导致的菌血症的危险(实线为股静脉,虚线为颈静脉入路。经股静脉途径超过7天后菌血症发生率快速增加。对于颈静脉入路菌血症发病率在三周内尚可以接受)
1. National Kidney Foundation-Dialysis Outcomes Quality Initiative: NKF-DOQI clinical practice guidelines for vascular access. Am J Kidney Dis 1997 30( Suppl): S150–S191
2. Matthew J Oliver, Sandra M Callery, Kevin E Thorpe, Steven J Schwab and David N Churchill. Risk of bacteremia from temporary hemodialysis catheters by site of insertion and duration of use: A prospective study. Kidney International (2000) 58, 2543–2545
3. Cheesbrough, JS, Finch, RG, Burden, RP: A prospective study of the mechanisms of infection associated with hemodialysis catheters. J Infect Dis 1986 154:579–589
4. Levin, A, Mason, AJ, Jindal, KK, Fong, IW, Goldstein, MB: Prevention of hemodialysis subclavian vein catheter infections by topical povidone-iodine. Kidney Int 1991 40:934–938
5. Almirall, J, Gonzalez, J, Rello, J, Campistol, JM, Montoliu, J, Puig de la Bellacasa Revert, L, Gatell, JM: Infection of hemodialysis catheters: Incidence and mechanisms. Am J Nephrol 1989 9:454–459
6. Karakitsos D, Labropoulos N, De Groot E, Patrianakos AP, Kouraklis G, Poularas J, Samonis G, Tsoutsos DA, Konstadoulakis MM, Karabinis A: Real-time ultrasound-guided catheterisation of the internal jugular vein: a prospective comparison with the landmark technique in critical care patients. Crit Care 10:R162, 2006
7. Brzosko S, Hryszko T, Malyszko J, Malyszko JS, Mazerska M, Mysliwiec M: Femoral localization and higher ultrafiltration rate but not concentration of heparin used for canal locking of hemodialysis catheter are negative predictors for its malfunction. Am J Nephrol 28:298–303, 2008
8. Daeihagh P, Jordan J, Chen J, Rocco M: Efficacy of tissue plasminogen activator administration on patency of hemodialysis access catheters. Am J Kidney Dis 36:75–79, 2000
9. Vascular Access Work Group: Clinical practice guidelines for vascular access. Am J Kidney Dis 48(Suppl. 1):S248–S273, 2006
10. Parienti JJ, Thirion M, Megarbane B, Souweine B, Ouchikhe A, Polito A, Forel JM, Marque S, Misset B, Airapetian N, Daurel C, Mira JP, Ramakers M, duCheyron D, Le Coutour X, Daubin C, Charbonneau P: Femoral vs. jugular venous catheterization and risk of nosocomial events in adults requiring acute renal replacement therapy: a randomized controlled trial. JAMA 299:2413–2422, 2008
11. Kim SH, Song KI, Chang JW, Kim SB, Sung SA, Jo SK, Cho WY, Kim HK: Prevention of uncuffed hemodialysis catheter-related bacteremia using an antibiotic lock technique: a prospective, randomized clinical trial. Kidney Int 69:161–164, 2006
12. Weijmer MC, van den Dorpel MA, Van de Ven PJ, ter Wee PM, van Geelen JA, Groeneveld JO, van Jaarsveld BC, Koopmans MG, le Poole CY, Schrander-Van der Meer AM, Siegert CE, Stas KJ: Randomized, clinical trial comparison of trisodium citrate 30% and heparin as catheter-locking solution in hemodialysis patients. J Am Soc Nephrol 16:2769–2777, 2005
13. Allon M: Current management of vascular access. Clin J Am Soc Nephrol 2:786–800, 2007
14. Sznajder JI, Zveibil FR, Bitterman H, Weiner P, Bursztein S. Central vein catheterization. Failure and compli-cation rates by three percutaneous approaches. Arch Intern Med 1986;146:259-61.
15. Vanholder V, Hoenich N, Ringoir S. Morbidity and mortality of central venous catheter hemodialysis: a review of 10 years' experience. Nephron 1987;47:274-9.
16. Farrell J, Walshe J, Gellens M, Martin KJ. Complications associated with insertion of jugular venous catheters for hemodialysis: the value of postprocedural radiograph. Am J Kidney Dis1997;30(5):690-2.
17. Denys BG, Uretsky BF, Reddy RS. Ultrasound-assisted cannulation of the internal jugular vein: A prospective com parison to the external landmark-guided technique. Circulation 1993;87:1557-62.
18. Sim DW, Robertson MR. Right vocal cord paralysis after internal jugular vein cannu lation. J Laryngol Otol 1989;103:424
19. El-Shahawy MA, Khilnani H. Carotid-jugular arteriovenous fistula: a complication of temporary hemodialysis catheter. Am J Nephrol 1995;15:332-6.
20. Vanholder R, Lameire N, Verbanck J, Van Rattinghe R, Kunnen M, Ringoir S. Complications of subclavian catheter hemodialysis: a 5 year prospective study of 257 consecutive patients. Int J Artif Organs 1982;5:297-303.
21. Blake PG, Uldall R. Cardiac perforation by a guide wire during subclavian catheter insertion. Int J Artif Organs 1989;12:111-3
22. Merrill RH, Raab SO. Dialysis catheter induced pericardial tamponade. Arch Intern Med 1982;142:1751-3.
23. United States Renal Data System: USRDS, Annual Data Report. National Institutes of Health, National Institutes of Diabetes and Digestive and Kidney Disease. Bethesda, MD, April 1999http://www.usrds.org/1999_adr.htm (1999).
24. PY Fan, Acute vascular access: new advances, Adv Renal Replace Ther 1 (1994), pp. 90–98.
25. GB Lund, SO Trerotola and PF Scheel et al., Outcome of tunneled hemodialysis catheters placed by radiologists, Radiology 198 (1996), pp. 467–472
26. PV Suhocki, PJ Conlon, MH Knelson, R Harland and SJ Schwab, Silastic cuffed catheters for hemodialysis vascular access: thrombolytic and mechanical correction of malfunction, Am J Kid Dis 28 (1996), pp. 379–386.
27. MR Crain, MW Mewissen, GJ Ostrowski, R Paz-Fumagalli, RA Beres and RA Wertz, Fibrin sleeve stripping for salvage of failing hemodialysis catheters: technique and initial results, Radiology 198 (1996), pp. 41–44.
28. ZJ Haskal, VH Leen, C Thomas-Hawkins, RD Shlansky-Goldberg, RA Baum and MC Soulen, Transvenous removal of fibrin sheaths from tunneled hemodialysis catheters, JVIR 7 (1996), pp. 513–517.
29. AG Rockall, A Harris, CWN Wetton, D Taube, W Gedroyc and Al-Kutoubi, Stripping of failing hemodialysis catheters using the Amplatz gooseneck snare, Clin Radiol 52 (1997), pp. 616–620
30. RD Johnstone, AS Graham, JA Akoh, M Fleet, M Akyol and JG Moss, Percutaneous fibrin sleeve stripping of failing hemodialysis catheters, Nephrol Dial Transplant 14 (1999), pp. 688–691.
31. R Duszak, ZJ Haskal, C Thomas-Hawkins, RA Baum, RD Shlansky-Goldberg and C Cope, Replacement of failing hemodialysis catheters through pre-existing subcutaneous tunnels: a comparison of catheter function and infection rates for de novo placements and over-the-wire exchanges, JVIR 9 (1998), pp. 321–327
32. RS Garofalo, GX Zaleski, JM Lorenz, B Funaki, JD Rosenblum and JA Leef, Exchange of poorly functioning tunneled permanent hemodialysis catheters, AJR 173 (1999), pp. 155–158
33. Michael Merport MD, Timothy P. Murphy MD , Thomas K. Egglin MD. Gregory J. Dubel MD Fibrin Sheath Stripping versus Catheter Exchange for the Treatment of Failed Tunneled Hemodialysis Catheters: Randomized Clinical Trial. Journal of Vascular and Interventional Radiology Volume 11, Issue 9, October 2000, Pages 1115-1120
34. Jaber BL. Bacterial infections in hemodialysis patients: Pathogenesis and prevention. Kidney Int 2005;67(6):2508-19.
35. UK Renal Registry: New adult patients starting renal replacement therapy in UK in 2004.UK Renal registry report. Bristol, UK Renal Registry, 2005. chapter3, pp12-26.
36. Lok CE, Stanley KE, Hux JE, et al. Hemodialysis infection prevention with polysporin ointment. J Am Soc Nephrol 2003;14:169-79.
37. Katneni R, Hedayati SS. Central venous cathe ter related bacteremia in chronic hemodialysis patients: epidemiology and evidence based ma nagement. Nat Clin Pract Nephrol 2007;3(5): 256-66. |




