经皮血管成形术出现在60年代,当时首次应用的扩张导管是一种柔软度较差聚四氟乙烯(Teflon)共轴导管。如果需要增加扩张的直径就导致进入动脉的孔径增大,损伤也就大。另外,共轴导管在穿过病变的时候也导致不需要的撕裂力(shearing force)[1]。自从那以后,用于血管成形术的导管一直处在不断的技术进展中。
在70年代,这种聚四氟乙烯导管被改进成内置乳胶球囊增加了径向扩张力,虽然排除了早期技术中所产生的撕裂力,但应然需要较大的导管直径,而且所有这类导管仍然缺少弯曲性,限制了在很多血管的应用。聚氯乙烯(polyvinyl chloride ,PVC)替代聚四氟乙烯导管增加了球囊导管的可弯曲性,这导致了冠状动脉球囊扩张导管的诞生,除了显著增加了血管直径,改进了这一疾病的治疗技术。球囊血管成形术后来获得普遍的认可,目前广泛应用于各种器官的扩张,包括非血管器官的扩张。但人们不断地追求理想球囊导管的步伐并没有停下来。
球囊的性能参数:
1. 球囊外径(cross profile)是指球囊最大扩张时的直径。根据应用不同包括1.5mm~30mm不同。
2. 球囊的表面涂层:疏水涂层多用于球囊扩张支撑架内球囊;亲水球囊可增加球囊通过狭窄病变的能力。
3. 命名压(Nominal Pressure):指需要获得标签标识的充气球囊直径所需要的压力,命名压定义为99%的球囊均不会破裂的压力。
4. 爆破压(Rated Burst Pressure): 反复充盈球囊40次,在此压力下99%的球囊不会破裂。此为产品标识的重要内容,为术者提供一个安全的充气压力范围。RBP: 6~16atm
5. 平均爆破压(Mean Burst Pressure): 按统计学原理,球囊破裂的压力。定义为50%的球囊会破裂。
球囊性能的评价指标:
球囊导管的特性包括球囊顺应性和扩张力、圆周应力、球囊截面积、追踪力、抗折性、可推动性、球囊导管头的设计、球囊膨胀缩复次数、支架兼容性、以及赋予球囊PTA导管的其他功能
(1)顺应性(Compliance)
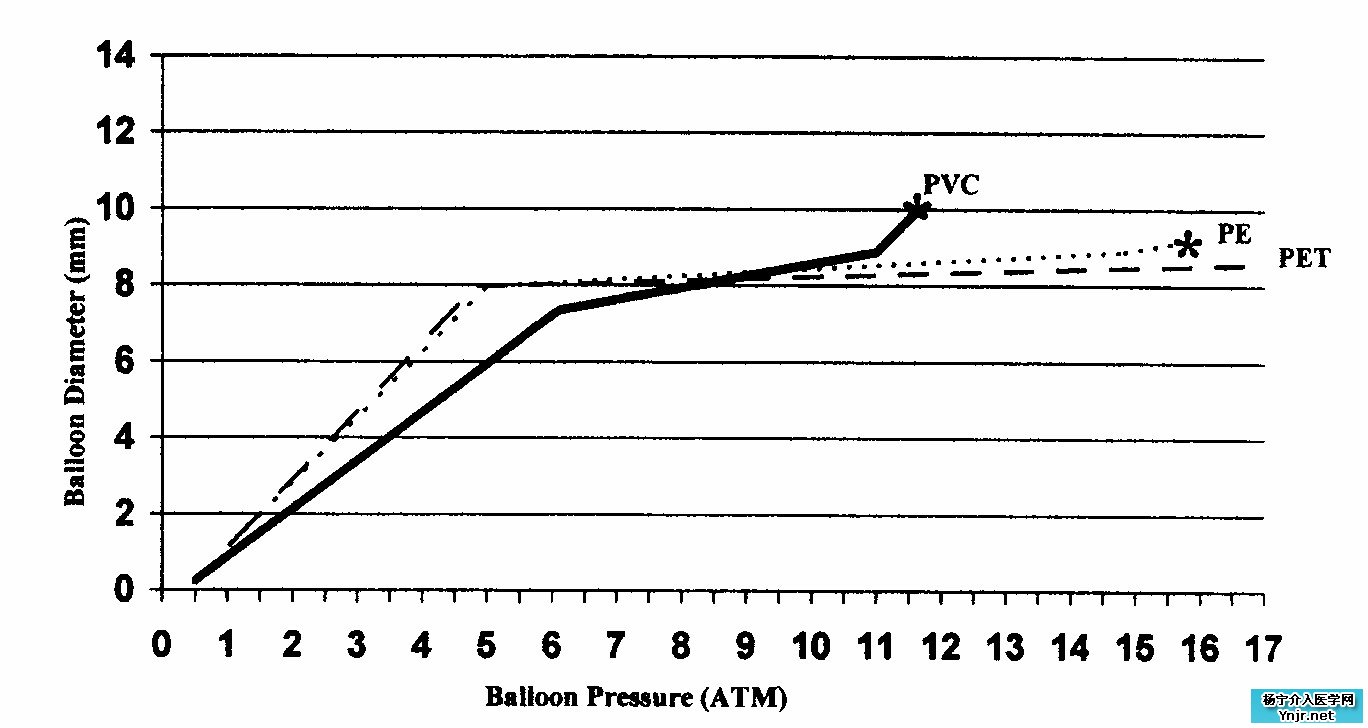
一般指球囊直径随着充盈压力的增加而增加的比率。从最严格的角度来说,顺应性是指在每改变一个单位压强时体积的变化值。对绝大多数PTA球囊导管来说,增加压强长度并不发生变化。因此,体积的变化主要体现在球囊直径的变化上。Gruentzig 最开始使用的球囊和所有早期的PTA球囊都是PVC材质的。而PVC材料以当今的标准而言是顺应性较大的球囊材料。这些球囊在施压时容易变形,并且在达到可拉伸强度极限(破裂)前直径明显增加。PTA 时的结果往往是球囊直径明显大于制造商所标称的数值。随着在严重狭窄部位施力的增加,顺应性球囊往往导致(1)难以预料的球囊直径;(2)非病变毗邻部位(例如,接触正常血管壁的部分)的血管的球囊材料过度伸展,导致(3)附近正常血管段的过度伸展和可能的破裂;(4)很差的球囊-病变界面的触感;以及(5)病变部位减弱的扩张力。
自从引入PTA球囊后,多聚物科学和技术的发展导致薄壁、顺应性较小材料的球囊产生,这些材料包括聚乙烯(PE)、聚对苯二甲酸乙二醇酯(PET)、尼龙和聚氨酯。这些材料顺应性比PVC小,一般来说较为适用于PTA(虽然其中PE是其中最柔顺的材料)。在达到破裂点前,无顺应性球囊直径的增加很少。因此选择匹配血管大小合适的球囊几乎能保证血管成形时不会发生血管破裂(透壁撕裂)。这种非顺应性球囊本身在超出张力极限时可能破裂,但这种破裂是纵向而不是横向的,从而撤出破裂的球囊时动脉血管可以保持完整。
血管成形时血管破裂最重要的原因是血管过度扩张。防止这种过度扩张的发生并保证能对病变部位施加最大扩张力最简单的方法是选择适当直径的无顺应性球囊。使用无顺应性的球囊行PTA,扩张力随着膨胀而压线性增加。除了理想的无顺应性PTA球囊,还可以选择顺应性有限的导管,或称半顺应性球囊。某些尼龙球囊制造商使用这种方法,他们生产的PTA球囊必须同时配合一个装置使用。因为球囊的顺应性曲线是精确和可重复的,选择任何球囊扩张压,球囊直径都可以知道。利用这种系统,可以通过选择想要的直径相对应的正确压力值,来扩张8.0mm直径的球囊到7.5或者8.5mm(或者需要的这两个极限值间的任意直径)。
(2)圆周应力(circumferential stress,hoop stress,peripheral stress)
球囊扩张时施加于球囊周表面的非放射状力称为圆周应力。因为压强等于单位面积上的压力,在压强一定时,表面大的球囊比表面小的球囊受到更大的圆周应力。圆周应力T等于压强P和球囊直径D的乘积:
T=P×D
对给定的球囊材料和膨胀压来说,球囊直径越大,其表面受到的圆周应力越大。因此,相同的材质,大球囊会在较小的压强下破裂。但是,由于上面提到的关系,对一个给定的圆周应力(T)来说,压强(P)和球囊直径(D)成反比。因此,对大球囊来说,要达到破裂的圆周应力所需要的压强相对较小。因此最大的球囊有最小的破裂压强值。市场上>20mm直径的非顺应性球囊爆破压多在4~6个大气压左右,而命名压仅为2~4个大气压;现有能承受20个大气压的所谓“高压球囊”多为直径在8mm左右的PTA直径相对小的扩张球囊。
(3)球囊截面积(balloon profile)
PTA球囊除了其顺应性,另一个重要的特性是球囊的截面积。一个5F的PTA球囊导管在其球囊部分可能是5.7F。现代PTA实施过程中都需要使用带有止血阀门和侧口的血管鞘以避免血管插入部位的渗血。球囊截面积小可以使用较小的动脉鞘避免局部穿刺部位的并发症和球囊穿过血管狭窄病变的能力。当然除了球囊截面,另外和穿过病变相关的因素是病变的表面特性和球囊表面的摩擦力。一些制造商通过给球囊表面增加亲水涂层来减少这种摩擦力。
某些血管太细,以致于这时候截面成了球囊导管最重要的特征。用于胫动脉PTA、儿科肾动脉PTA和肾分枝动脉PTA的小血管球囊导管使用3.1到5.0F范围的轴。根据球囊材料、直径和制造商的不同,这些球囊直径从1.5-6mm不等,并有6-16大气压的不同级别。心脏介入中同样存在截面的问题。PTCA中,冠状动脉中段到远端的某些严重狭窄不使用非常小截面的球囊导管是不可能穿过的。制造商应对这种挑战,最终生产出一系列的小截面PTCA球囊供选择。
介入医生也可以从一定程度上控制截面的大小。对包括那些回缩时明显会“变扁”的绝大多数球囊导管来说,逆时针方向扭转能最大限度地减少球囊截面。偶尔在狭窄处球囊导管不能循导丝推进时,通过逆时针旋转导管来使截面最小可以使球囊穿过病变。即使是球囊已经被回缩并且将要从血管造影鞘中移出的时候都必须考虑截面的问题。出现球囊导管不能从鞘中退出来的情况时,通常可以使用逆时针扭转的方法来解决。
(4)跟踪力(Tracking force)
追踪力是指PTA导管循着导丝通过弯曲路径到达病变部位而不使导丝移位的能力。在任何一种情况下,特殊的解剖结构、操作者的技术和经验和导丝-导管组合都影响球囊导管是否能到达血管狭窄的病变部位。早期行胫动脉与逆行髂血管成形术时,追踪力不是一个必须考虑的因素。因此相对较大而硬的PTA导管是完全可以接受的。正是由于这些硬质导管容易推进,它们可以穿过并扩张绝大多数病变。但是为了行跨越髂动脉到对侧股动脉的PTA、肾动脉和内脏动脉PTA,这样的导管显然不合要求,这就对制造商提出了新的挑战。
为了术者能顺利完成操作,导管的设计上需要有足够的柔顺性。导管的柔顺性很大程度上是通过制造商减小截面积来实现的。其主要是通过生产薄壁导管这样的手段。但是这样就不得不付出导管更容易弯折(kinking)和可推进性(pushable)减弱的代价。为了克服这一缺点,需要提高球囊扩张导管沿导丝前行到病变部位的能力。当前使用的多种导丝是现代PTA导管追踪力增加的另外一个原因。现在市场可以提供各种规格和型号可操控的交换导丝。理想的导丝头部具有安全的构型(J形),透视下可视性好,柔软,导丝的后部分设计较硬增加旋转控制力和可推行以使操作者通过病变部位,并能够增加球囊扩张导管跟踪导丝的能力。但是,实际上为了完成操作往往需要使用数根导丝。例如,行肾动脉PTA时,用一根Bentson导丝引导单弯导管穿过狭窄部位,需要导管头端形态和导丝软头能够很好的组合起来。一旦导管穿过病变,注射造影剂后,确定了在血管腔内的位置正确,Bentson导丝可以换成交换导丝或者其他有安全尖部的较硬导丝,PTA导管循着这个导丝穿过狭窄部位。追踪力差的球囊导管会把替换导丝从目标血管拉出到主动脉或者上一级动脉中,这样先前的选择性插管的努力全都白费了。
(5)抗折性(antikinking property)
PTA术前血管造影常常发生血管病理性迂曲或生理状态下的成角。在理想情况下要通过弯曲血管路径和严重狭窄部位,即使球囊导管通过一个小半径曲线时,导管轴应该不会弯折。尽管现代导管技术中经引导导管和导丝技术引导下的PTA技术使这种情况发生较少。但有时仍有情况需要操作者需要把导丝临时抽出来,通过球囊导管的导丝通道注射造影剂进行PTA术后动脉造影。当导丝抽出时,导管轴(包括球囊腔、导丝腔)最容易弯折。
行跨越迂曲和成角的动脉行PTA或者其他操作时,大多数5F的PTA球囊导管都存在这种弯折的问题。发生弯折后,有时可以在插入导丝的同时稍微将导管推出或退出一些来解决这个问题。还有数种方法可以避免这种情况的发生。一种方法是在狭窄远端放置一根软头的较硬的和较细0.018英寸导丝,并用止血阀门把一个Y阀固定在PTA球囊导管的注射口。然后沿着这根导丝将PTA球囊导管放置到位,Y形连接器的侧口可以用于注射造影剂、硝酸甘油、盐水或其他液体。第二种方法是用跨越髂动脉导丝或血管鞘来扩宽这个转弯(增加转弯的半径),再使用5F球囊导管来行对侧操作。这样或许可以避免弯折的发生,但是就失去了穿刺部位的小截面优势。
实际上导管壁太薄的时候所有的材料都很容易弯折。但是当导管壁厚度一定的时候,不同的材料有不同的抗折性能。编织导管抗折性能可能最强,但是截面较大、沿导丝跟踪力有限。5F的编织导管加上PTA球囊腔后截面远远大于5F,也会比非编织导管追踪力差。所以,虽然一些鞘、引导导管和许多选择性导管是编织状的,球囊PTA导管杆一般不用编织方式。
总之,用非常薄的材料生产的小截面球囊导管容易弯折,特别是在通过小半径转弯和导丝被抽出的时候。目前尚无完全抗折、小截面的PTA导管。最好的防止弯折的方法是使用上面描述的技巧。
(6)可推动性(pushable)
在跨越髂动脉分叉行对侧股腘动脉PTA、胫动脉PTA、肾动脉和内脏动脉PTA以及现代颅内动脉PTA中都存在可推动性的问题,但是这个问题最早提出是在PTCA,而不是PTA。截面非常小的PTCA导管或许不存在到达严重狭窄部位的困难,但是如果导管可推动性很差,或许不能够通过狭窄。为了解决这个问题,制造商现在已经生产出了球囊头(引导头)非常软而导管轴相对较硬的导管,使末端能够被推动。最新的进展是所谓单轨球囊导管,又称为快速交换导管,该导管分硬质部分与软质部,中间存在一部分移行区,以增加导管的可推动性而又不容易弯折。PTA导管的可推动性改变了过动脉弯曲时的PTA操作以及外周PTA时遇到的大多数情况。这样,术者就能够利用导管的硬质部分来支撑导管,并在导丝的引导下推动球囊导管通过狭窄病变。要想推动导管通过病变区,支撑导丝是非常重要的,这在再通慢性闭塞性髂动脉和支架放置PTA术中的推进技术有很典型的体现。
(7)球囊导管头的设计
球囊导管头应该逐渐变细来适应导丝并帮助导管穿过狭窄处。体积过大或者末端移行不好的头部形态设计使导管即使是有硬质导丝引导也难以穿过严重狭窄部位。形态不好的头部和推进性差的轴组装起来的导管特别不利于操作。球囊导管头的长度是另一个主要性质。许多操作,比如髂总动脉的逆性球囊PTA,导管头可能不是问题。但是在那些远端分枝血管容易被导管头损伤(对肾动脉和胫动脉进行操作)时,需要使用短的球囊导管头。
(8)球囊缩复时间
虽然PTA导管膨胀缩复过程中流经球囊的稀释造影剂“流量”不是层流,将它想像为层流有助于我们理解影响实际观察到的膨胀缩复次数的因素。现代PTA导管截面小,有相应的小直径球囊或通道。液体“流量”与通道半径的4次方成正比,与导管长度成反比。因此,如果我们比较两根PTA球囊导管,球囊直径均为12mm,而长度一根为40cm,一根为80cm,我们可以发现80cm长的导管复缩所需时间大约是40cm长导管的两倍。
(9)支架兼容性
可以认为支架兼容性是决定球囊导管是否可用于球囊扩张支架运送装置。现在以Palmaz球囊扩张腔内支架(Johson & Johnson系统)为代表的多种球括支撑架用于人体血管狭窄的治疗,其他的支架也正在开发中。这些用于外周血管成形的支架应该具有如下性能:
(1)加挂上支架后拥有足够小的截面使之能够穿过带止血阀的7F以下的血管鞘
(2)穿过导管鞘和展开支架时支架不会从球囊表面滑脱,和球囊具有抗刮擦能力。
大多数5F PTA球囊导管符合上面的截面标准,并且实际上所有的这些球囊都可以通过手动卷曲支架来避免它穿过导管鞘到达目的位置时滑脱。但是,球囊开始膨胀后仍然可能发生两个严重的问题。第一个问题是,为了减少摩擦增加病变穿透性而加有涂层的球囊,可能发生支架的滑脱。因此,最好不首先选择这些球囊来展开支架。第二个问题是球囊破裂。容易被刮擦破的球囊可能发生这种情况,这些球囊在被支架或者甚至被锐利钙化的硬化斑块刮擦都容易破裂。展开支架时球囊破裂以及支架从球囊表面滑脱都可能导致支架遗失在血管中或者非目标血管中。虽然还没有严格设计的对照试验来比较使用不同球囊来展开支架的安全性,但是许多经验丰富的介入学专家认为Duralyn(尼龙材质)球囊是最抗刮擦的球囊(展开支架时很少出现破裂口和操作失败),然后是PE材质的球囊。在外周PTA中最常用使用的球囊中,PET球囊最抗刮擦。使用PET球囊展开支架时大约有30-40%的球囊破裂并需要更换球囊导管。使用Duralyn球囊,破裂仍然会发生,只是发生的几率小很多(约为展开支架的5-10%)。正因为这个差别,Duralyn是制作支架展开球囊材料最好的选择。有时甚至可以在一次操作中使用一根5F Duralyn球囊放置了5个髂血管支架。
(10)球囊PTA导管的其他功能
近年来,血管成形术后再狭窄发生率高,治疗再狭窄增加个人及社会经济负担,以及随后病人行血管再通术的各种风险增加,引起研究者对减少和消除这些问题的基础和临床研究的兴趣。研究方法包括工程学(支架、腔内斑块旋切术)、药理学甚至遗传学。现在的理论认为PTA术后生长因子使动脉中层平滑肌细胞(SMC)发生性质改变,由原来的收缩细胞表型转化为合成细胞表型。这些转化了的平滑肌细胞移行到内膜层,合成的基质构成了内膜新生组织体积的90%。后者是多数再狭窄发生的原因。
已经研究的细胞毒性药物以及其他能够抗增殖的物质能够防止再狭窄,但是由于这些药物大剂量对病人的毒副作用太大,许多不能够静脉注射。包括寡肽、寡核苷酸等的多种其他药物会被消化酶消化,以及胃和肠道多种不同pH值的影响,不能口服。所以,研究者将兴趣放在了在行PTA同时直接将药物送达目的位置。自然我们会考虑将PTA球囊作为实现这一目标的载体。这类实验使用了能够作为药物载体的水凝胶包被的血管成形球囊。另外一些研究者在实验中使用多种微孔球囊导管来把药物送达血管壁。
也可能利用血管成形导管对血管壁释放能量来防止或者抑制再狭窄。有人使用特殊改造的血管成形导管释放射频能量来封闭PTA导致的血管夹层,并用它来重塑血管壁又不产生血管夹层。通过光纤释放激光的方法也被用来减少再狭窄。
最后,也有人提出通过球囊运送在血管内会凝固的液体多聚物并“铺平”PTA损伤的血管壁,然后将血管壁和周围的生长因子以及其他可能导致再狭窄的物质隔离。同时,“铺平”血管壁能够防止PTA引起血管夹层后导致血管闭合。这些多聚物包括聚乳酸和其他人体能够降解的物质。虽然这些物质的力学性质给放置支架增加了难度,但是它们却提供了一个临时的支撑结构而不必取出。
(11)新的球囊技术
目前正在开发新的球囊技术以防止血管内介入治疗的慢性并发症:血管夹层、血栓形成、远端栓塞以及再狭窄。这些技术包括低温球囊和切割血管成形球囊。低温球囊除了具有其他导管的机械血管塑形作用,还能够把附近组织温度降至-10℃。实验证据表明这种低温可以诱导组织凋亡或者程序性细胞死亡,进而减少狭窄。这种技术对治疗透析移植血管顽固性反复狭窄有预防作用。切割球囊血管成形术,在冠状动脉和外周循环动脉中均可使用,用于血管内近距离治疗后血管顽固性狭窄或者透析用动静脉瘘反复狭窄病人的治疗。
(12)关于球囊导管的术语
所有的介入学专家在临床描述、学术报告、操作或口头演讲中与同事或者助手交流都需要能够描述球囊导管的各个部分。在进行关键操作步骤时介入操作者都不可避免地需要描述球囊导管的近端和远端。而且操作者会觉得难以确定球囊的哪一端是近远端。例如,为治疗布加综合征,在下腔静脉和右心房连接部进行PTA操作,如果球囊是通过股静脉插入的,球囊有部分穿过腔静脉和心房连接部,部分在右心房内,还有部分在下腔静脉内,那么球囊哪一端才是近端呢?如果说在下腔静脉内的部分是近端,那么会把最靠近操作者的球囊端认为是近端。但是,事实上没有解剖学参考点近端这个词是没有意义的。选择了参考点后,近端通常是指最中央的部分;因此,近端应该指的是右心房内的那一端。问题是导管本身不是解剖学部位,不可能有近端或者远端。
应该放弃使用近端和远端这样的词,而使用实际操作中大家都能认同的词,应该用头和尾。任何需要描述使用的导管时候或者关于它的一部分的时候,用头尾端较为简单。例如,在刚才提及的情况下,用这些词来精确地描述球囊导管上的不透光标记应该是:“导丝头位于上腔静脉中,球囊导管尾部标记放置于狭窄的腔静脉心房连接处2cm下方,而头部标记位于心房内。”这个命名法同样适用于导丝和诊断性导管。
支架和其他需要展开的设备较为特殊。上述命名可以用于放置于导管上面和展开时的支架。只要支架放置于运送导管上,就有头和尾端,在放置前都可以参照。展开后,支架不再需要操作者或者其他进一步的干预,应该使用人体或者体腔的解剖定位标志。上面的例子中放置支架时,接近导管头端的支架部分是支架的头端,接近导管尾端的支架部分是支架尾端。支架展开后,头尾端就没有意义了。导管的心房端是近端,下腔静脉端是导管远端。这个原则同样适用于下腔静脉滤器和其他放置在人体内的装置。广泛接受这些简单的术语规则会明显增进我们关于装置和方法口头和文字交流。
小结
在球囊血管成形术出现后的不到20年时间里,球囊导管和导丝技术根据临床需要和市场竞争不断进步。现代外周PTA球囊导管具有高压、低柔顺性、有限柔顺性、小截面、可引导、可推动以及(对某些球囊来说)抗刮擦的性能。可以买到各种专门的可转向、不透光、硬质、松软以及不同硬度的导丝。常用的导丝有0.014-0.018英寸的小血管球囊导管导丝和0.035-0.038英寸的小截面5F球囊导管。将来的技术发展主要集中在提高抗折性、抗刮擦性、支架兼容性和可运送治疗药物、基因、可生物降解或者可生物吸收支架的球囊开发。研究也应该关注将所有的球囊功能缩小用于颅内介入治疗。
1. Becker GJ. Balloon angioplasty catheters. In: Baum S, Pentecost MJ, eds. Abrams' Angiography Interventional Radiology. 2nd ed. Philadelphia: Lippincott Williams & Wilkins; 2006:Chapter 12.
2. Grüntzig AR, Senning A, Siegenthaler WE. Nonoperative dilatation of coronary-artery stenosis: percutaneous transluminal coronary angioplasty. N Engl J Med. Jul 12 1979;301(2):61-8. [Medline].
| 

