名词:经皮血管成形术(Percutaneous Transluminal Angioplasty)是指经皮经导管在狭窄的血管内置入球囊装置,通过充盈球囊控制斑块破裂以恢复血管生理性腔径改善血流。
历史上采用经皮插管方式经腔治疗动脉硬化性阻塞性疾病首先由Dotter 和Judkins在1964年报告【1】。
早期使用逐渐变细的特氟纶(聚四氟乙烯)共轴扩张导管的技术扩张血管(上端约12F,下端8F)
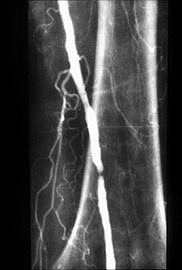 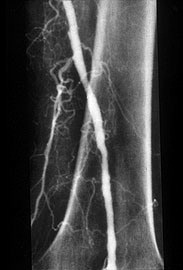
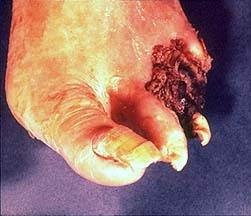
事件起源于Dotter医生医院内的一位医生糖尿病足,足趾溃烂。血管造影显示股浅动脉中段狭窄。采用上述共轴扩张导管实施扩张后,就诞生了历史上首例经皮血管扩张术的病例。
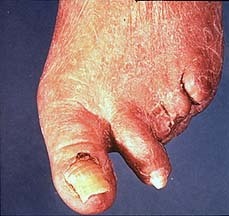
术后那位医生的足趾溃疡得到愈合
在Dotter医生和Judkins医生介绍了经皮腔内血管成形术(PTA)后的约十年时间里,美国和世界上的大多数国家很少关注这种革命性的治疗性导管技术的运用,但Zeitler及其同事使这个方法在欧洲保持了生命力。Dotter、Judkins、Zeiter 和该邻域的其他数位先驱者积极推广同时,他们也意识到,这项使用逐渐变细的特氟纶(聚四氟乙烯)共轴扩张导管的技术对可治疗的血管大小有非常实际的限制。血管越粗,所需要的导管轴也越粗。这就意味着需要把穿刺部位扩张得相当大才能治疗较大动脉病变,结果当然就是穿刺部位发生并发症的危险就更大,特别是血肿和假性动脉瘤形成的危险。Dotter 和 Judkins医生 在他们的实际操作中很早就意识到这个问题,他们描述了真实地描述了这种情况,并预测将来可能发展出一种径向膨胀的导管来治疗动脉狭窄。
1968年Staple[2] 报告改良导管用于治疗动脉硬化性阻塞性疾病。代替 Dotter 共轴双导管系统,Staple用单支8、10或12F导管逐渐被拉细(tapering),导管头部刚好通过直径0.038''导丝。比较Dotter & Judkins导管,Staple 导管的理论上的优点是由一支导管逐渐拉细可以消除“非渐细”外套管对内膜的损害,即所谓铲雪效应(snowplow effect)的减少。
不知道为什么Staple使用的导管后来被称为 van Andel锥形导管。特别是自从van Andel论文引证了Staple工作并改良了他的方法以后[3]。现在COOK 公司产品网站上 产品分类表中有关 van Andel 扩张导管仍然写着“用于扩张髂动脉、股浅动脉和腘动脉(Used for dilatation of the iliac, superficial femoral and popliteal arteries)”。在使用方法介绍中写着“通过交换导管的完成(血管)逐渐扩张(Progressive dilatation is accomplished by exchanging one catheter for another)。不知谁还会用这样由细到粗的交换导管的方式去扩张一支血管。或许仅仅是一个不可忘却的纪念,这个产品还挂在产品分类栏目中。
COOK产品分类表上van Andel 扩张导管
|

|

|
|
Used for dilatation of the iliac, superficial femoral and popliteal arteries.
-
Progressive dilatation is accomplished by exchanging one catheter for another.
-
A van Andel catheter may be used for pre-dilatation prior to use of a balloon dilatation catheter.
|
Used for percutaneous placement of external and internal drainage catheters constructed from softer materials.
-
van Andel dilator provides easy advancement of sheath assembly through fascial tissue and strictured areas.
|
Van Andel 导管(COOK)
|

|
|
|
Gruntzig 和 Hopff [4] 引入球囊导管室在1974年。这种“僵硬(rigid)”球囊是由聚氯乙烯制作的。由于其低顺应性,其可以应用4-5大气压使球囊扩张到预定的4-8mm直径很少有球囊破裂和血管过度膨胀的危险。和以前的系统比较球囊导管明显的优势是7F的导管可以扩张12F直径的血管,减少了血管穿刺部位的并发症发生率。
Dotter 和 Judkins [1] 共轴导管扩张血管狭窄的方法并没有在美国被广泛的接受,但在欧洲获得推广,并介绍他们的经验[5]。Gruntzig-Hopff 球囊导管发明后的3~4年,“球囊热”开始在美国得到传播,成为介入放射学领域内最先进的治疗技术[6,7]。我们只能推测美国这种经皮导管血管再通术的“慢热型(delayed enthusiasm)”是由于球囊导管引进到其它相关因素。有兴趣的是正当美国经皮血管成形术走红的时候,作为超声和CT广泛应用的结果,诊断性血管造影的例数不断地下降。
当年,Dotter-Judkins共轴Teflon 导管和Staple-van Andel 改良的锥形Teflon 导管一直和继续以各种大小不同的大小(French)在应用。而Porstmann [8]发明的用于扩张髂动脉病变的一种称为“笼”的球囊导管开始。Dotter虽然继续使用他的同轴导管系统扩张股腘动脉,但他更喜欢髂动脉球囊导管。
除了对大小的限制,共轴导管相对的不灵活限制了它只能在特定的解剖区域导入并治疗。用一根这种导管到达肾动脉是非常困难的,而到达冠状动脉病变部位更是难以想象的。在20世纪60年代中期,这种共轴扩张导管的设计缺少柔软头部结构、没有可转向和高度不透X光的导丝,缺少扭矩校正导管和引导导管,辅助药物治疗的相对缺乏,这些都是限制。面对这些限制,Dotter 和 Judkins 仍然预测血管成形术将运用于冠状动脉、肾动脉和颈总动脉。相对于建立先进的心脏和各种血管治疗导管室在时间上来说都相对太早。
问题不止于此,共轴扩张导管法不仅对病变部位的血管壁施加辐射状力,同时也产生一种非常不利的剪切力。因此,人们努力发展一种导管,在把这种导管送至动脉粥样硬化病变部位以后,可以径向扩张,并能够使斑块变形或者塑性,最终扩张血管腔。这些想法就是早期PTA球囊的前奏曲。
1974年,Gruntzig 提出经皮经腔球囊血管成形术(Percutaneous Transluminal Angioplasty, PTA)以来,该项技术已经发展成为几乎所有血管领域里,为治疗动脉狭窄或阻塞性疾病的方法中最有价值的一项微创技术。经皮腔内血管成形术(PTA)曾经在血运重建的治疗历史上发生爆炸式的增长。并在当时引起临床医生和病人的广泛兴趣和接受。
到现在为止球囊导管的各种设计和技术参数的不断改进,促进了PTA在很多不同领域内的应用。当选择球囊导管扩张时,球囊大小、顺应性、扩张力和爆破压都是其中需要考虑的重要参数。
球囊的顺应性由球囊压力与直径的变化所决定的。典型的球囊由PVC、尼龙(nylon)或聚四氟乙烯(polytetrafluoroethylene ,PTFE)材料制成。尼龙的顺应性最小。理想的球囊导管可以提供充分的压力减少狭窄“腰”同时不会过度扩张或扩张在正常血管直径之下。非顺应性球囊可以被充盈较高的压力而相对较小的球囊直径变化。
PTA 的机理
PTA的目标是通过球囊扩张形成的对动脉壁的压力超过了含有斑块的血管壁的抗张强度来重建血管的生理腔隙的直径。
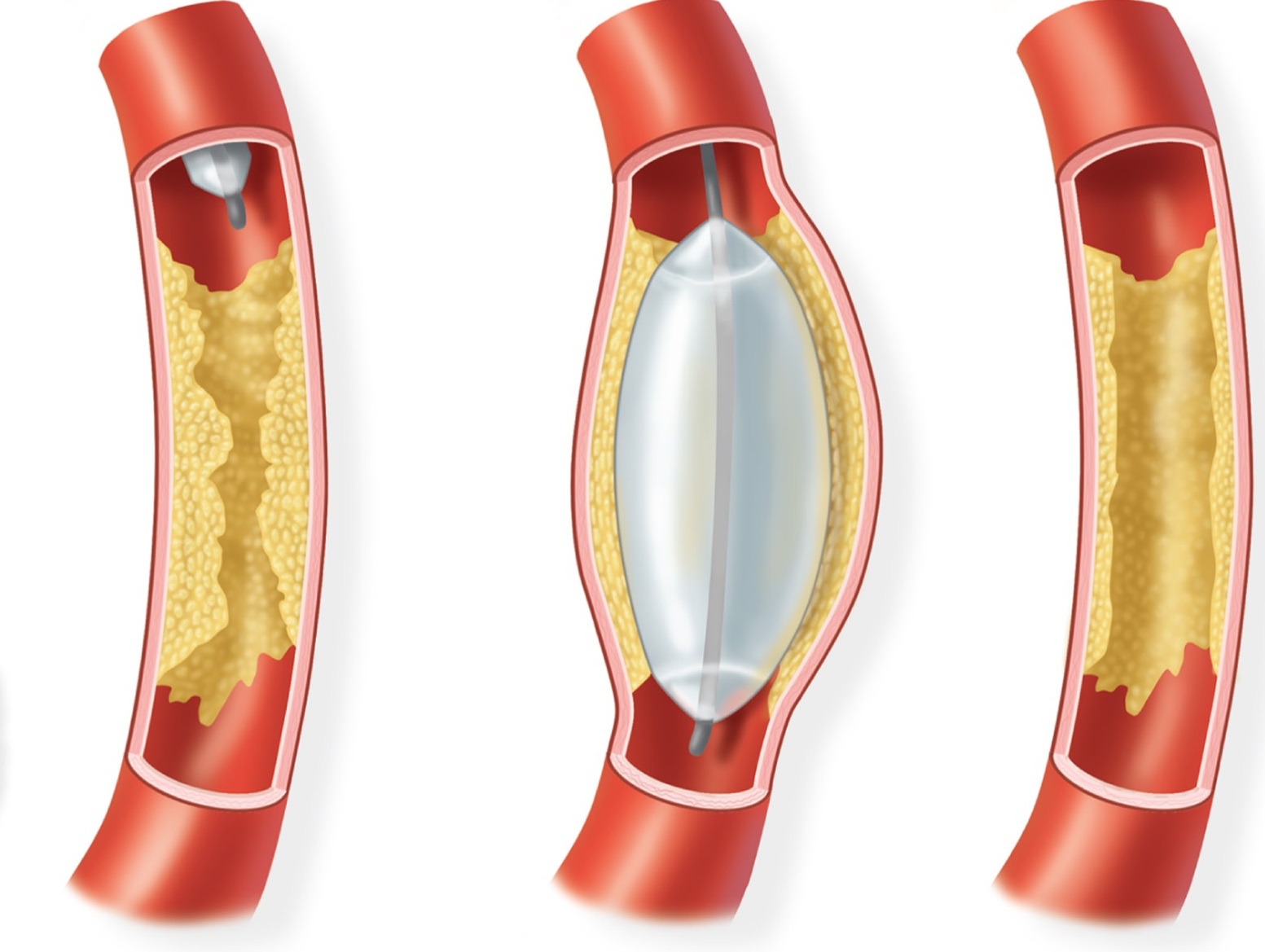
关于PTA的机制有不同的观点。最早Dotter 【1】认为PTA的机制是造成血管壁狭窄的动脉粥样硬化斑块被压缩后重新塑形和斑块血管壁下再分布。1980年以后,Castaneda-Zuniga 等人【2-5】通过尸体解剖,动物实验模型以及PTA后的病理标本的研究,深入观察PTA血管扩张血管壁组织修复过程,提出了目前普遍接受的PTA原理。
动脉壁的结构由内膜、中层和外膜组成。球囊扩张引起的主要的病理学变化是发生在内膜和中层。 扩张后最初内皮层损伤,暴露了破损的内弹力层。血小板在10分钟内聚集在损伤的内膜上。30分钟内血小板细胞脱颗粒(degranulation),一周时,新生内膜开始形成,1-2月损伤表面完全再内皮化。中层是由弹性蛋白,胶原蛋白和肌纤维组成。球囊扩张后的中层过度延展,导致中层各种成分的广泛破坏,同时也失去弹性。特别是肌细胞的损伤,它们的细胞核在组织学上的破坏,提示这是一种持久的损害。肌细胞的损害是血管成形术机理的基础部分。弹性纤维的延展和破碎也在这时发生。经过3天,来自损伤和死亡的肌细胞的碎片被清除。在第一周的末期,中层以肌纤维母细胞浸润的形式重建中层,以此基础上发生新的肌细胞形成和胶原增生。这一过程持续3-6个月。球囊充分的扩张到中层的破裂仅存留浆膜保护血流通过。这种情况下中层由疤痕修复愈合。
首先斑块被压缩,接下来,它被压破裂,并且粥样硬化的物质被压入血管壁中。进一步,血管在被扩张的部位被拉长,导致内膜和中膜内层部分的非弹力成分的被控制下的撕裂,而血管中膜的外层和外膜由于其的弹力层而完整无损。如果残余的血管壁的弹力成分导致动脉的弹性回缩,或内膜的剥离,PTA的结果可以是无效的。二者均可导致残余的狭窄,这种残余的狭窄可以通过再次的经皮穿刺扩张来治疗,如果仍无效,可通过支架术来治疗。
文献中关于PTA机理的论述
气囊扩张在分离狭窄硬化的内膜的同时可以破坏中膜平滑肌弹力层和胶原纤维,使动脉粥样硬化斑块断裂,中膜延伸;
而自1987年以来,支架血管内植入技术得到发展,大大提高经皮经腔血管成形术的效果,并克服了 PTA 技术的不足。作为曾经辉煌的普通PTA血运重建的治疗技术逐渐走入历史,但其历史上的功绩是不可磨灭的,并为后来冷冻球囊,切割球囊和药物洗脱球囊的技术发展提供了基础。
几乎所有采用经皮方式被治疗的病变均为粥样硬化性血管病,但是一些少见的病例是由于动脉炎,自发或创伤性动脉夹层,或肌纤维发育不良造成的。此外,PTA和支架术也用于治疗在以前的PTA或其它血管内操作包括血管外科手术之后发生的再狭窄。
PTA 和支架术应被理解为是一种纯粹的姑息治疗方法,他能够促进血管的灌注和治疗症状,但不能治疗其基础病动脉粥样硬化性疾病。因此,动脉粥样硬化的进展和疾病复发的频率是不能单独被PTA所影响的。它只是通过治疗后通过获得临床症状和体征的改善,生活质量可以得到提高的。四肢严重缺血的周围血管疾病中,治疗还存在着一种抢救患肢和预防截肢的选择倾向,或者至少大的节肢可以被减少。在复杂和大范围的疾病中,经皮血管内操作可以与传统的血管手术相结合。
1. DOTTER CT, JUDKINS MP. TRANSLUMINAL TREATMENT OF ARTERIOSCLEROTIC OBSTRUCTION. DESCRIPTION OF A NEW TECHNIC AND A PRELIMINARY REPORT OF ITS APPLICATION. Circulation. 1964 Nov;30:654-70.
2. Castaneda-Zuniga WR, Formanek A, Tadavarthy M, Vlodaver Z, Edwards JE, Zollikofer C, Amplatz K. The mechanism of balloon angioplasty. Radiology. 1980 Jun;135(3):565-71.
3. Zollikofer CL, Chain J, Salomonowitz E, Runge W, Bruehlmann WF, Castaneda-Zuniga WR, Amplatz K. Percutaneous transluminal angioplasty of the aorta. Light and electron microscopic observations in normal and atherosclerotic rabbits. Radiology. 1984 May;151(2):355-63.
4. Zollikofer CL, Salomonowitz E, Sibley R, Chain J, Bruehlmann WF, Castaneda-Zuniga WR, Amplatz K. Transluminal angioplasty evaluated by electron microscopy. Radiology. 1984 Nov;153(2):369-74.
5. Lyon RT, Zarins CK, Lu CT, Yang CF, Glagov S. Vessel, plaque, and lumen morphology after transluminal balloon angioplasty. Quantitative study in distended human arteries. Arteriosclerosis. 1987 May-Jun;7(3):306-14.
|