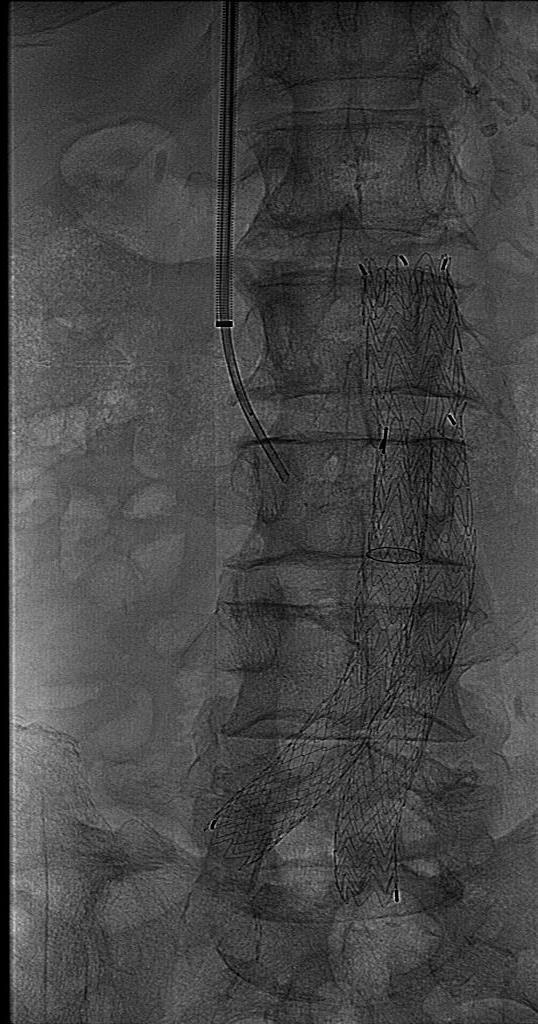
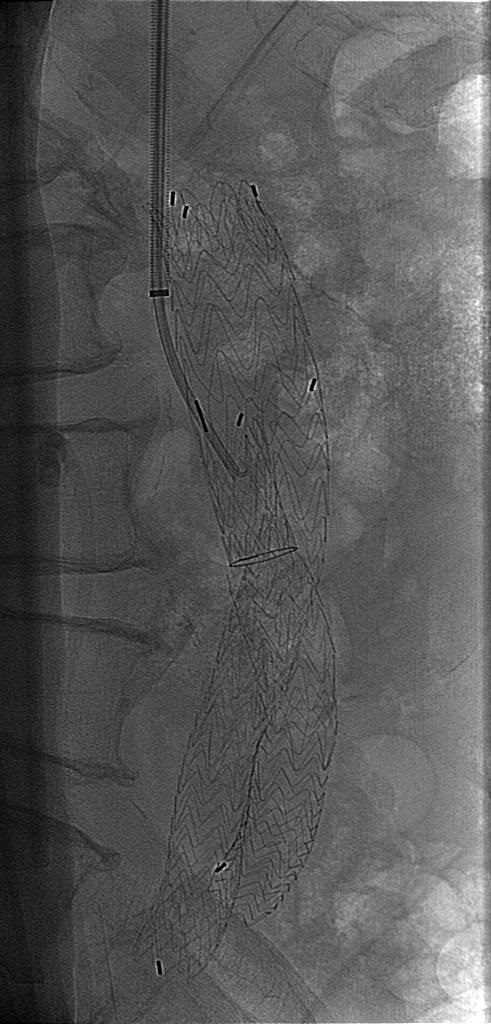
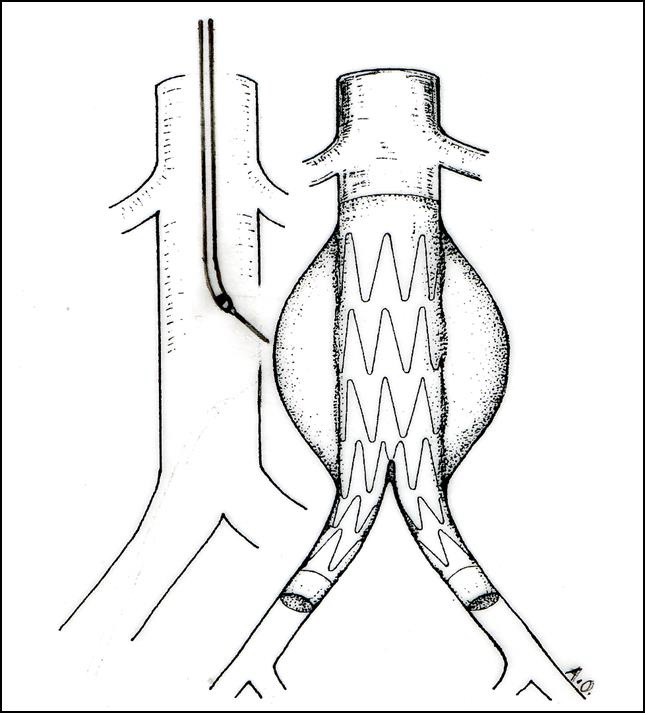
同传统的修复方法一样,EVAR的目的是要将动脉瘤囊从体循环中隔离出来,这样就能防止其持续扩张以及最终破裂。而与传统修复方法不同的是,约有三分之一的病人将会有血流从装置周围进入动脉瘤囊中(内漏)。这就需要腹主动脉支撑架植入后按要求定期进行CT扫描来证明动脉瘤囊仍然被成功地隔离在体循环外。内漏的定义是“持续的血流出现在内皮化的移植物管腔外,但仍然在动脉瘤囊或经过移植物治疗的临近血管节段以内[2-4]”。要对这一现象有更好的理解,制定了一套分类系统,其中根据内漏的来源将它们分为4种类型。重要的是记住,无论哪种类型,所有的内漏都是将体循环压力传导到了动脉瘤囊内。在内漏的诊治过程中确定内张力(endotension)也是非常重要的。还有人专门为此写了一部专著。
所谓“内张力”是指在无肉眼可见的穿过支架移植物灌流的情况下瘤体仍继续增长,有作者将其归为V型内漏[5]。一些病例虽然支架移植物植入成功,但瘤腔内压力仍然偏高,瘤体仍会继续增长。这一现象和瘤腔内持续存在的内张力(endotension)有关。
 |
 |
|
|
编辑 |
Ⅰ型内漏
如果血流是从支架移植物的结合部位(近端或远端)周围进入动脉瘤囊内的,就被称为Ⅰ型。这种现象表明支架移植物没有能封闭住自身的动脉壁,造成了和体动脉循环的直接相通。这种类型的内漏很少见,发生在3-5%的病人中。可以采用球囊,支架,以及延伸袖套将不起作用的一段移植物固定到动脉壁上。在EVAR术后,观察到很多持续的主动脉颈扩张。这可能是造成近端Ⅰ型内漏的潜在原因。
Ⅱ型内漏
这是最常见的内漏类型,发生率在20%左右。由于主动脉支架移植物植入后,瘤囊内的压力下降,被修复段的原主动脉分支血管内的血流逆向流动最终注入覆膜支架移植物后面的动脉瘤囊时,就会发生这种现象。而在支架移植物植入前这些分支是将主动脉血流输送到阻力较低的营养血管床中。支架移植物植入后如果这些分支血管仍然保持开放血液逆流就不可避免。在腹主动脉瘤支架移植物中最常见的导致逆流的血管包括肠系膜下动脉和腰动脉。当血流从血管内修复区近端或远端的主动脉分支血管流出,进入与动脉瘤囊直接相通的血管,如此还可以形成一个环路。
II 型内漏
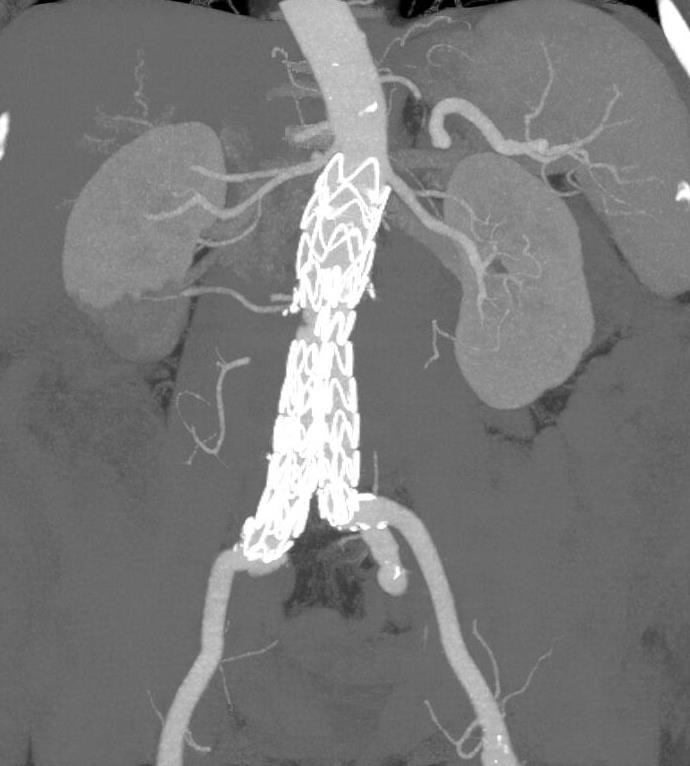 |
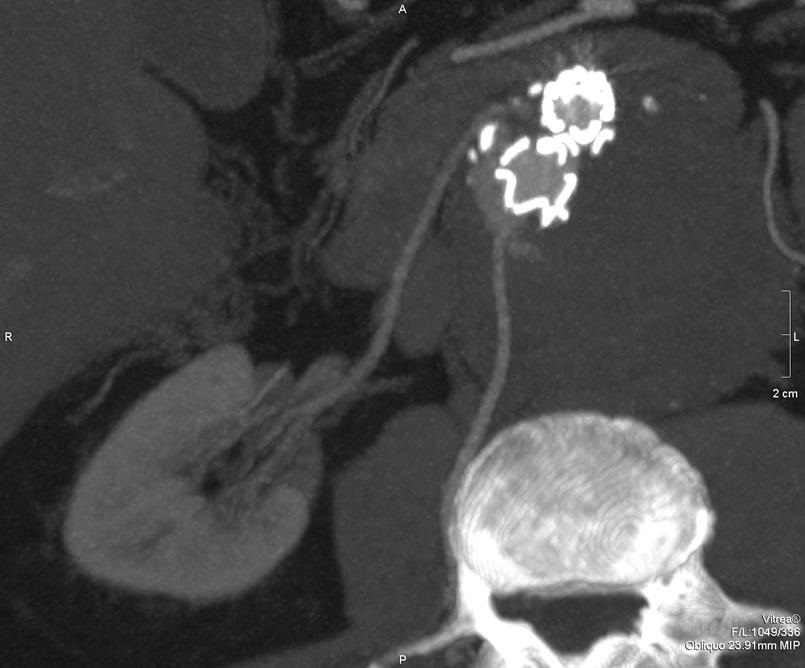 |
|
|
|
侧支内漏(Ⅱ型)有两种不同的形态学类型。这对于出现此型内漏的病人的治疗方法很有意义。在第一种类型中,血液是从单支主动脉分支血管逆向流入动脉瘤囊的。血液在收缩期进入内漏腔,在收缩期保持在内漏腔里。血液进出内漏都只有一个通道。在内漏腔内的血流本身是缓慢而紊乱的。这种类型的侧支内漏被认为是“简单型”。将这种类型的内漏同其它类型区分开来是很重要的,因为它有更加良性的发展过程。
侧支内漏的第二种具有“复杂”的解剖结构。在这种类型的内漏中,有一支主动脉分支血管将血液注入动脉瘤囊和内漏腔内,还有另一支主动脉分支将血液引流出去。因此,血流是由多个潜在的进入和流出的通道而直接穿过动脉瘤囊的。
尽管两种类型的内漏都有体循环压,但与每一种侧支内漏相关的生理过程可能是很不相同的。在侧支内漏简单型中的血流于假性动脉瘤类似。血流在腔内形成涡流,并且通过进入的同一个出口流出。同少数几个假性动脉瘤一样,有人认为许多简单侧支内漏最终会形成血栓。如果情况是这样,就可以解释为什么一些内漏能够自发地形成血栓,而其它的则会继续增长、扩大。更进一步,就提出了这样一个问题:为什么有一些有内漏的病人动脉瘤持续扩大,而另一些病人的动脉瘤囊却缩小。
相反,复杂的Ⅱ型内漏有多支血管将血流引入漏腔,又有多支血管将血流引出漏腔。这种内漏具有高度动态的结构,常常引入新的供血血管,内漏腔进行重塑。这种内漏的行为类似于动静脉畸形。这种内漏内部的血流很急,预计随时间延长,这种内漏不会形成血栓,并且动脉瘤囊可能扩张而导致将来破裂的危险。
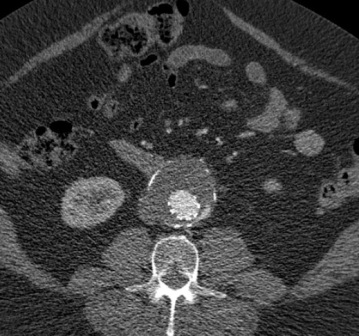 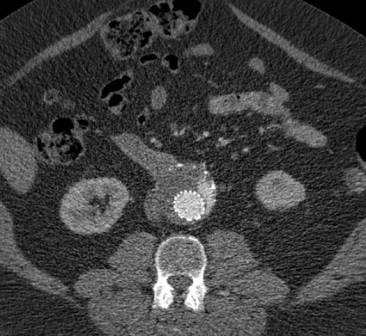
支撑架植入后,动脉增强现实II型内漏
Nevala 等人[1]评价了血管内腹主动脉瘤支撑架植入术前栓塞肠系膜下动脉的临床价值。79例计划行血管内主动脉瘤支撑架(Endovascular Aneurysm Repair,EVAR)前CTA发现肠系膜下动脉开放。其中40例为防止术后的II型内瘘进行了肠系膜下动脉弹簧圈栓塞(栓塞组),39例未进行这种栓塞(对照组)。所有病人使用Zenith 支撑架,并进行了平均3.4 years ± 1.7 (median, 3.1 years; range, 0–7.6 years)的随访。结果显示尽管肠系膜下动脉栓塞减少了II型内瘘的发生率,但对术后动脉瘤缩小没有任何影响。
除了在主动脉支架移植物植入前预防性对修复段主动脉分支血管进行栓塞,对于已经发生的动脉瘤囊还可以进行封堵治疗以避免继续扩大。
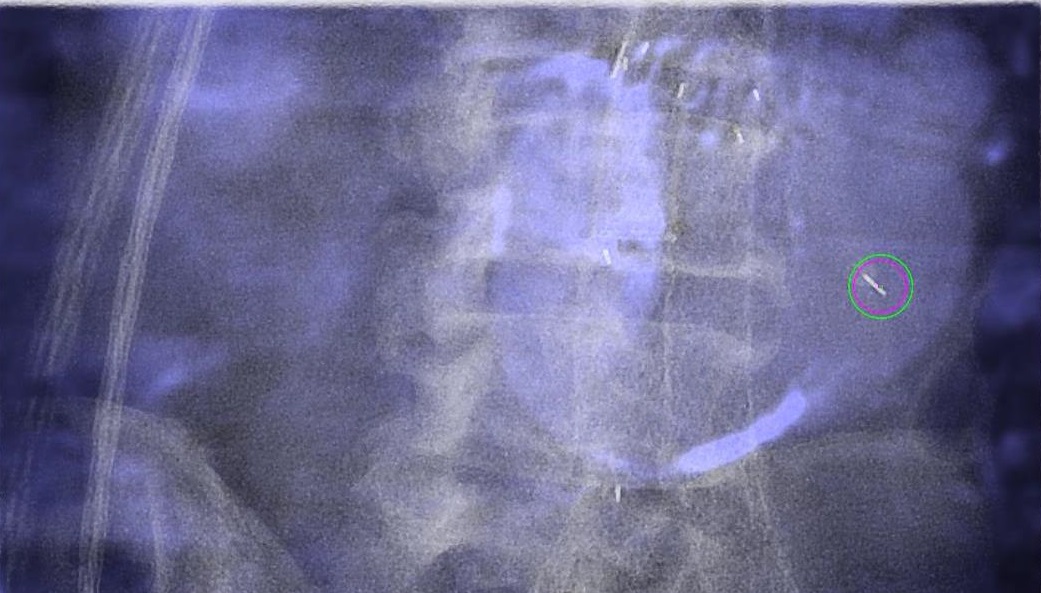
方法之一是直接进行II 型内漏的主动脉瘤囊进行CT或其它影像学引导下的穿刺。
CT引导下主动脉瘤囊直接穿刺治疗II型内漏
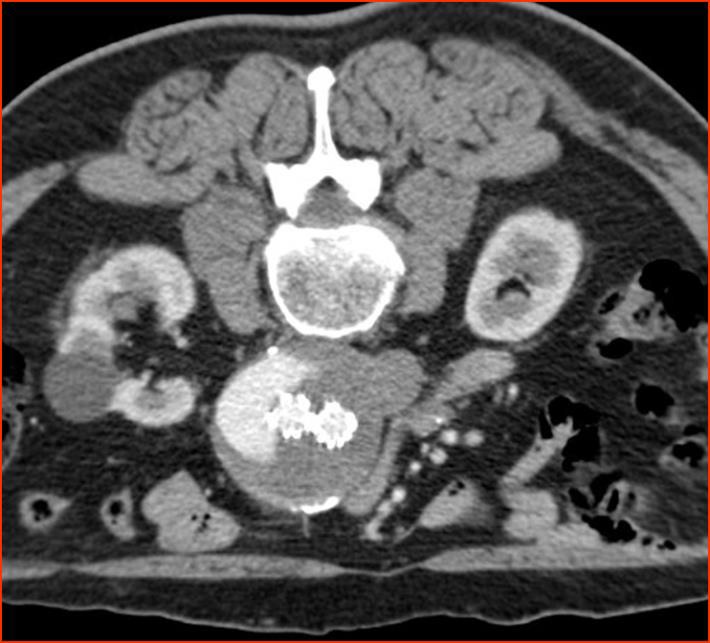 |
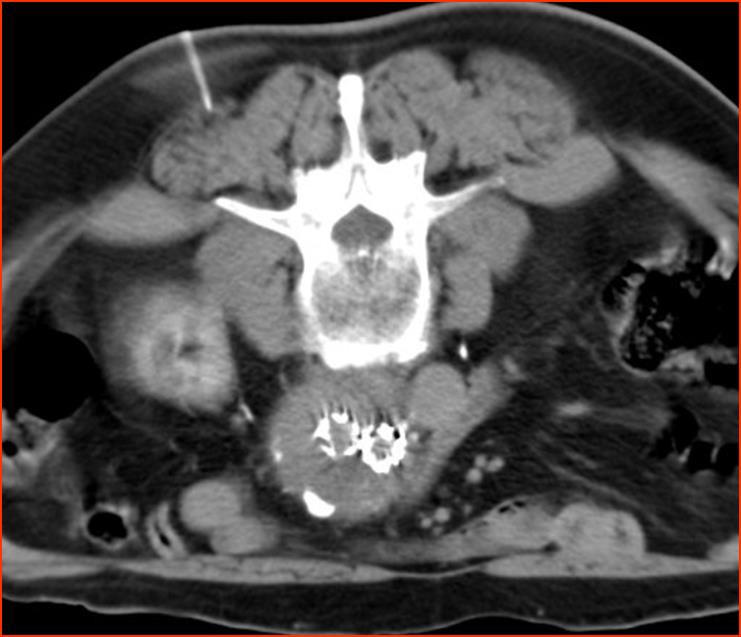 |
|
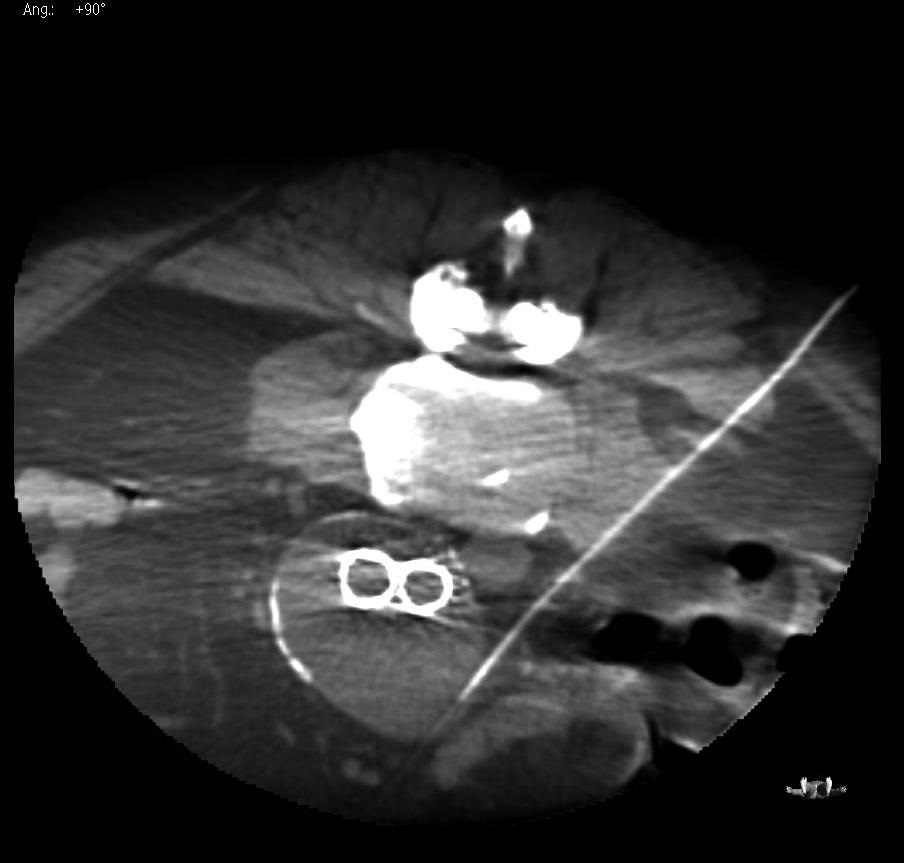
增强CT现实支架移植物植入后发生内漏 |
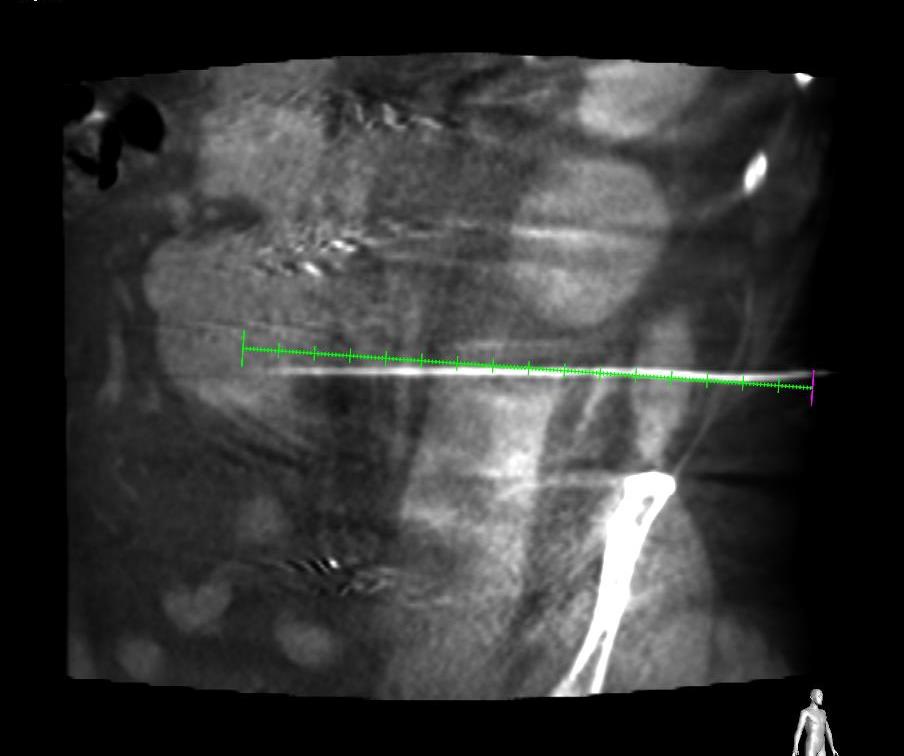
CT引导下后入路直接穿刺瘤囊 |
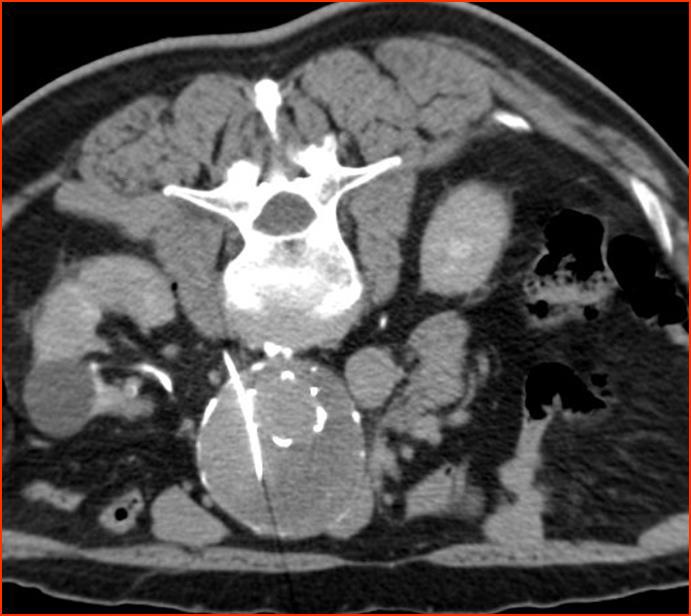 |
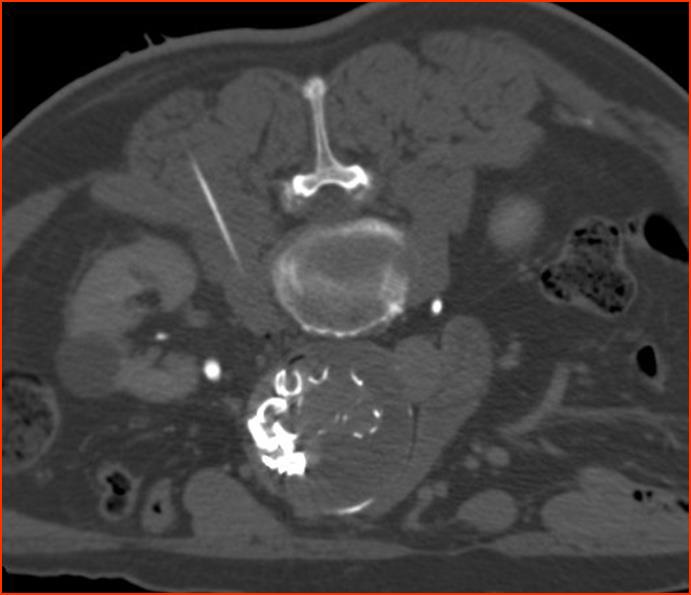 |
|
导管进入瘤囊内 |
Onyx 胶注射后 |
在CT引导下直接瘤囊穿刺的优点是可以清晰地界定穿刺的路径。而缺点是不能够实时观察穿刺的路径,需要反复CT扫描确定进针方向与正确的路径保持一致。栓塞时是盲目进行的,整个过程需要反复的CT扫描确定栓塞的程度,操作比较耗时,病人受辐射较多。尽管在透视下CT可以实时操作,而且可以增加整个操作过程的速度。但操作者受辐射较多,而且栓塞时可视性较差。
透视CT引导下的主动脉瘤囊直接穿刺
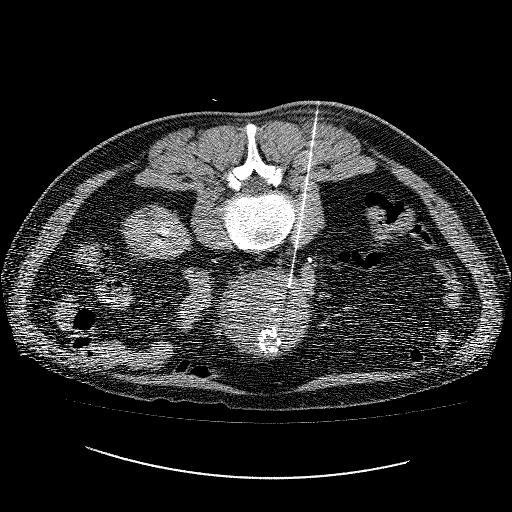 |
|
尽管可以实时操作,但栓塞时的可视性较差。 |
为了增加穿刺的准确性有人尝试在C-arm CT引导下利用图像融合技术引导瘤囊穿刺
CT图像融合技术引导下的瘤囊穿刺优点是穿刺和栓塞都是实时状态,缺点是技术人员和医生都需要一个学习过程(Lerining curve)
经腔静脉入路实施瘤囊穿刺也是一种尝试。
经腔静脉入路穿刺瘤囊:RUPS-100 穿刺针
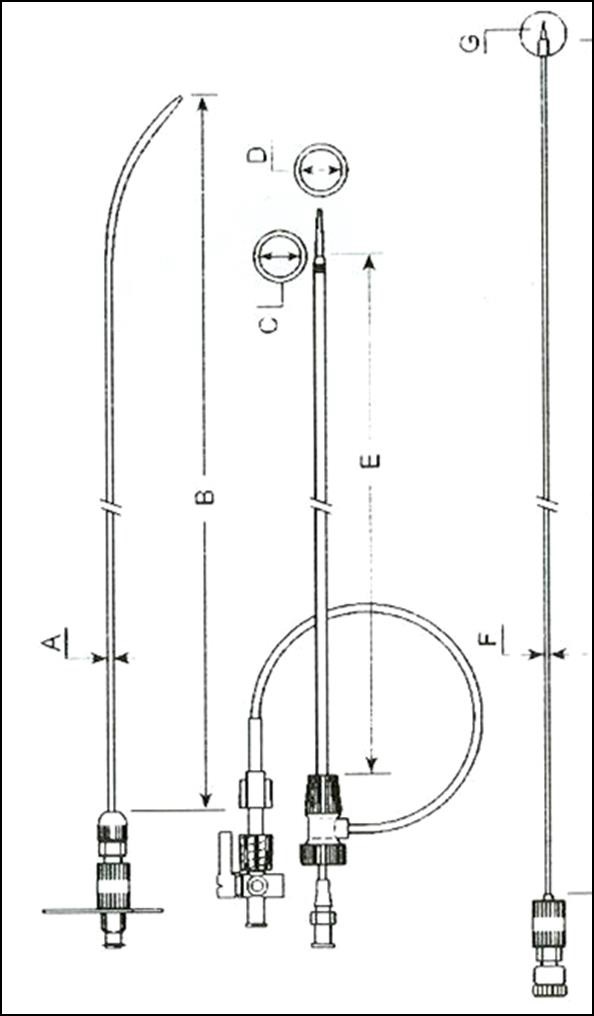 |
 |
|
|
穿刺示意图 |
经腔静脉穿刺入路: 术前CT扫描,AXIAL, CORONAL, MIP 等 明确进入点和选择进入点的标示
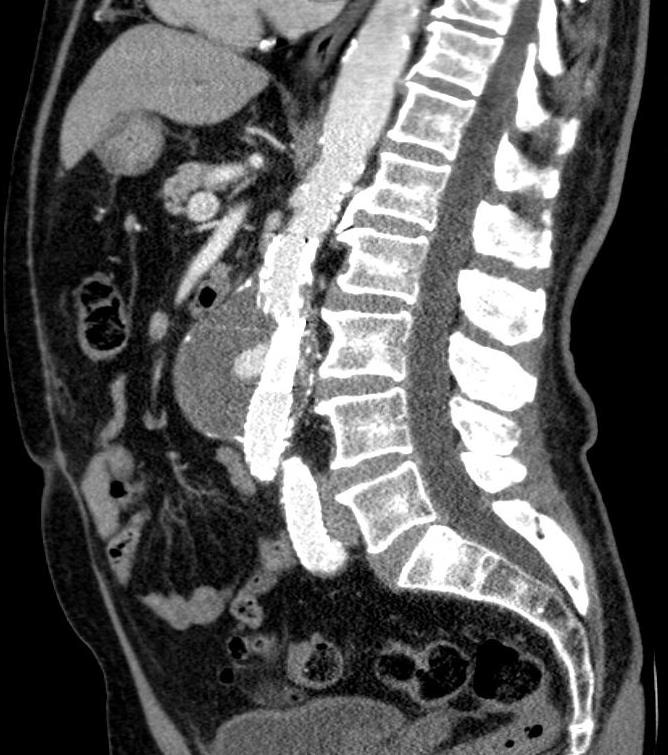 |
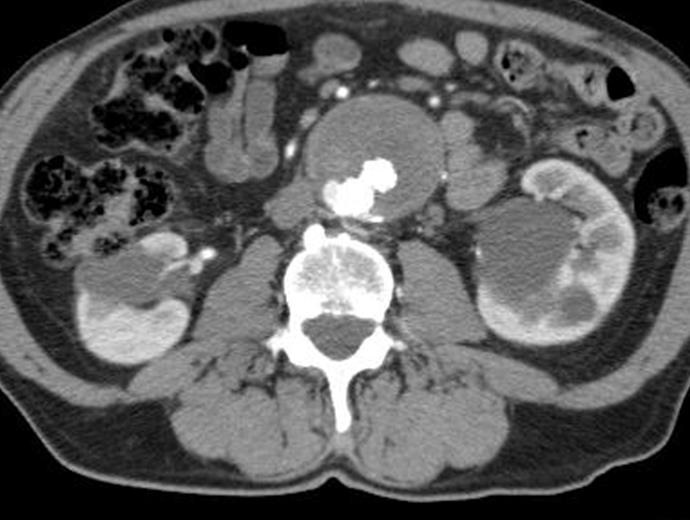 |
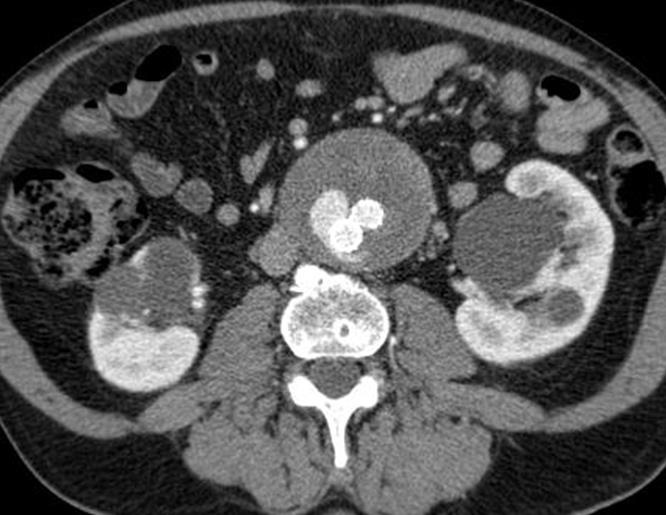 |
|
|
|
Ⅲ型内漏
如果支架移植物本身存在机械问题,就可能发生这种情况。孔洞,折断,以及分离都属于这种情况。在动脉的搏动过程中,压力反复作用于移植物上。另外,由于随着时间动脉瘤囊萎缩,施加在移植物上的压力更大,可能导致塌陷。尽管现在这类漏很少见,但随着置入的支架开始老化并且从这些病人中获得长期随访信息,这种现象会更加常见。Ⅲ型内漏可以用扩张补片矫正机械缺陷来修补,但对于严重的病例,可能需要将内支架移出。
Ⅳ型内漏
因为支架的孔洞增加,血液从编织结构的支架壁穿过,就形成了这种漏。如果病人被充分抗凝,在置入支架时就能识别出漏,这时除了让病人的凝血指标恢复正常,不需要其它特殊治疗。由于各种漏的严重性和治疗选择有很大不同,对内漏正确的识别和分类非常关键。动态CT血管造影是一种敏感的方法,能够识别出是否存在内漏。但它却不能区别不同类型的内漏。原因是,内漏是根据漏的来源分类的,而CT显像不能确定漏腔内血流的方向。例如,如果在CTA上看到一个内漏腔同腰动脉相通,却无法确定漏腔内血流的方向。确定内漏病因最好和最可靠的方法是进行内漏专用血管造影。有人也认为将注射时间延长至60秒能更好地显示侧支内漏。
内漏的治疗
关于内漏病人治疗的时机和方法问题,进行了很多讨论。内漏的严重性决定于漏的类型和慢性程度。一般情况下,在动脉瘤血管内修复术后30天对病人进行CT血管造影。如果有内漏存在,那么就在6个月后复查一次CTA。如果内漏仍然存在,就应该对其进行修补,因为在6个月时仍然存在的内漏形成血栓的可能性不大。采取何种治疗取决于内漏的类型。只有通过专门的内漏血管造影才能够准确地对其进行评价。必要时专门的时间单独这项血管造影的操作是有意的,这样才能制定一个详尽的治疗计划。
对Ⅰ型和Ⅲ型内漏采取直接的治疗方法,即是将体循环和动脉瘤囊隔离开来。由于血管和内支架的解剖结构,对Ⅱ型内漏的处理要更为复杂些。已有显示,栓塞内漏供血血管的方法并不能够有效地提供持久的修复。例如,栓塞肠系膜下动脉(IMA),就不能持久地修复IMA到腰动脉的内漏。内漏是一个动态结构,堵塞一根供血血管将使其它主动脉分支血管中的血流重新分布。在IMA被栓塞后,原来在内漏中起输出血管作用的腰动脉会变成输入血管。在很多方面,内漏都同动静脉畸形(AVM)相类似。已经有证明,对AVM的供血动脉栓塞是无效的。要有效地治疗畸形,必须破坏病灶。这个中心区域就是供血和引流血管相接的地方。同样的观念也适用于Ⅱ型内漏。要有效地治疗这种漏,需要将漏腔的中心区域栓塞。一旦中心区域被栓塞,内漏腔的各支供血和引流血管将形成血栓,直至它们的开口处。为了能更容易地进入内漏腔,已经开发出经腰内漏栓塞的技术。
进行经腰内漏栓塞时,需要病人俯卧在X线透视检查台上(也有人使用CT来进行这项操作)。首先根据骨性解剖标志以及内支架上的不透X线标志来对内漏定位。对病人应用抗生素,采用一支标准的腰部穿刺针进入动脉瘤囊。在X线引导下进针,穿刺部位在距中线约一手掌宽处。可以从左侧或右侧的经腰部途径进行穿刺。在很多病例中,从右侧经腰部途径进入动脉瘤囊的途中,需要穿过下腔静脉。有时候,朝锥体方向穿刺会有帮助。一旦针头接触到了锥体,就可以把它往回拉一些,稍拐向外侧进入动脉瘤囊。这种技术的优点在于它避免进行横向穿刺而堵塞动脉瘤囊的入口。
在进入囊内时,常常会有轻微的落空感。同进入钙化的股动脉时感觉一样。一旦针头进入动脉瘤囊,就应该缓缓将其推进内漏腔中。这时将C型臂旋至外侧非常有帮助,这样就避免了向前进针太多而离开动脉瘤囊。需要时时回抽针芯,确定位置是否正确。进入内漏腔后,就会有活跃的体循环压动脉血从针末端溢出。用一小段连接管同装有造影剂的注射器相连,然后用手推5-10ml造影剂进行内漏血管造影。这样就可以进行供血和引流血管的显像。重要的是记住,这些血管并不是栓塞治疗的目标。一旦内漏腔的中心区被消除,这些血管会自发形成血栓。
联合使用弹簧栓子和凝胶对内漏腔进行栓塞。弹簧栓子栓塞法是针对缓慢的血流进行的,而注射凝胶是因为一般它会走行到比弹簧栓子更远的地方。必须小心注意不要使传送凝胶的导管粘在动脉瘤囊里的其它地方。要做到这一点,就要缓慢地将导管撤出,而凝胶被散步在内漏腔里。有人也用凝胶来“封闭”动脉瘤囊的出口。
Ⅰ型和Ⅲ型内漏在诊断当时即予修复。Ⅱ型内漏如果持续存在超过6个月即予修复。同样,也应该考虑动脉瘤囊的大小状态。如果动脉瘤囊稳定(没有缩小或胀大),是否对Ⅱ型内漏给予治疗仍有争议。
|
分类 |
病因 |
治疗 |
|
I |
附着部位 |
PTA, 球囊,支架 |
|
II |
侧支 |
栓塞 |
|
III |
移植物塌陷 |
移植物修复 |
|
IV |
多孔 |
不需要治疗 |
支撑架扭结
在扭曲的髂动脉解剖中的内支架臂可能会导致狭窄或绞结。另外,在EVAR后,动脉瘤囊在纵轴上缩短的现象很常见。这就导致髂动脉起始处的角度增加,同时也会造成支架臂的绞结。病人典型表现为逐渐加重的跛行,并且在一些病例中会出现严重的缺血。治疗方法很简单,包括用支架支持狭窄的臂,增加支架移植物的臂,或同时采用这两种方法。及时对臂绞结进行诊断是很重要的,避免进展为臂血栓形成。如果出现了血栓,一般需要联合应用血栓切除和溶栓的方法,这样才能去除大的血凝块。一旦血流得以重建,就可以用支架对臂提供支持。
1. Terhi Nevala, MD, Fausto Biancari, MD, PhD, Hannu Manninen, MD, PhD, Pekka Matsi, MD, PhD, Kimmo Mäkinen, MD, PhD, Kari Ylönen, MD, Jukka Perälä, MD, PhD. Inferior Mesenteric Artery Embolization before Endovascular Repair of an Abdominal Aortic Aneurysm: Effect on Type II Endoleak and Aneurysm Shrinkage. JVIR Volume 21, Issue 2, Pages 181-185 (February 2010)
2. White GH, Yu W, May J. Endoleak--a proposed new terminology to describe incomplete aneurysm exclusion by an endoluminal graft. J Endovasc Surg. 1996 Feb;3(1):124-5.
3. White GH, May J, Waugh RC, Yu W. Type I and Type II endoleaks: a more useful classification for reporting results of endoluminal AAA repair. J Endovasc Surg. 1998 May;5(2):189-9
4. Velazquez OC, Baum RA, Carpenter JP, Golden MA, Cohn M, Pyeron A, Barker CF, Criado FJ, Fairman RM. Relationship between preoperative patency of the inferior mesenteric artery and subsequent occurrence of type II endoleak in patients undergoing endovascular repair of abdominal aortic aneurysms. J Vasc Surg. 2000 Oct;32(4):777-88.
5. Dubenec SR, White GH, Pasenau J, Tzilalis V, Choy E, Erdelez L. Endotension. A review of current views on pathophysiology and treatment. J Cardiovasc Surg (Torino). 2003 Aug;44(4):553-7.
|