介入治疗脑动脉瘤的终极目标是防止动脉瘤破裂。利用弹簧栓子的致密填塞技术,导致脑动脉瘤囊内完全血栓形成,明确和永久地将动脉瘤囊与颅内的血循环隔绝,并保留载瘤动脉的正常循环。长期以来脑动脉瘤的治疗为神经外科所主宰,但自从九十年代以来,由神经介入医生应用血管内技术治疗脑动脉瘤的病例迅猛增加。 20世纪60年代Mckissock等[7,8]连续报道手术夹闭对于某些颅内动脉瘤的益处,高于动脉瘤所具有的风险,从此手术夹闭成为颅内动脉瘤治疗的金标准,并随着显微外科技术的不断进步,手术死亡率也不断下降,目前也仍是治疗颅内动脉瘤的最可靠方法[9]。但仍然有部分病人由于动脉瘤的形态和部位不合适手术加闭或临床状态不允许进行风险较高的外科开颅手术,人们开始尝试进行血管内介入治疗颅内动脉瘤。 颅内动脉瘤介入治疗始于二十世纪七十年代初。当时也仅仅在不能手术的病人中进行有选择的尝试[12,13,14]。 随着血管内治疗技术及新的栓塞材料的快速发展,血管内栓塞目前已经成为治疗颅内动脉瘤的可选择的重要方法之一。电解可脱卸弹簧圈(GDC)发明以前,曾有一段时间大家尝试用可脱性球囊栓塞颅内动脉瘤,发现栓塞后动脉瘤复发率几乎100%,此技术现早已废弃。 电解可脱弹簧圈(GDC)栓塞动脉瘤自1991年开始应用于临床,目前已经取得广泛认可[10,11]。 颅内动脉瘤的血管内治疗包括两种根本上不同的处理方法。 第一个是指在1970年左右,在Guglielmi发明可分离弹簧栓子之前(GDC), 脑动脉瘤血管内治疗的主要内容是进行载瘤动脉栓塞,或者使用由Serbinenko 改进的硅树脂球囊进行囊内治疗,血管内治疗被限制于使用可脱性球囊。 它们被置于供血动脉中,分别在近端和远端堵住动脉瘤颈部。如果不能堵住,通过在动脉瘤颈部近端放置可分离性球囊而栓塞载瘤动脉,类似于手术结扎。1982年,Romodanov 和 Shchegelov 报告了第一个只用可脱性球囊栓塞动脉瘤腔的病例。他们在动脉瘤的囊腔中放置橡胶球囊,然后以永久性固化剂替代造影剂来防止球囊缩小。接下来发展了充满2-羟乙基甲基异丁烯酸酯(HEMA)的软硅胶球囊。球囊技术引起了一些问题;进入球囊的困难,在动脉瘤腔内进行的过多的球囊操作导致动脉破裂,以及由于动脉瘤形状不规则所造成的不正确的球囊填充。成功地填塞动脉瘤后还面临球囊放气后变小等。后来还有其他方法,以作为那些高危患者的手术治疗的备选方案。迄今,对于不能进行动脉瘤囊栓塞的梭形动脉瘤仍然采用载瘤动脉栓塞的方法。 第二个为“重建性的”,是指在1990年左右,随着工业生产的裸铂螺旋圈(Guglielmi Detachable Coils,GDC)的使用而发生改变,铂螺旋圈的使用可以实现外科手术风险很大的脑动脉瘤腔内进行可控瘤内栓塞。通过用球囊或弹簧栓子填塞关闭动脉瘤腔而保留供血动脉[12,13,14]。到了1995年,美国FDA批准在美国用GDC螺旋圈治疗脑动脉瘤,这使得该治疗方法在世界范围内被用来治疗破裂或者未破裂的脑动脉瘤。 Guglielmi 等人发展了可脱性弹簧栓子系统,该系统可实现通过较少的操作完成动脉瘤囊腔弹簧栓子的填充。在解脱栓子的过程中使用电解和电至栓的原理[12],使动脉瘤腔内围绕栓子形成局部血栓,加强瘤囊内的完全填塞。一旦血管造影证实完全填塞,弹簧栓子可不经牵引而得到释放。位置不满意可以收回栓子在导管内重复释放,直到满意为止。这种可脱性弹簧栓子法革新了颅内动脉瘤的处理方法。早期进行的较小的单一中心研究表明,和外科切除相比,动脉瘤的螺旋圈栓塞治疗更加安全。Vanniner等人进行了一项前瞻性的随机临床试验,比较在111例患有破裂的小的颅内动脉瘤患者中进行螺旋圈栓塞治疗和外科治疗的治疗结果。该研究表明,虽然两种治疗方法的短期疗效无显著差异,但是栓塞组的死亡率要低于外科治疗组。从技术的角度来讲,后循环动脉瘤的术后造影结果要优于螺旋圈栓塞组。前循环动脉瘤的技术结果以外科治疗组为优。该研究认为螺旋圈栓塞治疗并不能作为破裂动脉瘤的治疗方法,因为它无法提供优于外科治疗的发病率和死亡率数据。 Raftopoulos等人报道了一项单中心临床试验,在该试验中,他们对132例动脉瘤患者中的103例进行了计划-处理分析。在该研究中,64例患者进行血管内治疗;剩下的患者进行外科治疗。治疗后的患者预后分析表明,虽然外科组中有93.9%的患者预后良好,在血管内治疗组中该数值为86.7%,但是两者没有统计学差异。尽管两种方法的结果相似,但是血管治疗组中血管栓塞和动脉穿破等严重并发症的发病率高于外科组,为9.4%。 后来的前瞻性试验表明,在治疗脑动脉瘤中,微弹簧栓子栓塞的安全性高于开放性的外科手术。未破裂的颅内动脉瘤的国际研究(ISUIA)试验是一项前瞻性非随机临床试验,用以评价患有未破裂颅内动脉瘤的患者。在两个研究组中,患者被分为治疗组和观察组,治疗组患者接受外科或者栓塞治疗。该研究结果表明,和外科组相比(1,917例),微弹簧栓子栓塞组(451例)的发病率和死亡率较低,尤其是在后循环动脉瘤患者中。国际蛛网膜下腔动脉瘤试验(ISAT)是一项前瞻性的随机多机构临床试验,用于比较外科切除和血管内微弹簧栓子栓塞对破裂脑动脉瘤的疗效。该研究中包括2,143例患者。由于血管内治疗在早期即具有较低的发病率,因此该研究被咨询委员会终止。该研究表明,在一年随访过程中,栓塞组的死亡率有统计学意义的降低,该结论是通过患者的修正Rankin评分得出的。该研究并未对当前随访中相关的微弹簧栓子栓塞效果是否持久,以及在第一年中观察到的临床结果的改善是否可以长期持续作出回答,特别是微弹簧栓子栓塞的动脉瘤的再出血率是否显著?这些问题的解答必须通过更长期的随访观察才能完成。 “蛛网膜下腔出血 众多证据显示,80%以上的蛛网膜下腔出血是由动脉瘤引起的,第一次出血之后,动脉瘤再次发生出血的发生率及致死率明显提高,因此采取积极措施治疗导致出血的原因是关键,单纯内科保守治疗的观念已经为人们所淘汰。在这个问题上,观念的改变比技术本身的提高更为重要。 颅内动脉瘤的血管内治疗是一项高技术水平的治疗方法,依赖术者的技术成熟。事实上,合适的治疗可以提高破裂动脉瘤患者的生存率,同时还可以预防未破裂动脉瘤患者的并发症(卒中或者死亡)发生率。以至于有人认为栓塞术将取代夹闭术[3]。目前多数学者仍认为这两种方法各有优缺点和适应征,两种治疗方法将会长期并存,并相互补充[4,5]。 作为外科治疗的可选择方案,血管内治疗是微创的;但是,介入治疗的可能并发症,包括血管栓塞,动脉瘤或者血管穿破而导致的脑出血,动脉破裂以及脑血肿的形成,都是高致残或致命的。因此,必须需要有经验的神经介入医师进行该治疗。同时还必须将这些风险告知患者及其家属。虽然经验表明,动脉瘤治疗的风险相当低,但是长期效果并没有被证实[13,14]。 很多情况下可以影响动脉瘤囊内的完全填塞,最重要的因素是瘤颈到瘤底的比率[13,14]。瘤颈过宽甚少能够通过单独的微栓子的成篮技术完成完全填塞,因为弹簧栓子有可能在试图致密填塞的努力中,形成载瘤动脉内拱形突出,造成脑动脉狭窄,甚至逸出至载瘤动脉内造成阻塞;也可能担心可能发生的此类情况造成动脉瘤残存或不完全填塞。 除了某些特殊情况,多部分颅内动脉瘤的介入治疗都需要进行全麻。由于脑动脉瘤中几个毫米的微导管都可能穿破血管,因此认为全麻是最安全的措施。同时,很多颅内动脉瘤治疗的栓塞步骤在系统抗凝后的出血率都是很低的。血管栓塞是动脉瘤栓塞治疗的常见并发症。因此,在栓塞治疗前有必要进行抗凝控制和治疗管理。
除了某些特殊情况,多部分颅内动脉瘤的介入治疗都需要进行全麻。由于脑动脉瘤中几个毫米的微导管都可能穿破血管,因此认为全麻是最安全的措施。同时,很多颅内动脉瘤治疗的栓塞步骤在系统抗凝后的出血率都是很低的。血管栓塞是动脉瘤栓塞治疗的常见并发症。因此,在栓塞治疗前有必要进行抗凝控制和治疗管理。
尽管2002年大规模随机对照研究(ISUIA,ISAT)已经对未破裂及破裂的动脉瘤的治疗进行了对比研究,但在动脉瘤的治疗中,选择外科手术还是血管内治疗的争论仍然在继续。最近的一组前瞻性研究报告指出,外科动脉瘤夹闭的并发症稍高,生活质量稍差,但动脉瘤的彻底治愈率高,达97%;而血管内治疗组,只有84%的动脉瘤栓塞达到90%以上,在1年随访过程中,甚至有再出血死亡的病例”。国际动脉瘤性蛛网膜下腔出血试验(ISAT)的结果显示,对同时具有手术和介入治疗指征的颅内动脉瘤,介入治疗病人的相对和绝对风险较开颅手术降低了22.6%和6.9%[6]。
脑动脉瘤栓塞原理图: 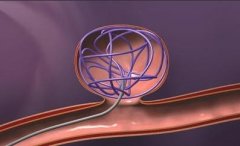 Matrix 的3D弹簧圈由Ω形状的小圈和大圈交替组成,释放后在动脉瘤内“成篮”。 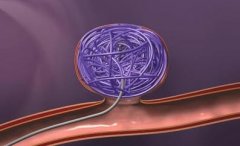 Matrix 的3D弹簧圈由Ω形状的小圈和大圈交替组成,释放后在动脉瘤内“成篮”,密实填塞 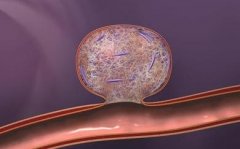 弹簧圈在动脉瘤内造成血流阻滞诱发血栓形成 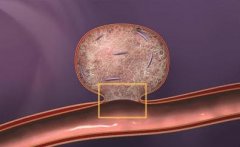 簧圈在动脉瘤内造成血流阻滞诱发血栓形成 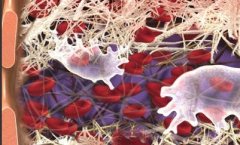 弹簧圈在动脉瘤内造成血流阻滞诱发血栓形成  弹簧圈在动脉瘤内造成血流阻滞诱发血栓形成  弹簧圈在动脉瘤内造成血流阻滞诱发血栓形成 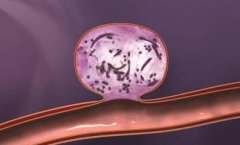 弹簧圈在动脉瘤内造成血流阻滞诱发血栓形成,载瘤动脉的内皮细胞移行到瘤颈口的血栓表面,并最终覆盖瘤颈口 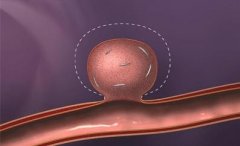 最终,可脱弹簧圈栓塞的动脉瘤体积将缩小,通过截面积计算约缩小40%[1,2]。 1. Murayama Y, Tateshima S, Gonzalez NR, et al. Matrix and bioabsorbable polymeric coils accelerate healing of intracranial aneurysms:long-term experimental study. Stroke, 2003,34:2031-2037. 2. Murayama Y, Vinuela F, Tateshima et al Cellular 2sponses of bioabsoable polymeric material and Cuglielm i detachable coil in experimental aneurysms. Stroke, 2002, 33(4): 1120一1128
3. De Wilte T. Endovascular treatment for cerebral aneurysms will replace clipping. J Neurosurg Anesthesiol. 2003,15:58~60
4. 秦尚振,马廉亭,余泽,等.颅内动脉瘤的诊断和治疗方法探讨. 中华外科杂志,2001,39:123~125
5. 刘承基,颅内动脉瘤应选用显微手术夹闭还是血管内栓塞术,中国脑血管病杂志.2004,1:530~532
6. Molyneux A,Kerr R,Stratton J et al. International subarachnoid Aneurysm Trial (ISAT) of neurosurgical clipping versus endovascular coiling in 2143 patients with ruptured intracranial aneurysms a randomised trial Lancet,2002,360:1267-1274
7. Mckissock W,RichardsonA,Walsh L.Posterior communicating aneurysms: a controlled trial of conservative and surgical treatment of ruptured aneurysms of the internal carotid artery at or near the point of origin of the posterior communicating artery. Lancet,1960,1: 1203~1206 9. Chicoine MR. Microsurgery and clipping.The goldstandard for the treatment of intracranial aneurysms.J Neurosurg Anesthesiol.2003,
10. Brilstra EH, Rinkel GJ, van der Graaf Y et al Treatment of intracranial aneurysms by embolization with coils a systematic review [J]. Stroke, 1999, 30(2): 470-476
12. Guglielmi G, Viñuela F, Sepetka I, Macellari V. Electrothrombosis of saccular aneurysms via endovascular approach. 1. Electrochemical basis, technique, and experimental results. J Neurosurg 1991;75:1-7.
13. Fernandez Zubillaga A, Guglielmi G, Viñuela F, Duckwiler GR. Endovascular occlusion of intracranial aneurysms with electrically detachable coils: correlation of aneurysm neck size and treatment results. AJNR Am J Neuroradiol 1994;15:815-820.
14. McDougall CG, Halbach VV, Dowd CF, Higashida RT, Larsen DW, Hieshima GB. Endovascular treatment of basilar tip aneurysms using electrolytically detachable coils. J Neurosurg 1996;84:393-399.
|

