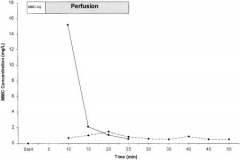
胰腺癌是对化疗药物不敏感的肿瘤,面对晚期胰腺癌患者倍感凄惨的痛苦预后,尽管肿瘤治疗的终点目标是延长病人生存期,但在目前缺乏有效的治疗手段的情况下,治疗的选择往往是预期改善病人有限生命期间的生存质量而不是生存期。 胰腺癌局部化疗的原理包括解剖原理和药学原理 根据公式,高“肝脏首过”或全身清除率更利于局部化疗的应用。所以常用于胰腺癌局部化疗的药物是丝裂霉素C(mitomycin C), 米托蒽醌(mitoxantrone), 5-FU,顺铂(cisplatin), 表柔比星(epirubicin), 和 环磷酰胺(cyclophosphamide),有些药物如丝裂霉素C和阿霉素被文献报告在缺氧下灌注更有效[23,24]。因为吉西他滨有较高的整体清除率,似乎更适合动脉内应用[22]。 陈紫千等[1]研究动脉及周围静脉注射5-FU后胰腺的药代动力学显示:在给药后10、20、30分钟动脉组是静脉组的57、29、6倍。傅德良等[2]证实介入治疗可使健择在胰腺的浓度显著高于全身用药。近期,有关健择治疗胰腺癌收到较好临床疗效的报道日益增多[3~5]。键择是一种新的核苷类似物,其细胞膜穿透性强,在细胞内潴留时间较长,这样药物在细胞内能较长时间保持高浓度,更好地发挥抗肿瘤作用。Matano 等 [6] 采用健择加5-FU连续输注方案治疗中晚期胰腺癌,其疗效CBR达63.6%,且不良反应轻微,认为健择加5-FU联合化疗疗效显著,病人耐受性好。 他滨动脉灌注对静脉灌注的患者药代动力学研究显示静脉灌注后体循环药物峰值浓度是动脉灌注后3.8倍。静脉灌注的AUC高于动脉灌注后2.8倍。动脉灌注后吉西他滨体循环药物水品低或不能被测到。这一结果肯定了吉西他滨是适合于局部化疗的药物
化疗对胰腺癌的杀伤作用机理是通过促使癌细胞凋亡来实现的[7,8],而区域动脉灌注化疗诱导细胞凋亡是一持续的过程,由于介入治疗后凋亡细胞明显增加,会使肿瘤增殖减慢,产生明显的治疗作用。区域动脉灌注化疗可主动的干涉bax和bcl-2之间的比例,从而可使胰腺癌细胞的凋亡增加[9],国外诸多文献证实通过介入手段采用健择及5-Fu联合化疗治疗胰腺癌是安全有效的[10]。能明显延长病人的生存时间,傅德良等[9]认为胰腺癌的综合治疗中,区域动脉灌注化疗是一项重要的治疗措施,即可以减少全身化疗的副作用[11],又可以提高组织的药物浓度,提高疗效。
经泵动脉灌注化疗的优势在于:能在局部达到较高的药物浓度,显著抑制肿瘤生长,减少肝转移的发生,延长患者的生存期,且较少发生全身化疗引起的严重毒副反应。其优点主要有[12]:
(1)局部高浓度的药物可以克服肿瘤耐药性,并通过抑制TNF-A、IL-1、IL-6的产生和促使肿瘤细胞凋亡,抑制肿瘤生长和转移;
(2)经泵动脉灌注化疗对局部进展期胰腺癌有较好的降期作用,增加患者手术机会,并通过杀灭已存在的微小转移和亚临床病灶,减少术后的复发和转移;
(3)经泵动脉灌注化疗使肿瘤和血管之间产生炎性间隙,便于手术操作,且经泵动脉灌注化疗可使胰腺组织变韧,减低胰空肠吻合口漏的机率;
(4)术后或复发的胰腺癌行经泵动脉灌注化疗可杀灭残留的肿瘤细胞,控制肿瘤的局部生长和转移;
(5)经泵动脉灌注化疗能改善患者局部和全身症状,提高患者生存质量。
1. 陈紫千,刘承恩,郭克建.氟尿嘧啶腹腔动脉与周围静脉给药胰腺和肝脏药代动力学实验研究[J].中国冶金工业医学杂志,2000,17(5):257-259.
2. 傅德良,倪泉兴,虞先浚,等.胰腺区域性动脉灌注治疗胰腺癌的实验研究[J].中华医学杂志,2002,82(6):371-375. 3. Casper ES,Green MR,Kelsen DP,et al.Phase trial of gemcitabine in patients with adenocarinoma of the pancreas [J]. Invest New Drugs,1994,12(1):29-34. 4. Hajm U,Schumann T,Schiefke I,et al.Decrease of CA19-9 during chemotherapy wlth gemcitabine predicts survival time in patient with advanced pancreatic cancer[J].BrJ Cancer,2000,82(5):1013-1016. 5. Kommam M,Butzer U,Blauer J,et al.Pre-clinical evaluation of the activity of gemcitabine as a basis for regional chemotherapy of pancreatic and colorectal cancer[J].Eur J Surg Oncol,2000,26 (8):583-587. 6. Matano E,Tagliferri P,Libroia A,et al.Gemcitabine combined with continuous infusion 5-FU in advanced and symptomatic pancreatic cancer: a clinical benefit-oriented phase Study[J]. Br J Cancer,2000,82(11):1772-1775. 7. 石欣,高乃荣,霍明东,等. 胰腺癌细胞对5-Fu和健择的获得性耐药机制的研究[J] 中华普通外科杂志,2003,18(1):16-17.
8. Clark JW,Gligksman AS,Wanebo HJ,et al. Systemic and adjurant therapy for patients with pancreatic cancinoma [J]. Cancer,1996,78(3):688-693. 9. 傅德良,倪泉兴,虞先俊,等. 区域动脉灌注化疗对胰腺癌bcl-2bax基因的影响[J] 中华肝胆外科杂志,2001,7(3):147-148. 10. 石海峰,金征宇,周志强,等. 经动脉灌注吉西他宾及5-Fu治疗中晚期胰腺癌的疗效分析[J]. 中华放射学杂志,2002,36(12):1074 11. 傅德良.胰腺癌的区域性辅助治疗. 国外医学·外科学分册, 2002,29:216-220.
12. 郑家平,叶强,顾伟中.胰腺癌的血管介入治疗[J].介入放射学杂志,2004,13(4):373-375.
13. Muchmore et al.Regional chemotherapy for inoperable pancreatic carcinoma. Cancer. 1996 Aug 1;78(3 Suppl):664-73.
14. Rosemurgy A et al.New directions in systemic therapy of pancreatic cancer. Cancer Control. 2000 Sep-Oct;7(5):437-444. Review.
15. Gansauge F, Link KH, Rilinger N, et al. Regional chemotherapy in advanced pancreatic carcinoma. Med Klin 1995;90:501-5.
16. Collins JM. Pharmacologic rationale for regional drug delivery. J Clin Oncol 1984;2:498-504.
17. Lorenz M, Staib-Sebler E, Gog C, et al. Liver metastases: the value of regional long-term chemotherapy. Chirurg
18. Donatini B, Rougier P. Anatomical basis for pancreatic locoregional chemotherapy. Reg Cancer Treat 1992;4:272-6.
19. Hryniuk WM, Figueredo A, Goodyear M. Applications of dose intensity to problems in chemotherapy of breast and colorectal cancer. Semin Oncol 1987;14(suppl 4):3-11.
20. Ensminger WD, Gyves JW, Stetson P, et al. Phase I study of hepatic arterial degradable starch microspheres and mitomycin. Cancer Res 1985;45:4464-7.
21. Collins JM. Pharmacologic rationale for regional drug delivery. J Clin Oncol 1984;2:498-504.
22. Heinemann V, Schalhorn A, Schulz L, et al. Pharmacokinetics of gemcitabine in patients with advanced pancreatic cancer. Oncology 1997;20(suppl 1):56.
23. Hönl H, Ridwelski K, Mertens U, et al. Pharmacokinetic aspects of mitomycin C in the aortic stop flow treatment. Reg Cancer Treat 1997;1(suppl):14.
24. Klapdor R, Seutter R, Lang-Pölckow EM, et al. Locoregional/systemic chemotherapy of locally advanced/metastasized cancer with a combination of mitomycin-C and gemcitabine and simultaneous follow-up by imaging methods and tumor markers. Anticancer Res 1999;19:2459-70.
25. Hönl H, Ridwelski K, Mertens U, et al. Pharmacokinetic aspects of mitomycin C in the aortic stop flow treatment. Reg Cancer Treat 1997;1(suppl):14.
26. Petrowsky H, Heinrich S, Janshon G, et al. Technique and pathophysiology of isolated hypoxic perfusion of the abdomen. Zentralbl Chir 1999;124:833-9.
。
| |||||||

