国家医学电子书包
- 医学影像学概论
- 第二篇:介入医学
- 第四节:动脉出血疾病 (杨宁)
一、咯血 杨宁(1000字)
二、消化道出血 杨宁(3000字)
三、创伤性出血 杨宁(3000字)
一、支气管动脉大咯血
大咯血(massive hemoptysis)文献上定义各不相同,24小时内咯血从100ml到1000ml不等,但广泛被引用的数字是24小时内出血在300~600ml[1~4]。预计肺泡间隙400ml血量显著抑制气体交换[5],并引起窒息性死亡而不是血容量丢失性死亡[6]。它是需要在诊断和治疗上认真对待的威胁生命的呼吸道急症。
(一)病因
|
1. 肺部疾病Pulmonary diseases
|
|
结核 Tuberculosis
|
|
曲霉菌病 Aspergilloma
|
|
肺炎 Pneumonia
|
|
支气管扩张症 Bronchiectasis
|
|
肺恶性肿瘤 Lung malignancy
|
|
慢性阻塞性气道疾病Chronic obstructive airways disease
|
|
肺脓肿 Lung abscess
|
|
囊性纤维化 Cystic fibrosis
|
|
结节病 Sarcoidosis
|
|
血管炎(Vasculitis):白塞氏病( Behçet’s disease), 韦格纳氏肉芽肿)Wegener’s granulomatosis)
|
|
心脏疾病 Cardiovascular diseases
|
|
肺动脉:动静脉瘘或畸形或动脉瘤 Pulmonary artery arteriovenous malformation/aneurysm
|
|
肺栓塞 Pulmonary embolism
|
|
肺动脉高压 Pulmonary hypertension
|
|
支气管动脉瘤 Bronchial artery aneurysm
|
|
胸主动脉破裂/夹层 Thoracic aortic aneurysm rupture/dissection
|
|
主动脉支气管动脉瘘 Aortobronchial fistula
|
|
Others
|
|
凝血功能障碍Coagulopathy
|
|
医源性(Iatrogenic): 抗凝 anticoagulation, 肺动脉导管(Swan-Ganz catheters)
|
|
创伤 Trauma
|
|
不明原因:有些咯血病人并不能发现病因,被定义为特发性或隐源性咯血(cryptogenic hemoptysis),被报告占咯血病人的4~42%。 |
(三)支气管大咯血的病理生理
肺有双重供血,包括肺动脉和支气管动脉。肺动脉占据肺供血的99%和负责气体交换。支气管动脉仅占肺供血的1%,其营养分支供应支气管,肺动脉和静脉的滋养血管以及发出支气管肺分支到肺实质[7,8]。在支气管和肺小叶水平的肺动脉与支气管动脉形成众多的吻合交通支[7]。这种交通所形成的生理上右到左分流占全部心输出量的近5%[8]。
当肺动脉循环遭到损伤的时候,如低氧性肺动脉狭窄、血管内血栓形成和血管炎时,支气管动脉会代偿增生,并逐渐替代肺动脉循环[8,9]。肺的慢性炎症也与支气管动脉的代偿相关,导致肺小动脉(pulmonary arterioles )异常交通增加[10,11]。炎症的过程释放血管源性生长因子( angiogenic growth factors),其促进新生血管和来自邻近体循环侧支血管的形成[12]。这些新生的血管壁薄和脆弱,在体循环压力下容易破裂到气道,导致咯血。预计肺泡间隙400ml血量显著抑制气体交换[5],并引起窒息性死亡而不是血容量丢失性死亡[6]。
支气管大咯血除了支气管动脉的来源还包括体循环来源和肺动脉来源的支气管大咯血...
(四)支气管大咯血的诊断
咯血病人最初临床评价的目标是出血源的定位和发现可能的病因。标准的诊断包括痰检查,支气管镜,胸片和胸部CT。
痰检查主要是细菌的培养,特别是分支杆菌和霉菌。对于吸烟超过40年的病人还需要痰查癌细胞[5]。
支气管镜是内科医生咯血定位和诊断的主要方法[5,13]。虽然柔软的细支气管镜检查得到更广泛的应用,而且不需要全麻下实施床边检查,并直接向出血源滴注血管收缩药物[5,14]。但硬支气管镜仍被推荐用于大咯血的病人,因为它能够保持主气道的开放。但气管镜定位出血源的诊断率<50%[4,15],并较少用于发现出血原因的诊断。气管镜的另外的缺点是用于气道内充满活动性出血,难于发现末梢气道的情况,在大多数情况下支气管内治疗无效[4,5]。
普通胸片:支气管大咯血在普通胸片的表现是大咯血原发病变的改变和出血改变。........。胸片是临床上较为容易获得的检查。可以帮助出血的定位和诊断肺实质的异常。但是胸片在一项回顾性分析中仅有50%的阳性率[1],在另一项研究中,几乎25%的继发于恶性肿瘤的咯血病人胸片表现为正常[2]。
CT扫描:CT被证实诊断咯血相关疾病方面有相当的价值,可以定位出血来源在63%~100%之间[3,4]。联合CT与气管镜阳性率进一步增加[1]。单排螺旋CT的增强扫描能够显示支气管和非支气管的体循环动脉,并发现血管性病变如熊主动脉瘤和动静脉畸形[5,6]。2003年的一项研究显示大咯血病人非支气管动脉来源诊断正确率为84%[22]。
MDCT已经不是很新的影像学技术。现代CT技术多采用螺旋扫描图像采集技术,以3~5ml/秒的速率注射浓度为320mg 碘/L造影剂80ml左右。由于扫描速度快,它可以在屏气的情况下进行全肺扫描,减少呼吸伪影,更精确地发现出血来源和原因。
从包括锁骨下区域和两侧锁骨下动脉及其分支的肺尖一直到肾静脉(L2~L3)包括腹腔动脉和肠系膜上动脉开口的部位。
CT血管造影技术可以通过将:
(1)最大密度投影技术(MIP)
(2)多平面/曲面重建技术(MPR/CPR)
(3)容积再现技术(VR)等后处理技术,并联合
(4)Add/Remove Structure
(5)任意角的旋转等功能,对患者的支气管供血血管进行三维解剖学特征重建【15,23】。,这些包括
(1)支气管动脉数目
(2)走形
(3)变异
(4)和病变之间的相互关系
另外,延迟二次图像采集还可以显示肺动脉影像。这些技术除了薄层或厚层扫描,几乎所有的技术都可以应用于大咯血的影像学分析,改善大咯血的临床治疗。这些技术包括:
(1)MPR(Multiplanar reformation)多平面重建
(2)2D-MIP(Maximum Intensity Projection)影像
(3)VRT(Volume-rendering technique)3D容积影像
(4)SSD(Surface Shadow Display)影像
(5)miniMIP(Minimum Intensity Projection)
CTA能够产生更为清晰胸主动脉血管、肺动脉(Khalil A,et al Chest 2008;133:212~219)(下图)和支气管动脉和非支气管动脉(Khalil A,et al AJR 2007;188:W117~125)并提高出血来源发现率和发现可能的病因。这些信息对于介入放射线科医生甚为重要,可以减少寻找支气管动脉在胸主动脉出口的时间,制定动脉栓塞计划。未来解析度更高的CTA技术有潜在发现来自于胸主动脉的脊髓大动脉,减少支气管动脉栓塞导致的脊髓损伤。
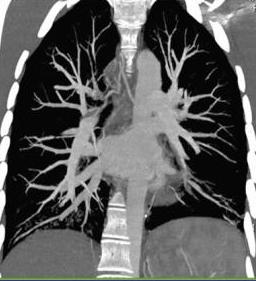
CTA的肺动脉2D MIP影像
2004年的一项研究也证实CTA比常规血管造影可以更清楚地显示支气管和非支气管[23]。相同的研究和其它的报告也显示在发现支气管动脉异位开口和其在纵膈和肺门走行(特别是迂曲增粗的情况下)3D影像优于2D[23~25]。进一步研究显示[26],CTA可以100%证实支气管动脉和62%非支气管动脉导致的大咯血。同样,CTA也可以发现肺动脉来源的出血,如Rasmussen 动脉瘤[27]。
MRI
支气管动脉造影
(五)支气管大咯血的治疗选择
咳血治疗的管理应包括初步复苏和支持措施,如对心肺参数进行监测,纠正缺氧,稳定血压,必要时进行血液制品的输注。在大量咳血的情况下,临床医生最愿意在重症监护室进行早期气管插管管理[1]。经支气管滴注如冷盐水或肾上腺素输注的解决方案,或使用气球导管压迫,或已被报道是不可靠的和作用有限的[1,2] 。
直到20世纪70年代,一旦支气管镜检查确认出血的部位,手术被认为是治疗大咯血的首选。文献报告的手术后死亡率各不相同,在7.1和18.2%之间,但紧急手术的情况下死亡率提高到40%[13,14]。在急性发作出血时进行外科干预承载着手术出血,窒息,,呼吸衰竭和支气管胸膜腔瘘等高风险 [15]。此外,相当比例的大咯血患者的是不适合外科手术,主要由于先前存在的伴发病和较差的呼吸储备功能。但是,手术仍是某些大咯血病人的选择,如医源性肺动脉破裂,胸部外伤,对曲霉菌治疗方法耐受的患者[16,17]。
选择性支气管动脉栓塞术已成为复发性咯血和大咯血治疗的成熟的血管介入技术 [3,3~12,25]。该治疗的原理是阻断体循环血流到炎症导致脆弱的血管,降低灌注压力和再出血的可能性[18]。在1960年代,首先对提肺循环的关注,由非选择性胸主动脉造影发现了支气管动脉的显影[19,20]。 1964年,Viamonte首次报告选择性支气管动脉导管及造影 [21]。由于以后的10年中,因脊髓缺血的报告导致这项技术进展缓慢。这是由于不慎阻塞发自于支气管动脉和肋间动脉的脊髓动脉,使用大口径导管的时候和使用离子型造影剂可加剧此种情形的发生[23-24]。这些报告促进了动脉供应脊髓血管造影技术的改进和进一步的评估。Remy等人在1974年首先通过选择性支气管动脉栓塞成功治疗咯血病人。自那时以来,许多作者证明了这一方法治疗咯血病人的疗效和安全性[8-12,25,26-29]。由美国胸科医师学院(American College of Chest Physicians)的调查显示,多数胸科医师的青睐介入放射学处理支气管大咯血[1]。
支气管动脉栓塞( Bronchial artery embolization ,BAE)作为可选择的治疗手段被认为是治疗大咯血和复发性咯血的最有效的非外科治疗。作为主要的治疗手段或外科手术前稳定病人情况扮演着重要的角色。所以对于内科保守治疗后复发的大咯血,一线治疗手段是支气管动脉栓塞术,以及之后的外科手术治疗或观察随访。
(六)大咯血的动脉栓塞治疗
1. 概述
2. 大咯血的相关动脉解剖
3. 大咯血栓塞适应症:
(1)急性大咯血:24小时内咯血300-600mL被定义为大咯血,其保守治疗的死亡率高达50-85%,为了减少潜在窒息,故一直以来是支气管动脉栓塞的主要适应征。
(2)外科术前栓塞:尽管对于孤立病变及有足够肺功能储备的患者,手术切除是首选治疗。一些证据表明有活动性出血的患者术前经支气管动脉栓塞可降低手术的死亡率。安全而迅速的经导管支气管动脉栓塞在技术上已很成熟。
(3)但对于慢性肺疾病及肺功能储备有限的患者,其手术风险难以承受,这组病人可能较适合姑息性的支气管动脉栓塞。
(4)中量咯血(一周内大于或等于三次咯血100mL/天):也被近期认为是经导管治疗的适应征。在囊性纤维化的患者中尤其易见反复的非大量咯血,使得其它肺区的引流能力减弱。对于轻到中度咯血,支气管动脉栓塞有较好疗效。
4. 术前准备
5. 技术
6. 支气管动脉栓塞并发症
7. 疗效评估
8. 术后观察
(七)小结
1. Fernando HC, Stein M, Benfield JR et al (1998) Role of bronchial artery embolization in the management of hemoptysis. Arch Surg 133:862–866
2. Ferris EJ (1981) Pulmonary hemorrhage. Vascular evaluation and interventional therapy. Chest 80:710–714
3. Marshall TJ, Jackson JE (1997) Vascular intervention in the thorax: bronchial artery embolization for haemoptysis. Eur Radiol 7:1221–1227
4. Yoon W, Kim JK, Kim YH et al (2002) Bronchial and nonbronchial systemic artery embolization for life-threatening hemoptysis: a comprehensive review. Radiographics 22:1395–1409
5. Jean–Baptiste E (2000) Clinical assessment and management of massive hemoptysis. Crit Care Med 28:1642–1647
6. Crocco JA, Rooney JJ, Fankushen DS et al (1968) Massive hemoptysis. Arch Intern Med 121:495–498
7. Pump K (1972) Distribution of bronchial arteries in human lung. Chest 62:447–451
8. Deffebach ME, Charan NB, Lakshminarayan S et al (1987) The bronchial circulation: small but a vital attribute to the lung. Am Rev Respir Dis 135:463–481
9. Malik AB, Tracy SE (1980) Bronchovascular adjustments after pulmonary embolism. J Appl Physiol 49:476–481
10. Ferris EJ (1981) Pulmonary hemorrhage. Vascular evaluation and interventional therapy. Chest 80:710–714
11. Marshall TJ, Jackson JE (1997) Vascular intervention in the thorax: bronchial artery embolization for haemoptysis. Eur Radiol 7:1221–1227
12. McDonald DM (2001) Angiogenesis and remodeling of airway vasculature in chronic inflammation. Am J Respir Crit Care Med 164:S39–S45
13. Dweik RA, Stoller JK (1999) Role of bronchoscopy in massive hemoptysis. Clin Chest Med 20:89–105
14. Najarian KE, Morris CS (1998) Arterial embolization in the chest. J Thorac Imaging 13:93–104
15. Hsiao EI, Kirsch CM, Kagawa FT et al (2001) Utility of fibre-optic bronchoscopy before bronchial artery embolization for massive hemoptysis. AJR 177:861–867
16.
| 

