第六章 介入基本技术
第四节 球囊成形术
任务:考题 20题,PPT制作 20张 考试教纲:掌握 PTA的机理、适应证、禁忌证、术前准备、操作步骤、术后处理原则、 并发症及预防、再狭窄机制、临床应用
1. 名词和定义
球囊成形术,又称球囊扩张术(Balloon Dilation)是指在医学影像设备的引导下,将球囊导管置入入人体内腔器官狭窄病变处,通过注射造影剂膨胀球囊并对狭窄病变实施扩张以恢复其生理内腔的过程。目前广泛应用于血管和非血管介入治疗领域。
血管成形术(angioplasty)是指将血管内狭窄的病变消除的血管治疗的技术。经皮血管成形术(percutaneous transluminal angioplasty,PTA)是应用Seldinger 经皮血管穿刺技术,在DSA(数字减影血管造影)引导下,球囊导管经导丝引入到血管狭窄的部位后,通过向注射造影剂使球囊扩张,增加血管内腔直径以达到恢复血流的目的。有时这一技术也被称为球囊血管成形术(balloon angioplasty)。主要用于各种原因导致的周围血管狭窄性病变,冠状动脉病变,主动脉病变以及心瓣膜狭窄病变等。
非血管介入治疗领域内的球囊成形术的基本原理与血管成形术相似。临床上主要用于扩张气管,食道和胃肠道,胆道以及泌尿系统的狭窄性病变。
2. 历史
经皮血管成形术最初是由美国医生Charles Dotter(1920-1985)在1964年阐述的[1]。当时Dotter医生应用自制的逐渐变细的聚四氟乙烯塑料共轴导管,经皮穿刺股动脉后在导丝的引导下,对一位82岁拒绝截肢女性患者的股浅动脉局限性严重狭窄实施扩张。术后患侧肢体严重缺血、疼痛和足趾坏疽得到完全缓解。直到2年半后病人死于肺炎时,扩张的动脉仍保持通畅。Dotter 医生通常被称为“介入放射学之父”,并获1978年诺贝尔医学奖提名。
在Dotter介绍了经皮腔内血管成形术(PTA)后的约十年时间里,这种逐渐变细的聚四氟乙烯共轴扩张导管的技术对可治疗的血管大小有非常实际的限制。血管直径越大,所需要的导管直径也越大。这就意味着需要把经皮穿刺部位扩张得相当大才能治疗较大动脉病变,结果当然就是穿刺部位发生并发症的危险就更大,特别是血肿和假性动脉瘤形成的危险。除了对大小的限制,共轴导管相对的不灵活限制了它只能在特定的解剖区域导入并治疗。用当时的扩张导管到达肾动脉是非常困难的,而到达冠状动脉病变部位更是难以想象的。共轴扩张导管法不仅对病变部位的血管壁施加径向扩张力,同时也产生一种非常不利的剪切力。Dotter 和 Judkins 在他们的实际操作中很早就意识到这个问题,并预测将来可能发展出一种径向膨胀的球囊扩张导管来治疗包括冠状动脉、肾动脉和颈动脉狭窄。这些想法就是早期PTA球囊的前奏。
直到1974年,Andreas Gruentzig (1939–1985)提出并发明了经皮经腔球囊血管成形术(Percutaneous Transluminal Balloon Angioplasty, PTBA)。这是一个由聚氯乙烯材料制成的双腔导管。它克服了早期血管成形术导管僵硬和剪切力对血管内膜的损伤,并以较小的剖面进入血管后,用造影剂充盈球囊使其在靶病变区产生较大的扩张直径。术后可通过回缩球囊顺利撤出体外。Gruentzig医生于1977年9月完成了人类首例经皮冠状动脉成形术。目前该项技术已经在几乎所有血管领域里成为治疗动脉狭窄或阻塞性疾病的方法中最有价值的一项微创技术。
3. 血管成形术的病理变化和基本原理
PTA的目标是通过球囊扩张形成的对动脉壁的压力超过了含有斑块的血管壁的抗张强度来重建血管的生理腔隙的直径。Gruntzig 把 PTA 称为“有控制的损伤”。关于球囊血管成形术的机制有不同的观点。Casteneda-Zuniga 和他的同事在1980年提出了目前普遍接受的PTA的机制。他们对PTA血管扩张后和组织修复过程的组织学分析表明,球囊扩张引起的主要的病理学变化是发生在内膜和中层。
内膜在扩张后最初内皮层撕裂,暴露了破损的内弹力层。血小板10分钟内聚集在损伤的内膜上。30分钟内血小板细胞脱颗粒(degranulation),一周时,新生内膜开始形成,1-2月损伤表面完全再内皮化。内弹力层的修复此时并没开始。 中层是由弹性蛋白,胶原蛋白和肌纤维组成。球囊扩张后的中层过度延展和撕裂,中层各种成分的广泛破坏,同时也失去弹性。特别是肌细胞的损伤,它们的细胞核在组织学上的破坏,提示这是一种持久的损害。经过3天,来自损伤和死亡的肌细胞的碎片被清除。在第一周的末期,中层以肌纤维母细胞浸润的形式重建中层,以此基础上发生新的肌细胞形成和胶原增生。这一过程持续3-6个月。球囊充分的扩张到中层的破裂仅存留浆膜保护血流通过。这种情况下中层由疤痕修复愈合。
球囊扩张血管机理示意图 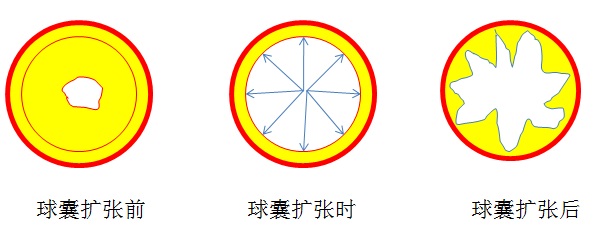 血管扩张的机理是充盈的球囊压力首先使斑块被压缩,接下来造成了狭窄区血管壁内、中膜局限性撕裂。血管壁特别是中膜过度伸展以及动脉粥样斑的断裂,从而导致血管壁张力减退和腔径的扩大。 PTA的目标是通过球囊扩张形成的对动脉壁的压力超过了含有斑块的血管壁的抗张强度来重建血管的生理腔隙的直径。只有那些有明显的血流动力学改变的造成临床症状的病变才被视为血运重建的适应证。PTA 不提倡扩张临床上无症状的病变来预防最终的完全阻塞,这会造成今后处理上的困难。 由于各种血运重建技术的快速发展,有关常规PTA技术最合适的适应症逐渐变得困惑起来。PTA在血管支撑架或血管外科手术中的相对角色也渐渐地模糊起来。目前总的来说PTA的适应症与慢性阻塞病变的血管形态和病因相关。 就动脉病变形态来说,球囊血管成形术适合非钙化病变、<2cm的短段病变、单一病变(非多发病变)、同轴心狭窄病变(非偏心狭窄病变)、非阻塞性病变和非开口狭窄病变(包括分叉部位病变)。如肾动脉中段局限性狭窄病变、股浅动脉<2cm孤立性狭窄病变等。决定是否采用PTA治疗最重要的是基于临床的评估而不仅仅是病变解剖的状况。对于如下肢动脉狭窄导致的轻度或部分中度的间歇性跛行病人,采取保守治疗一段时间后,根据是否病情缓解再考虑是否进一步包括PTA在内的其它治疗方法。 和病因相关的PTA适应症包括肌纤维增生不良性、动脉炎性、移植肾动脉、肾透析通道以及支撑架内的狭窄等。在这些疾病导致的动脉血管狭窄在初始治疗的情况下首先考虑PTA治疗,一旦治疗失败仍然考虑进行动脉支撑架的植入。 仅10年来由糖尿病导致的膝以下动脉的血管病变尽管病变较广泛甚至阻塞,也考虑采用小直径的长球囊扩张治疗,取得一定的疗效。 5. 球囊血管成形术的禁忌症 一般来说球囊血管成形术的禁忌症包括全身情况相关、血管形态相关和特殊血管相关禁忌症。 (1)无症状的血管性狭窄或阻塞性疾病 (2)病人全身情况不稳定 (3)不可纠正的凝血障碍 (4)全身或病变局部及入路部位感染或炎症时均为PTA的禁忌症。如大动脉炎活动期的肾动脉狭窄等。 (5)长段的阻塞病变、严重的钙化病变、多发血管、伴有动脉瘤病变或弥漫性血管病变。 (6)PTA特殊血管相关病变的禁忌症如颈动脉或椎动脉阻塞性病变,远端流出较差的股动脉狭窄或同侧患肢严重坏疽,膈肌脚(Arcuate ligamen)压迫导致的腹腔动脉狭窄等。 (7)患者对PTA治疗不合作、精神障碍也被视为实施PTA的禁忌症。 (8)碘过敏 6. 球囊导管成形术的术前准备 是指决定PTA直至治疗开始之前一段时间的临床处置。目的在于提高手术的安全性和病人的耐受性,避免和减少PTA治疗的并发症。不同患者或/和血管的PTA术前准备要求各不相同。术前准备的内容包括患者的心理准备和医学准备。 所谓心理准备是由于绝大多数患者术前都存在有不同程度的紧张、焦虑甚至是恐惧。需要医护人员给予充分的心理指导,使病人了解有关PTA治疗的知识和简单过程,PTA术中可能出现的感觉,帮助患者克服惧怕心理。获取病人对医生的信任和最佳心身状态。 医学准备包括术前准备、术前一日准备和手术当日准备。 1. 术前准备: (1)详细的病史采集和体格检查:病史采集和体格检查是诊断血管性疾病诊断的重要依据之一。如下肢动脉缺血往往有间歇性跛行,下肢溃疡、足背或/和胫后动脉搏动消失等。进一步检查包括无痛行走距离和多普勒踝肱指数等。考虑到许多血管疾病是全身性疾病所导致的,在检查某一处血管疾病时,应考虑其它血管是否同时受累。正确的病史采集和体格检查可决定患者是否需要进行血管内治疗。 (2)实验室检查:应进行的实验室检查包括血常规、肝肾功能以及凝血参数。当计划施行肾动脉和髂动脉的PTA时,推荐进行血型检查,因为存在血管破裂的危险性。实验室检查往往决定进行PTA手术的安全性。凝血功能障碍或纠正后的凝血酶原时间活动度小于40%被认为是施行PTA的禁忌证。肌酐水平的检查反映肾脏对于造影剂耐受性。 (3)影像学检查:对于被治疗的血管应包括一次完整的血管解剖评估。如下肢动脉的PTA应包括主动脉下端,髂动脉,和股动脉国动脉,以及下肢动脉,一直达到足背动脉和脚掌弓,以分析病变及其流入流出道。 在过去这种评估意味着进行一次经皮动脉造影,现代影像技术已经可以通过CT血管造影(CTA)或MRA等无创伤完成整个下肢动脉的评估。术前影像学检查的主要的目的是对血管性狭窄病变进行病因诊断、确立是否是PTA适应症、计划手术方案和估计预后。 (4)术前3日可考虑服用阿司匹林100mg/日;不需要预防性抗菌素的应用。 2. 术前一日准备 (1)糖尿病患者和那些肌酐水平大于1.5mg/dL的临界肾功能者按照所准备的在操作前后进行普通生理盐水(NSS)静脉内水化12小时。 (2)最后获取凝血功能障碍被纠正的情况。来自外科经验的推荐可能并不适合介入治疗的操作,因为前者在开放手术的直视情况下有利于获得控制出血的能力。当介入治疗的位置不容易评估或难以在影像引导下控制(如经皮肠系膜动脉的PTA治疗),任何术后出血的延时发现都会使病人危险增加。 (3)相关准备还包括心律失常病人的调整,存在左束支传导阻滞的病人需要心内科大夫充分准备,必要时应考虑术中临时起搏器置入。 (4)PTA操作是无菌性操作,除非存在可能的感染因素,一般不考虑术前预防性抗生素的应用 (5)必要时给以镇静剂保证病人充分的睡眠。 3. 术前当日准备 (1)一般术前4~6小时禁食水 (2)PTA多数情况下是清醒镇静下操作。送至导管室之前,在病人的病房内给予肌肉内镇静剂或麻醉镇痛药的做法不应该视为正确的,因为病人不可能被充分监测。相反的做法是病人进入导管室基础生命体征被监测后给予镇静药物。 (3)潜在复杂的PTA操作或老年人应考虑导尿管置入。 (4)建立静脉通路以备不时之需。 4. 获取病人或家属签字知情同意书 7. 球囊血管成形术的技术步骤 (1)穿刺技术:包括动脉seldinger法经皮穿刺和鞘管置入的选择。目前市场上穿刺针的有包括18G金属针、塑料套管针穿刺套件和微穿刺套件供应。操作者可根据不同动脉和经验进行选择。根据PTA 靶血管部位和入路的不同而选择不同的引导导管。选择引导导管目的保证绝大多数导丝、导管和PTA球囊的操作力度被引导至病变血管。如经股动脉入路进行肾动脉局限性狭窄PTA时,可考虑选择6~8F肾动脉引导导管。经股动脉狭窄锁骨下动脉狭窄PTA考虑多用途的、长的引导导管。经股动脉对侧下肢动脉PTA时选择专用的可跨越主动脉分叉的引导导管,或长的金属鞘管。引导导管内径需保证球囊导管顺利通过,一般需要比球囊导管大1F以上,例如选择5F球囊导管需要6F~8F引导导管。 PTA治疗属于简单介入治疗操作。一旦鞘管插入,静脉团注3000单位肝素。 (2)入路的选择:目前经股动脉逆行穿刺入路可以完成大多数血管的经皮腔内治疗,如头臂干、颈动脉和肾动脉的PTA,除非穿刺部位的股动脉病变可考虑经肱动脉入路。双侧髂动脉闭塞性病变也考虑经肱动脉入路,为选择90cm长的6-7F长鞘作为引导导管。双侧髂动脉分叉病变则需要双侧股动脉穿刺以使被放置在主动脉分叉两侧的球囊能够同时扩张(kissing balloon technique)。顺行股动脉穿刺治疗同侧血管病变往往由于对侧股动脉-髂动脉有严重病变时。 (3)过狭窄和阻塞技术:导丝导管通过狭窄病变是PTA技术成功的关键。一旦鞘管或/和导管在导丝的引导下抵近靶血管病变的近端时,需要注射造影剂以获得阻塞病变的血管影像,包括通过延长图像的采集时间,使通过侧支循环病变远端主干血管显影。这对于操纵导丝沿正确的方向前进是很有帮助的。同时根据病变的长短和多少判断是否为PTA的适应症。 通常"J"形亲水导丝很容易通过狭窄的血管病变。而让导丝导管通过阻塞性病变并非都顺利。在获取阻塞病变的“路图”(road map)影像后,一般使用直头普通血管造影导管或椎动脉导管抵近病变做为支撑,将导丝头伸出导管,在“路图”的引导下通过旋转导丝和推进导丝导管,仔细地穿过阻塞病变。导丝在“路图”监视下走行在阻塞远端的血管主干中提示成功。有时导丝不能正确进入远端血管腔,而在内膜下层的夹层中前行,此时应考虑放弃PTA,改行支撑架植入。 对于导丝导管不能通过的阻塞性病变可考虑从阻塞另一端入路尝试通过,如经肱动脉穿刺逆行通过锁骨下动脉阻塞,经腘动脉或足背动脉、胫后动脉穿刺通过股动脉阻塞病变。 (4)球囊导管的选择和扩张: 导丝通过病变后,球囊导管通过导丝在透视下引导下进到靶病变血管位置。精确的定位是通过球囊上的标志。现代球囊扩张导管,能承受高压,剖面小,扩张后的直径大,5到7F球囊导管,膨胀后球囊直径3至12mm,球囊长度2至10cm。
被选择的球囊的直径应与被治疗血管的直径相适应。直径的测量位置应选择在病变的末端或以对侧血管为参考。动脉的直径测量可在数字减影设备上应用特殊设计的DSA软件进行。考虑到扩张后动脉壁会发生弹性回缩,球囊扩张直径应超出血管直径的10-20%。如果球囊的直径和被治疗的血管直径一样大,血管壁的弹力不会被超越,这将导致病变的扩张后立即缩窄。过度扩张导致血管内膜或中层过度损伤也会导致再狭窄率的增加。
球囊的长度:应该和病变的长度相适应。特别长的病变可以用10mm长的球囊扩张。否则球囊必须分段扩张整个病变。 如果选择过长的球囊扩张短病变可能导致正常血管壁损伤增加再狭窄的机会。
球囊扩张时间应该持续到20秒,当病人不能忍受疼痛时停止扩张。因为疼痛是由于球囊过度扩张血管浆膜引起的,由于有血管破裂的危险,疼痛不应超出可以忍受的范围。所以疼痛是球囊直径选择是否合适的一个重要的指标。如果病人不感觉痛,球囊可以进一步膨胀或球囊的直径太小。当病人不能够忍受的疼痛时,球囊的压力应减少。如果病人表现为对疼痛特别的敏感,停止扩张球囊让病人休息。一般长球囊扩张时的疼痛较短球囊剧烈。因此,建议用短球囊处理短的残余狭窄。
对于特别坚硬的狭窄,如PTA后的再狭窄,血液透析的分流通道,或支撑架内的狭窄,扩张时间可以持续5分钟或更长才能够完全使血管再开放。因为PTA治疗血液透析分流通道时病人非常的疼,所以可以在皮下的病变血管壁周围进行局部麻醉。发生在人工动静脉瘘的静脉部分狭窄很坚实,有时近20个大气压的特殊的球囊。用5ml注射器可以手工得到8个大气压的压力。为了得到高于该水平的压力,必须使用有着气压计的特制的注射器。
目前市场上多为非顺应性球囊即一旦球囊到达其名义上的直径,再增加压力不会使球囊的直径进一步增加。球囊爆破压(Rated Burst Pressure): 指反复充盈球囊40次后,在此压力下99%的球囊不会破裂。此为球囊导管的重要标示,为术者提供一个安全的充气压力范围。目前生产的大多数球囊爆破压(RBP)在 4~20 atm 之间 ,球囊越大,球囊爆破压越低。在血管扩张中尽量不要超过球囊爆破压。
(5)疗效评估:扩张后球囊导管回缩并从治疗的部位撤除。通过导管鞘注射造影剂进行对比血管造影,若残余狭窄<30%,血流通畅,局部没有血管夹层,远端造影没有栓塞提示PTA技术成功。若残余狭窄>30%,决定重复扩张或采用支撑架植入。
8. PTA术后处理原则 (1)穿刺部位的处理:PTA经皮动脉穿刺和鞘管置入破坏了入路血管的完整性。术后鞘管的拔除有发生局部出血、血肿、动静脉瘘、假性动脉瘤甚至血栓形成和动脉栓塞等可能。目前为了防止局部穿刺部位并发症的发生可采用穿刺局部的加压包扎、器械压迫和血管闭合装置的方法。取决于应用穿刺鞘的大小和危险因素,局部加压包扎和器械加压包扎需要病人肢体制动12-24小时,期间需密切观察局部是否有出血和肢体缺血情况,包括肢体动脉搏动和皮温的情况。对于肥胖病人,凝血状态差以及不合作的病人考虑应用血管闭合装置。 (2)直径较大血管PTA,术后血流速度快动脉或许不需要注射肝素。 (3)抗血小板治疗:PTA术后的病人可能导致病变部位急性血栓形成,这是由PTA 触发的血栓并发症。术后口服阿司匹林100mg/日,对于动脉硬化狭窄的患者可考虑终身服用。再阻塞或再狭窄的高危患者可考虑双抗治疗即氯吡格雷75mg/日,持续服用4周。 (4)定期随访 9. PTA并发症及预防
1)穿刺部位的并发症,总发生率为4%。包括穿刺部位血肿、假性动脉瘤形成和动静脉瘘形成,其发生率分别为3.4%、0.5%和0.1%。其危险因素包括病人对术后制动不配合,股深动脉穿刺、高血压、凝血障碍、便秘、排尿障碍和咳嗽等高腹压原因。应该针对穿刺部位并发症各种危险因素进行不同的处理。如果动脉瘤出现可以考虑人工盲压迫、超声引导下的机械辅助压迫和超声引导下瘤腔内凝血酶注射。而出现股动脉和股静脉之间的瘘最好的办法是外科手术缝合瘘口。
2)血管成形部位远端血管栓塞:是指动脉狭窄/闭塞病变在球囊扩张时可能导致血栓、钙化斑块以及胆固醇栓子等脱落造成远端的动脉栓塞。其发生和狭窄病变的性质相关,如严重钙化或严重狭窄病变。静脉血管成形术也可以引起血栓移位导致肺动脉栓塞。PTA栓塞的危险性取决于靶血管的位置和脱落栓子的大小。血管狭窄病变初始治疗就使用支撑架、PTA前后抗血小板治疗,使用远端保护装置以及下腔静脉滤器可以减少这些危险。 但远端血管栓塞并发症很少发生,并且发生后并不是所有病例都有症状。
3). 血管成形部位血管夹层:指由于球囊扩张后内膜局部撕裂,在血流的冲击下,内膜逐步剥离、扩展,在动脉内膜下内形成假腔。下肢动脉PTA术后小的夹层可以通过延长球囊扩张时间直到5分钟左右,使内膜夹层再一次和血管粘连在一起。对于影响血流的动脉夹层,或夹层导致残余狭窄大于30%,应考虑在夹层的血管植入支撑架以避免术后急性血栓形成或术后近期再狭窄。
4). 血管痉挛:由导丝和导管操作刺激引起。痉挛的发生会影响血管成形术的继续进行。往往在腘动脉、胫动脉常见等血管直径相对小的动脉出现。术前可以预防性应用血管扩张剂可以减少血管痉挛的发生。对已经发生的血管痉挛可在使用血管扩张剂后可以恢复。靶血管扩张剂的局部灌注效果更佳。 5). 血管穿孔:PTA时由于导丝导致的血管穿孔或不造成危险,取决于实际情况。如果导丝穿孔到腹膜后,而病人处于抗血小板或抗凝治疗可能导致严重的出血并发症。但如果导丝在一个灌注很差的情形下通过腘动脉远端穿孔,它的危险性较小。设想一下血管壁穿孔后,导丝可以撤回并再回到血管真腔。血管成形术可以通过恢复真腔,并将血管内膜挤到到穿孔部位从而使穿孔得到修复。
6). 血管破裂:PTA导致的血管破裂是即刻危及生命的严重并发症。因此,术前认真准备是必要的。首先选择与病变血管直径相适应的球囊导管,避免过度扩张导致血管破裂。同样需要准备的是与血管直径相适应的覆膜支撑架以备不时只需。对于有潜在破裂可能的病变如严重狭窄和钙化的髂动脉病变,过度迂曲的病变,最初就置入与覆膜支撑架规格相适应的血管鞘,以避免置换血管鞘的时间损失。扩张后通过狭窄病变的导丝不要撤出,除非影像学和临床体征除外血管破裂。
8) 再狭窄
血管成形术是对血管壁组织的一种损伤。对于这种损伤的修复是一个复杂的病理过程。包括初期的血小板在血管壁损伤表面血栓凝聚过程,伴随血液内和血管壁组织细胞生长因子和细胞因子释放。后期为血管壁细胞增殖迁移、细胞外基质的重新构建以及血管壁的重塑。这些过程往往导致PTA术后不同时期的血管腔的再狭窄。所谓再狭窄是指PTA术后的一段时间内,血管腔内径缩小到>50%,并最终引起血流动力学的变化。
急性期再狭窄:是指PTA术后立即发生或稍迟发生的血管狭窄或闭塞。主要原因包括血管痉挛、血管壁弹性回缩和血管夹层导致的血栓形成的形成。对于血管痉挛,在PTA前或术中积极地应用钙通道阻滞剂和硝酸甘油。如果是血栓考虑肝素和尿激酶抗凝和溶栓。支撑架是有血流动力学意义的夹层最好的治疗。
早期再狭窄:是指PTA术后1-12月内发生的血管狭窄或闭塞。主要原因是血管壁损伤后,血管内皮细胞的过度增生的反应(它并非特指血管成形术,外科血管手术后也会发生)和病变血管壁的弹性回缩。早期再狭窄是最常见的狭窄类型。Essed 等人首次提出这主要是由于中层的肌细胞(myocytes)暴露在血液中所引起的。并且确定动脉斑块切除导致的狭窄确定是内膜增生。斑块撕裂(disruption)引起局部血小板沉积(deposition)并释放血栓素A2(thromboxane A2)和血小板衍生的生长因子(platelet-derived growth factor)。血管内皮也释放内皮缩血管肽(endothelin),这是一个强有力的血管收缩剂、内皮生长因子(endothelium growth factor)和成纤维细胞生长因子(成纤维细胞生长因子)。这导致平滑肌细胞移位和增生与此同时纤维细胞组织累积,它们可以完全阻塞血管。
晚期再狭窄:发生在1年以上的再狭窄,主要是由于PTA后血管壁损伤的过度增生和原有病变的加重和发展。
再狭窄的预防主要包括抗凝和抗血小板凝集,技术和器械的改进以及支撑架的植入。 尽管支撑架技术在临床上得到广泛应用,但传统PTA 仍然应用于 (1)纤维肌增生不良性肾动脉狭窄; (2)非活动期大动脉炎肾动脉狭窄; (3)移植肾动脉狭窄的的初始治疗; (4)肾透析通道的狭窄 (5)支架内再狭窄 (6)膝以下动脉狭窄 |

